有机化学基础复习提纲
图片预览


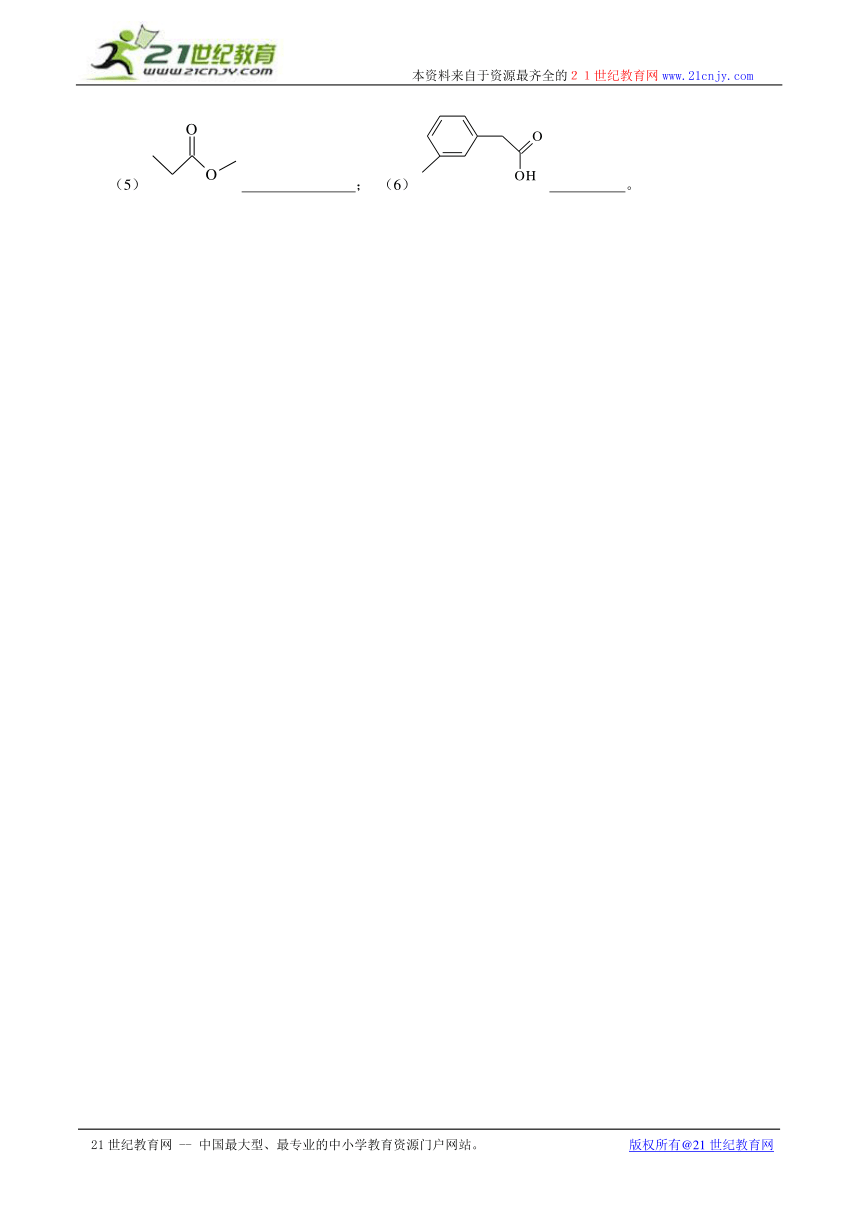

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
〈〈有机化学基础〉〉 复习提纲
专题1 认识有机化合物
(一)有机化学的发展与应用
1、18世纪初瑞典化学家_____提出了有机化学的概念。
2、打破无机物和有机物界限的化学家是____。
3、1965年 中国 世界上第一次人工合成蛋白质--结晶牛胰岛素
(二)科学家怎么样研究有机物
1、有机化合物:含____元素的化合物,(除____、____、____外)。
2、有机物中组成元素种类的确定
⑴燃烧法――-李比希法
一般来说,有机物完全燃烧后,各元素对应的产物为C→__,H→__。
欲判断有机物中是否含氧元素:
设有机物燃烧后CO2中碳元素的质量为m(C),H2O中氢元素质量为m(H)。若
m(有机物)__m(C)+m(H)→有机物中含有氧元素
m(有机物)__m(C)+m(H)→有机物中不含氧元素
⑵其它常见的元素测定方法
①钠融法可定性确定有机物中是否存在_____等元素
②铜丝燃烧法可定性确定有机物中是否存在_____。
③元素分析仪可同时对_____等多种元素进行分析。
3、有机物分子式的确定
(1)直接法(物质的量法):直接求算出1mol有机物中各元素原子的物质的量,即可确定分子式。
例:1、充分燃烧0.10mol气态烃,生成0.40molCO2,0.30molH2O。求此烃分子式
(2)最简式法:根据有机物中各元素的质量分数(或元素的质量比),求出该有机物的最简式,再根据其相对分子质量求n的值,即可确定分子式。
例2:实验测得某碳氢化合物A中含碳80%,含氢20%,又测得该化合物相对分子质量30。求该化合物的最简式和分子式。
例3:某烃经测定其相对分子质量为56。取该有机化合物样品5.6g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重7.2g和17.6g。试求该有机物的分子式。
4、有机化合物结构的研究
(1)从H1核磁共振氢谱(1H-NMR)中上可以推知该有机物分子有几种不同类型的__原子及它们的数目。
氢原子类型=___数目 吸收峰的面积之比___不同氢原子的个数之比
(2)通过红外光谱可以推知有机物含有哪些_______。
(3)质谱法可确定_______。
专题2 有机物的结构与分类
(三)有机化合物的结构
1、有机物中碳原子的成键特点
①在有机物中,碳呈 价,碳原子总是形成__个共价键。
②在有机物分子中,仅以___键方式成键的碳原子称为饱和碳原子;连接在双键、叁键或在苯环上的碳原子(所连原子的数目少于4)称为____碳原子。
③C—C单键可以旋转而C=C(或三键)不能旋转。
2.碳原子的成键方式与分子空间构型的关系
(1)当一个碳原子与其它4个原子连接时,这个碳原子将采取______取向与之成键;当碳原子之间或碳原子与其它原子之间形成双键时,形成该双键的原子以及与之直接相连的原子处于____上;当碳原子之间或碳原子与其它原子之间形成叁键时,形成该叁键的原子以及与之直接相连的原子处于____上。
(2)有机物的代表物基本空间结构:甲烷是____结构(5个原子不在一个平面上);乙烯是____结构(6个原子位于一个平面);乙炔是____结构(4个原子位于一条直线);苯环是____结构(12个原子位于一个平面)。
拓展应用:有机分子空间构型解题规律
规律Ⅰ:以碳原子和化学键为立足点,若氢原子被其它原子所代替,其键角基本不变。
规律Ⅱ:若两个平面型结构的基团之间以单键相连,这个单键可以旋转,则两个平面可能共面,但不是“一定”。
规律Ⅲ:若两个苯环共边,则两个苯环一定共面。
规律Ⅳ:若甲基与一个平面型结构相连,则甲基上的氢原子最多有一个氢原子与其共面。若一个碳原子以四个单键与其它原子直接相连,则这四个原子为四面体结构,不可能共面。同时,苯环对位上的2个碳原子及其与之相连的两个氢原子,这四原子共直线。
3、有机物结构的表示方法
(1)结构简式书写:
不能用碳干结构表示,碳原子连接的氢原子个数要正确,官能团不能略写,要注意官能团中各原子的结合顺序不能随意颠倒。
(2)键线式:
将__、__元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有一个___原子,称为键线式。每个交点、端点代表一个__原子,每一条线段代表一个__,每个碳原子有四条线段,用四减去线段数既是__原子个数。注意事项:
(a)只忽略C-H键,其余的化学键不能忽略;
(b)必须表示出C=C、C≡C键等官能团
(c)碳氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中氢原子)
(d)计算分子式时不能忘记顶端的碳原子。
有机化合物结构的表示方法
电子式 结构式 结构简式
键线式
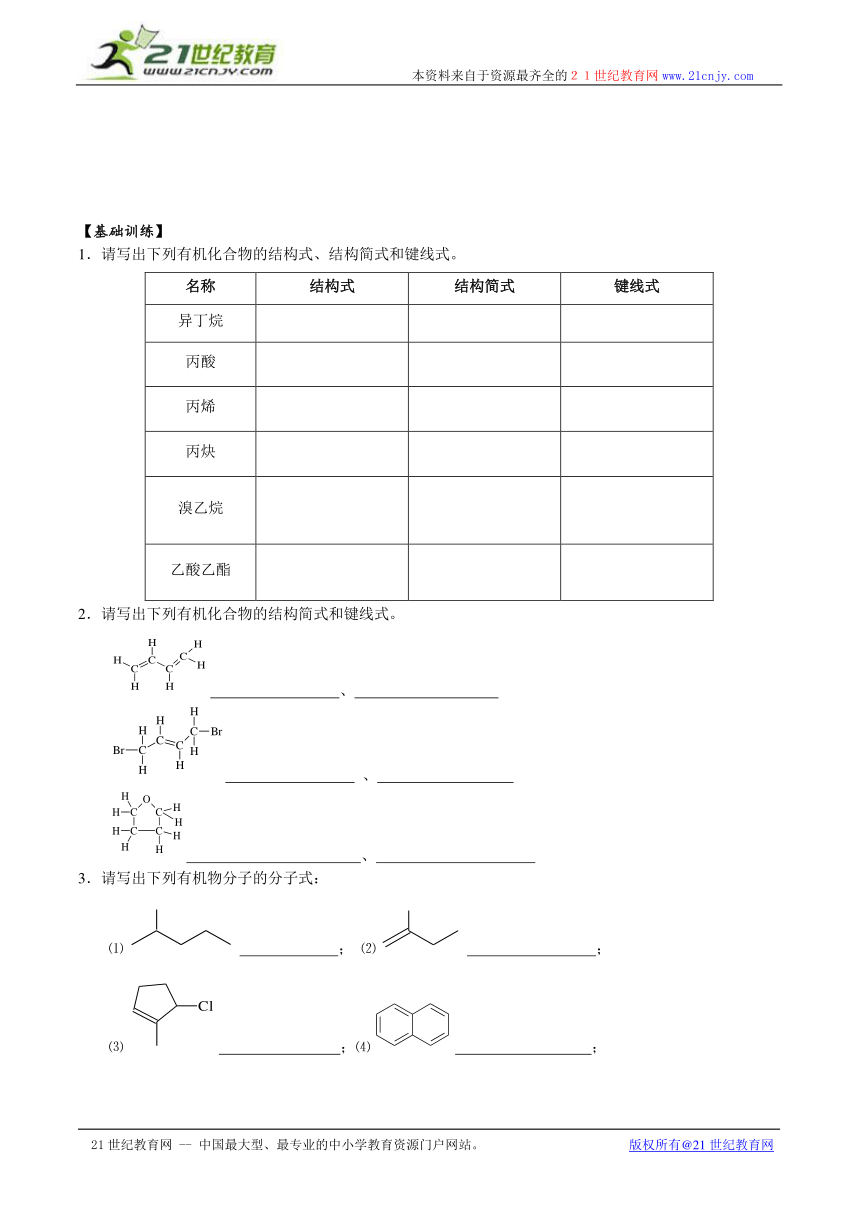
【基础训练】
1.请写出下列有机化合物的结构式、结构简式和键线式。
名称 结构式 结构简式 键线式
异丁烷
丙酸
丙烯
丙炔
溴乙烷
乙酸乙酯
2.请写出下列有机化合物的结构简式和键线式。
、
、
、
3.请写出下列有机物分子的分子式:
⑴ ; ⑵ ;
⑶ ;⑷ ;
(5) ; (6) 。
3、同分异构体与同系物
同分异构体的特点:____相同,_____不同。
同系物:___相似,组成上相差一个或若干个____的有机化合物。
4、同分异构体的常见种类
①碳链异构:分子中__原子的排列顺序不同而产生的异构。例:
②位置异构:分子中官能团(包括双键或三键)或取代基在碳链上的位置不同而产生的异构。例:
③类别异构:分子式相同,由于分子中官能团不同而分属不同类物质的异构。例:
5、烷烃同分异构体的写法
①主链由长到短 ②支链由整到散
③位置由心到边(一边走,不到端,支链碳数小于挂靠碳离端点位数。 ),
④排布对、邻、间。
6、等效氢原子确定的规律
同一碳原子上的氢原子完全等效;
与同一碳原子相连的甲基上的氢原子完全等效。
结构对称的碳原子上的氢原子完全等效。(通过寻找对称轴或对称中心进行分析。)
(四)有机物的分类和命名
1、分类
官能团符号 官能团名称 典型有机化合物 物质名称 所属类别
烯
炔
卤代烃
醇
酚
醛
羧酸
2、有机物的命名
(1)有机物中的基
如果失去氢原子的烃是烷烃,剩余的原子团就叫做_________。例如,甲烷分子CH4失去一个氢原子后剩余的________部分叫做甲基,乙烷CH3CH3分子失去一个氢原子后剩余的_________部分叫做乙基
(2)习惯命名法:(普通命名法)
习惯命名法在命名简单有机化合物时比较方便。如对烷烃的命名,其中碳原子数在10以内时,用天干—____、____、____、____、____、____、____、____、____、____表示;大于10时,则用中文数字十一、十六等来表示。同时为了区别同分异构体,在名称前面加“____、____、_____”等冠词。
例如C5H12的3种同分异构体命名:
_______________________, ____________________, ___________________
(3)系统命名法:
①选母体。选定分子中_________的碳链做主链,定为某烷。
②编序号。把主链里____________一端作起点,给主链的碳原子编号以确定支链的位置。
③写名称。把支链作取代基,名称写在烷烃名称前,用________注明它在主链上的位置,中文和数字间用_________隔开。
例:
___________________________________________
④如果有相同的取代基,可以合并起来用二、三等数字表示,但表示相同取代基位置的阿拉伯数字用________隔开;如果几个取代基不同,就把_______写在前面,_______写在后面。例:
_______________________________, ____________________________________
⑤如果有两种以上选择主链的可能性时,应选择_________的碳链为主链。如果支链数目也相同,应选择位次总和最小的碳链为主链。例如:
______________________________________
(4)几类烃的衍生物的命名:
⑴开链烃以及包含—C==C—、—C C—、 —CHO、—COOH、—OH、—SO3H、
—NO2、—NH2等官能团的化合物的命名。
步骤:①编号。通常选取其中包含官能团的最长的碳链为主链,从距官能团最近的一端开始编号。如果官能团相距两端一样近,则从支链较近的一端开始编号。
例:
__________________________________________
②命名。如果有两种以上的官能团,则以能进入主链的官能团为最后名称,而把主链上带有的其它官能团作为取代基。
例: ______________________________
其它规则同烷烃的命名。
例: ___________________________________
专题3 常见的烃
一、各类烃的代表物比较
代表物 结构简式 空间构型 化学性质
烷烃 甲烷
烯烃 乙烯
炔烃 乙炔
芳香烃 苯
二、“四同”概念比较
概念 同系物 同分异构体 同素异形体 同位素
研究范围
限制条件
三、链烃的结构和性质
烃 烷烃 烯烃 炔烃
结构特点
空间构型
特征反应
燃烧现象
酸性高锰酸钾
溴水
四、芳香烃的结构和性质
1、苯的组成和结构
(1)分子式:C6H6 (2)结构简式:
(3) 结构特点:平面正六边形结构,碳碳键介于单键和双键之间的独特的键。
2、苯的物理性质
没有颜色带有特殊气味的液体,密度比水小,不溶于水。熔、沸点较低。
3、苯的化学性质
⑴与H2加成
⑵跟Br2的取代
⑶硝化反应
(4)燃烧
4、苯的主要用途: (1)重要的有机化工原料 ,(2) 常用的有机溶剂。
5、苯的同系物 (以甲苯为例)
1 结构: CH3
CH3
2 性质
a. 取代反应
b.加成反应:与H2加成生成甲基环己烷。
c.被酸性高锰酸钾溶液氧化。
五、烃的燃烧规律
若烃的分子式用CxHy表示,烃完全燃烧的化学方程式可表示为:
CxHy+ O2 CO2 + H2O
专题4 烃的衍生物
一、烃的衍生物
1.定义:
2.分类:常见烃的衍生物有 、 、 、 、 、 等。
二、卤代烃对人类生活的影响
1.卤代烃的用途: 、 、 、 、 等。
2.卤代烃的危害:
(1)DDT禁用原因:
(2)卤代烃对大气臭氧层的破坏原理:卤代烃释放出的氯原子对臭氧分解起到了
的作用。
三、卤代烃
1.定义:
一卤代烃的通式: ;饱和一卤代烃的通式: 。
2.分类:
3.卤代烃的物理性质
a.聚集状态
b.熔、沸点变化规律
卤代烃的熔、沸点 (填“>”、“<”、或“=”)相应烃的熔、沸点
c.密度及水溶性规律
4.溴乙烷
(1)溴乙烷的物理性质:纯净的物理性质是 色的 ,沸点 ,易挥发,密度比水 , 溶于水,是 (填“电解质”或“非电解质”)
(2)溴乙烷的分子组成和结构
分子式 结构式 结构简式 官能团
(3)溴乙烷的化学性质
a.溴乙烷的水解反应 ( 反应)
实验步骤:1)、向大试管中注入5mL溴乙烷和15mL20%的氢氧化钾水溶液,现象:
2)、加热。现象:
3)、取大试管中反应后的少量剩余物于另一试管中,再向该试管中加入稀硝酸至溶液呈酸性,滴加硝酸银溶液。现象:
反应原理:
或:
[讨论]在滴加硝酸银溶液之前,为什么要加稀硝酸酸化溶液?
b.溴乙烷的消去反应
消去反应:
实验步骤:1)、向大试管中注入5mL溴乙烷和15mL饱和氢氧化钾乙醇溶液,加热。
2)、用排水法收集气体,并检验此气体。
3)、取大试管中反应后的少量剩余物于另一试管中,再向该试管中加入稀硝酸至溶液呈酸性,滴加硝酸银溶液。现象:
反应原理:
[讨论]1、乙醇在反应中起到了什么作用?
2、实验过程中发现有气体生成,请设计实验检验生成的气体是乙烯气体,画出实验装置图。
在滴加硝酸银溶液之前,为什么要加稀硝酸酸化溶液?
5.卤代烃的化学性质
(1)卤代烃发生水解反应时的断键情况
(2)卤代烃发生水解反应时的断键情况
注意:1)并不是所有的卤代烃都能发生消去反应。
卤代烃发生消去反应的条件:
2)溴乙烷的水解反应和消去反应,反应条件不同,产物不同。可用下列口诀记忆:“无醇则有醇,有醇则无醇”。
6.卤代烃的制法
(1)
(2)
7.卤代烃水解反应和消去反应的比较
水解反应 消去反应
反应条件
反应产物
反应实质
反应特点 有机物碳架不变,官能团有-X变为-OH,无副反应 有机物碳架不变,官能团有-X变为C=C或C=C,可能有副反应
四.醇 酚
1.醇的概念:___________________ _叫醇。
酚的概念:__________________________ ___叫酚。
2.乙醇
(1)乙醇的分子结构:
分子式:________ _ 结构式:___________
结构简式:___________或___________ 官能团:_______ __
(2)乙醇的物理性质
无色透明,有 ________味的液体,_______溶于水,易挥发。工业用酒精含乙醇约96%(体积分数),含乙醇99.5%以上也叫____________。
(3)乙醇的化学性质
a.羟基氢所发生的反应
①与Na的反应:CH3CH2OH + Na→
②与氧化剂的反应:(乙醇的催化氧化)CH3CH2OH + O2→
b.羟基所发生的反应
①脱水反应:
CH3CH2OH和浓硫酸混合加热到170℃____________________ ____ ___属于______反应
消去反应的概念:_____________________________________ _
CH3CH2OH和浓硫酸混合加热到140℃_______________________ ____属于______反应
②与氢卤酸(例HBr)的取代反应:_______________________________________ ___
③乙醇和乙酸的酯化反应:__________________________________________ _____
c.氧化反应
①乙醇使酸性KMnO4褪色
②乙醇和氧气燃烧:________________________________________现象:
(4)乙醇的工业制法
a.发酵法
b.乙烯水化法:
(5)乙醇的用途: ________的乙醇溶液用于医疗消毒。
3.醇
(1)醇的通式_________________ 饱和一元醇的通式
(2)醇的化学性质:
a.醇与钠的反应:CH3-CH-CH3 + Na→
b.与氢卤酸的反应:ROH + HX→
c.醇的催化氧化
+ O2 → + O2→
注意:醇发生催化氧化的条件:
d.醇的消去反应:
CH3CH2CH2OH与浓硫酸混合加热至170℃____________________________________
注意:醇发生消去反应的条件:
4.几种重要的醇
(1)甲醇 分子式___________,结构简式________,又名木精(源于木材干馏),有毒。
(2)乙二醇:结构简式______________,无色、粘稠、有甜味的液体,凝固点低。
HOCH2CH2OH + Na→
HOCH2CH2OH + O2→
HOCH2CH2OH与浓硫酸混合加热170℃________________________________________
HOCH2CH2OH与浓硫酸混合加热140℃___________________________________(环状)
用途:______________________________________ ________________________。
(3)丙三醇 :结构简式________________俗称_________,无色、粘稠、有甜味,吸湿性强。
用途:____________________________________________ ___________________。
5.苯酚(最简单的酚)
(1)苯酚的分子结构
分子式:_______________;结构简式:______________,所有原子 一个平面上。
(2)苯酚的物理性质
纯净的苯酚是____色有_____气味的_______,俗称 。露置在空气中因小部分氧化而显________,常温下在水中的溶解度 ,高于65℃与水以任意比例互溶,苯酚 溶于乙醇等有机溶剂。其浓溶液有腐蚀性,有毒,如不慎沾在皮肤上,立即用______擦洗,再用水冲洗。
(3)苯酚的结构特点:酚中的羟基和苯环相互影响
a.羟基受苯环的影响而使羟基中的氢容易电离出H+,而表现出 性;
b.羟基对苯环的影响,使苯环上的邻、对位上的氢被激活,而容易发生 反应。
(4)苯酚的化学性质
a.羟基氢的活泼性
①弱酸性: + NaOH→ 现象:__ ___
再向上述反应后的溶液中通入CO2,现象_______________________________,反应方程式________________________________________________________________________。
盐酸、碳酸、乙酸、苯酚、碳酸氢根离子的酸性强弱顺序:
b.取代反应: + Br2 → 现象___________________
(说明:本反应用于苯酚的定量和定性检测。)
c.显色反应
苯酚溶液遇Fe3+显示________色,利用这一反应也可作为苯酚的定性检测。
d.加成反应: + H2→
e.氧化反应:在空气中逐渐被氧化而显粉红色。
(5)苯酚的用途
苯酚是一种重要的化工原料,主要用于制造 (电木)等,还广泛用于合成纤维、医药、合成香料、染料、农药等。
苯酚的稀溶液具有消毒、杀菌的功效,药皂中常含有少量的苯酚。
酚醛树脂制取的反应方程式:
五.醛 羧酸
1.乙醛
(1)乙醛的组成与分子结构
分子式: ;结构简式: ;结构式: ;官能团: ;
(2)乙醛的物理性质
色、有 气味的 体;沸点: , 挥发、易燃烧;密度比水 ;溶解性: ,易溶于乙醇、乙醚、氯仿等溶剂。
(3)乙醛的化学性质
a. 氧化反应
Ⅰ银镜反应
①实验操作:a.银氨溶液的配制: ;
b.在银氨溶液中滴入3滴乙醛,振荡;
c.将试管放在 中加热。
②实验现象: 。
③涉及到的方程式: 、 、
。
Ⅱ与新制氢氧化铜反应
①实验操作:a.Cu(OH)2的配制: ;
b.在新制Cu(OH)2中加入0.5mL乙醛;
c.将试管放在 中加热。
②实验现象: 。
③涉及到的方程式: 、
。
Ⅲ被氧气完全氧化(燃烧)或催化氧化
CH3CHO + O2 ;CH3CHO + O2
b.还原反应(与氢气的加成)
CH3CHO + H2
2.甲醛
(1)甲醛的分子结构
分子式: ;结构简式: ;结构式: ;核磁共振谱上可以看到 个峰,空间构型为 ,甲醛分子结构中相当于含 个醛基。
(2)甲醛的物理性质
甲醛俗称 ,在通常状况下是一种 色、 气味的 体。有毒(它是室内空气污染源之一,如胶合板、油漆等); 溶于水,浓度在 的甲醛水溶液俗称 ,具有 性,可作 。
(3)甲醛的化学性质
a.氧化反应
银镜反应: ;
新制氢氧化铜反应: ;
氧气催化氧化: 。
b.还原反应 氢气加成: 。
c.与苯酚缩聚反应(制酚醛树脂)
n + n HCHO
3.醛
(1)醛类的结构可表示为 ,饱和一元醛的通式为 或 。
(2)醛基中碳元素的化合价为 价。
(3)醛基既有氧化性,又有还原性。
5.乙酸
(1)乙酸的分子结构
分子式 , 结构式 ,结构简式 ,官能团 。
(2)乙酸的物理性质
乙酸俗称 ,是一种 色、 味 溶于水的液体,当温度低于16.60C时为晶体,所以乙酸又称 。
(3)乙酸的化学性质
a.具有弱酸性,具有酸的通性:① ②
③ ④ ⑤
CH3COOH +
在稀醋酸溶液中滴加紫色石蕊溶液、碳酸钠溶液的现象分别是 、 ,有关方程式为 。
b.酯化反应: 。
+
CH3CH2OH + HO-NO2→
乙酸乙酯的制取实验
(1)浓H2SO4的作用:____ _(2)盛反应液的试管口要_____________________
(3)导管_______________ ______________________________ __________
(4)饱和Na2CO3的作用:______________ _________________________________________
(5)不能用Na0H代替Na2CO3,_______________________________________________________
6.羧酸
(1)羧酸的概念: 叫羧酸。
饱和一元羧酸的通式: 或
(2)羧酸的分类
(3)羧酸的酸性随碳原子数的增加而减弱,甲酸是一元羧酸中酸性最强的酸。
(4)甲酸
结构式: ,官能团: ,所以甲酸兼有 和 的性质。
a.具有羧酸的性质
b.具有醛的性质
7.缩聚反应:
对苯二甲酸和乙二醇作用形成高分子酯:
乳酸分子作用形成高聚物:
8.酯
(1)酯的概念: 叫酯。
酯的通式: 饱和一元羧酸酯的通式:
(2)酯的物理性质: 色 味的 ,密度 ,
溶于水,易溶于乙醇、乙醚。
(3)酯的化学性质
a.水解反应:酯在酸性或碱性条件下发生水解。
注意:甲酸某酯的特殊性。
专题5 生命活动的物质基础
糖类、脂肪、蛋白质、氨基酸
物质 葡萄糖 麦芽糖 蔗糖 淀粉 纤维素
组成
类别
结构
还原性
氨基酸分子的结构含________、__________官能团,具有______、________性质。
氨基酸在酸或碱的存在下加热,通过一分子的____基与另一分子的_____基间脱去一分子____,缩合形成含有肽键的化合物,叫做成肽反应。
茚三酮溶液中加入氨基酸溶液,显紫色。
蛋白质的性质
1:具有两性
2:能够水解
3:盐析:加浓的无机盐溶液〔如Na2SO4、(NH4)2SO4等〕,
4:变性:在热、强酸、强碱、重金属盐、甲醛、酒精、苯酚溶液、紫外线等作用下变性
5: 颜色反应
(1) 加浓硝酸变黄色
(2) 加双缩脲试剂显紫玫瑰色
1.有机合成的常规方法
(1)官能团的引入:
①引入羟基(-OH):烯烃与水加成;醛(酮)与氢气加成;卤代烃的碱性水解;酯的水解等;
②引入卤原子:烃与X2的取代;不饱和烃与HX或X2的加成;醇与HX的取代等。
③引入双键:某些醇或卤代烃的消去引入C=C;醇的氧化引入C=O等。
(2)官能团的消除:
①通过加成消除不饱和键;
②通过消去或氧化或酯化等消除羟基(-OH);
③通过加成或氧化等消除醛基(-CHO)
④通过消去或水解消除卤原子。
(3)官能团间的衍变:
①一元合成路线 R-CH=CH2 卤代烃→一元醇→一元醛→一元羧酸→酯
②二元合成路线:CH2=CH2→CH2X-CH2X
→二元醇→二元醛→二元羧酸→链酯、环酯、高分子酯
2.有机合成的一般思路
(1)判断原料、产物各有哪些官能团,官能团如何转化、如何引入和保护。
(2)读懂信息,认真分析信息中涉及到官能团或碳链结构的变化、与原料和产品有何联系。
(3)采用顺推、逆推或中间向两边推的推理方式得出合成路线。
省略短线
双键叁键保留
短线替换
共用电子对
略去碳氢
元素符号
CH3—C
CH3
CH3
—CH3
—CH2
,CH3
—CH
CH3
—CH3,
—CH2
CH3
—CH2
—CH2
—CH3
CH3
—CH
—CH2
—CH3
CH3
—CH
CH3
CH3
CH3
CH2
—CH3
—CH2
CH3
—CH
—CH2
—CH3
CH3
CH3
—CH3
CH3—
CH2
—CH
CH3
—CH
CH2
CH2
CH3
—CH
CH3
—CH3
—CH
CH3
—C—、
O
CH2=C
C2H5
—CH2
—CH3
CH2=
CH
—CH2
—OH
CH2=CH
—CH=C
—CH2
—OH
OH
卤代烃
按照烃基结构的不同
按照取代卤原子的不同
按照取代卤原子的多少
OH
CH3
—CH
CH3
—CH2
—OH
CH3
—CH
CH3
—CH
OH
—CH3
—OH
—OH
—OH
催化剂
加热
点燃
OH
CH3COOH + H18O-CH2CH3
催化剂
加热
羧酸
按照烃基结构的不同
按照碳原子的多少
按照羟基的多少
HX
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
〈〈有机化学基础〉〉 复习提纲
专题1 认识有机化合物
(一)有机化学的发展与应用
1、18世纪初瑞典化学家_____提出了有机化学的概念。
2、打破无机物和有机物界限的化学家是____。
3、1965年 中国 世界上第一次人工合成蛋白质--结晶牛胰岛素
(二)科学家怎么样研究有机物
1、有机化合物:含____元素的化合物,(除____、____、____外)。
2、有机物中组成元素种类的确定
⑴燃烧法――-李比希法
一般来说,有机物完全燃烧后,各元素对应的产物为C→__,H→__。
欲判断有机物中是否含氧元素:
设有机物燃烧后CO2中碳元素的质量为m(C),H2O中氢元素质量为m(H)。若
m(有机物)__m(C)+m(H)→有机物中含有氧元素
m(有机物)__m(C)+m(H)→有机物中不含氧元素
⑵其它常见的元素测定方法
①钠融法可定性确定有机物中是否存在_____等元素
②铜丝燃烧法可定性确定有机物中是否存在_____。
③元素分析仪可同时对_____等多种元素进行分析。
3、有机物分子式的确定
(1)直接法(物质的量法):直接求算出1mol有机物中各元素原子的物质的量,即可确定分子式。
例:1、充分燃烧0.10mol气态烃,生成0.40molCO2,0.30molH2O。求此烃分子式
(2)最简式法:根据有机物中各元素的质量分数(或元素的质量比),求出该有机物的最简式,再根据其相对分子质量求n的值,即可确定分子式。
例2:实验测得某碳氢化合物A中含碳80%,含氢20%,又测得该化合物相对分子质量30。求该化合物的最简式和分子式。
例3:某烃经测定其相对分子质量为56。取该有机化合物样品5.6g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重7.2g和17.6g。试求该有机物的分子式。
4、有机化合物结构的研究
(1)从H1核磁共振氢谱(1H-NMR)中上可以推知该有机物分子有几种不同类型的__原子及它们的数目。
氢原子类型=___数目 吸收峰的面积之比___不同氢原子的个数之比
(2)通过红外光谱可以推知有机物含有哪些_______。
(3)质谱法可确定_______。
专题2 有机物的结构与分类
(三)有机化合物的结构
1、有机物中碳原子的成键特点
①在有机物中,碳呈 价,碳原子总是形成__个共价键。
②在有机物分子中,仅以___键方式成键的碳原子称为饱和碳原子;连接在双键、叁键或在苯环上的碳原子(所连原子的数目少于4)称为____碳原子。
③C—C单键可以旋转而C=C(或三键)不能旋转。
2.碳原子的成键方式与分子空间构型的关系
(1)当一个碳原子与其它4个原子连接时,这个碳原子将采取______取向与之成键;当碳原子之间或碳原子与其它原子之间形成双键时,形成该双键的原子以及与之直接相连的原子处于____上;当碳原子之间或碳原子与其它原子之间形成叁键时,形成该叁键的原子以及与之直接相连的原子处于____上。
(2)有机物的代表物基本空间结构:甲烷是____结构(5个原子不在一个平面上);乙烯是____结构(6个原子位于一个平面);乙炔是____结构(4个原子位于一条直线);苯环是____结构(12个原子位于一个平面)。
拓展应用:有机分子空间构型解题规律
规律Ⅰ:以碳原子和化学键为立足点,若氢原子被其它原子所代替,其键角基本不变。
规律Ⅱ:若两个平面型结构的基团之间以单键相连,这个单键可以旋转,则两个平面可能共面,但不是“一定”。
规律Ⅲ:若两个苯环共边,则两个苯环一定共面。
规律Ⅳ:若甲基与一个平面型结构相连,则甲基上的氢原子最多有一个氢原子与其共面。若一个碳原子以四个单键与其它原子直接相连,则这四个原子为四面体结构,不可能共面。同时,苯环对位上的2个碳原子及其与之相连的两个氢原子,这四原子共直线。
3、有机物结构的表示方法
(1)结构简式书写:
不能用碳干结构表示,碳原子连接的氢原子个数要正确,官能团不能略写,要注意官能团中各原子的结合顺序不能随意颠倒。
(2)键线式:
将__、__元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有一个___原子,称为键线式。每个交点、端点代表一个__原子,每一条线段代表一个__,每个碳原子有四条线段,用四减去线段数既是__原子个数。注意事项:
(a)只忽略C-H键,其余的化学键不能忽略;
(b)必须表示出C=C、C≡C键等官能团
(c)碳氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中氢原子)
(d)计算分子式时不能忘记顶端的碳原子。
有机化合物结构的表示方法
电子式 结构式 结构简式
键线式
【基础训练】
1.请写出下列有机化合物的结构式、结构简式和键线式。
名称 结构式 结构简式 键线式
异丁烷
丙酸
丙烯
丙炔
溴乙烷
乙酸乙酯
2.请写出下列有机化合物的结构简式和键线式。
、
、
、
3.请写出下列有机物分子的分子式:
⑴ ; ⑵ ;
⑶ ;⑷ ;
(5) ; (6) 。
3、同分异构体与同系物
同分异构体的特点:____相同,_____不同。
同系物:___相似,组成上相差一个或若干个____的有机化合物。
4、同分异构体的常见种类
①碳链异构:分子中__原子的排列顺序不同而产生的异构。例:
②位置异构:分子中官能团(包括双键或三键)或取代基在碳链上的位置不同而产生的异构。例:
③类别异构:分子式相同,由于分子中官能团不同而分属不同类物质的异构。例:
5、烷烃同分异构体的写法
①主链由长到短 ②支链由整到散
③位置由心到边(一边走,不到端,支链碳数小于挂靠碳离端点位数。 ),
④排布对、邻、间。
6、等效氢原子确定的规律
同一碳原子上的氢原子完全等效;
与同一碳原子相连的甲基上的氢原子完全等效。
结构对称的碳原子上的氢原子完全等效。(通过寻找对称轴或对称中心进行分析。)
(四)有机物的分类和命名
1、分类
官能团符号 官能团名称 典型有机化合物 物质名称 所属类别
烯
炔
卤代烃
醇
酚
醛
羧酸
2、有机物的命名
(1)有机物中的基
如果失去氢原子的烃是烷烃,剩余的原子团就叫做_________。例如,甲烷分子CH4失去一个氢原子后剩余的________部分叫做甲基,乙烷CH3CH3分子失去一个氢原子后剩余的_________部分叫做乙基
(2)习惯命名法:(普通命名法)
习惯命名法在命名简单有机化合物时比较方便。如对烷烃的命名,其中碳原子数在10以内时,用天干—____、____、____、____、____、____、____、____、____、____表示;大于10时,则用中文数字十一、十六等来表示。同时为了区别同分异构体,在名称前面加“____、____、_____”等冠词。
例如C5H12的3种同分异构体命名:
_______________________, ____________________, ___________________
(3)系统命名法:
①选母体。选定分子中_________的碳链做主链,定为某烷。
②编序号。把主链里____________一端作起点,给主链的碳原子编号以确定支链的位置。
③写名称。把支链作取代基,名称写在烷烃名称前,用________注明它在主链上的位置,中文和数字间用_________隔开。
例:
___________________________________________
④如果有相同的取代基,可以合并起来用二、三等数字表示,但表示相同取代基位置的阿拉伯数字用________隔开;如果几个取代基不同,就把_______写在前面,_______写在后面。例:
_______________________________, ____________________________________
⑤如果有两种以上选择主链的可能性时,应选择_________的碳链为主链。如果支链数目也相同,应选择位次总和最小的碳链为主链。例如:
______________________________________
(4)几类烃的衍生物的命名:
⑴开链烃以及包含—C==C—、—C C—、 —CHO、—COOH、—OH、—SO3H、
—NO2、—NH2等官能团的化合物的命名。
步骤:①编号。通常选取其中包含官能团的最长的碳链为主链,从距官能团最近的一端开始编号。如果官能团相距两端一样近,则从支链较近的一端开始编号。
例:
__________________________________________
②命名。如果有两种以上的官能团,则以能进入主链的官能团为最后名称,而把主链上带有的其它官能团作为取代基。
例: ______________________________
其它规则同烷烃的命名。
例: ___________________________________
专题3 常见的烃
一、各类烃的代表物比较
代表物 结构简式 空间构型 化学性质
烷烃 甲烷
烯烃 乙烯
炔烃 乙炔
芳香烃 苯
二、“四同”概念比较
概念 同系物 同分异构体 同素异形体 同位素
研究范围
限制条件
三、链烃的结构和性质
烃 烷烃 烯烃 炔烃
结构特点
空间构型
特征反应
燃烧现象
酸性高锰酸钾
溴水
四、芳香烃的结构和性质
1、苯的组成和结构
(1)分子式:C6H6 (2)结构简式:
(3) 结构特点:平面正六边形结构,碳碳键介于单键和双键之间的独特的键。
2、苯的物理性质
没有颜色带有特殊气味的液体,密度比水小,不溶于水。熔、沸点较低。
3、苯的化学性质
⑴与H2加成
⑵跟Br2的取代
⑶硝化反应
(4)燃烧
4、苯的主要用途: (1)重要的有机化工原料 ,(2) 常用的有机溶剂。
5、苯的同系物 (以甲苯为例)
1 结构: CH3
CH3
2 性质
a. 取代反应
b.加成反应:与H2加成生成甲基环己烷。
c.被酸性高锰酸钾溶液氧化。
五、烃的燃烧规律
若烃的分子式用CxHy表示,烃完全燃烧的化学方程式可表示为:
CxHy+ O2 CO2 + H2O
专题4 烃的衍生物
一、烃的衍生物
1.定义:
2.分类:常见烃的衍生物有 、 、 、 、 、 等。
二、卤代烃对人类生活的影响
1.卤代烃的用途: 、 、 、 、 等。
2.卤代烃的危害:
(1)DDT禁用原因:
(2)卤代烃对大气臭氧层的破坏原理:卤代烃释放出的氯原子对臭氧分解起到了
的作用。
三、卤代烃
1.定义:
一卤代烃的通式: ;饱和一卤代烃的通式: 。
2.分类:
3.卤代烃的物理性质
a.聚集状态
b.熔、沸点变化规律
卤代烃的熔、沸点 (填“>”、“<”、或“=”)相应烃的熔、沸点
c.密度及水溶性规律
4.溴乙烷
(1)溴乙烷的物理性质:纯净的物理性质是 色的 ,沸点 ,易挥发,密度比水 , 溶于水,是 (填“电解质”或“非电解质”)
(2)溴乙烷的分子组成和结构
分子式 结构式 结构简式 官能团
(3)溴乙烷的化学性质
a.溴乙烷的水解反应 ( 反应)
实验步骤:1)、向大试管中注入5mL溴乙烷和15mL20%的氢氧化钾水溶液,现象:
2)、加热。现象:
3)、取大试管中反应后的少量剩余物于另一试管中,再向该试管中加入稀硝酸至溶液呈酸性,滴加硝酸银溶液。现象:
反应原理:
或:
[讨论]在滴加硝酸银溶液之前,为什么要加稀硝酸酸化溶液?
b.溴乙烷的消去反应
消去反应:
实验步骤:1)、向大试管中注入5mL溴乙烷和15mL饱和氢氧化钾乙醇溶液,加热。
2)、用排水法收集气体,并检验此气体。
3)、取大试管中反应后的少量剩余物于另一试管中,再向该试管中加入稀硝酸至溶液呈酸性,滴加硝酸银溶液。现象:
反应原理:
[讨论]1、乙醇在反应中起到了什么作用?
2、实验过程中发现有气体生成,请设计实验检验生成的气体是乙烯气体,画出实验装置图。
在滴加硝酸银溶液之前,为什么要加稀硝酸酸化溶液?
5.卤代烃的化学性质
(1)卤代烃发生水解反应时的断键情况
(2)卤代烃发生水解反应时的断键情况
注意:1)并不是所有的卤代烃都能发生消去反应。
卤代烃发生消去反应的条件:
2)溴乙烷的水解反应和消去反应,反应条件不同,产物不同。可用下列口诀记忆:“无醇则有醇,有醇则无醇”。
6.卤代烃的制法
(1)
(2)
7.卤代烃水解反应和消去反应的比较
水解反应 消去反应
反应条件
反应产物
反应实质
反应特点 有机物碳架不变,官能团有-X变为-OH,无副反应 有机物碳架不变,官能团有-X变为C=C或C=C,可能有副反应
四.醇 酚
1.醇的概念:___________________ _叫醇。
酚的概念:__________________________ ___叫酚。
2.乙醇
(1)乙醇的分子结构:
分子式:________ _ 结构式:___________
结构简式:___________或___________ 官能团:_______ __
(2)乙醇的物理性质
无色透明,有 ________味的液体,_______溶于水,易挥发。工业用酒精含乙醇约96%(体积分数),含乙醇99.5%以上也叫____________。
(3)乙醇的化学性质
a.羟基氢所发生的反应
①与Na的反应:CH3CH2OH + Na→
②与氧化剂的反应:(乙醇的催化氧化)CH3CH2OH + O2→
b.羟基所发生的反应
①脱水反应:
CH3CH2OH和浓硫酸混合加热到170℃____________________ ____ ___属于______反应
消去反应的概念:_____________________________________ _
CH3CH2OH和浓硫酸混合加热到140℃_______________________ ____属于______反应
②与氢卤酸(例HBr)的取代反应:_______________________________________ ___
③乙醇和乙酸的酯化反应:__________________________________________ _____
c.氧化反应
①乙醇使酸性KMnO4褪色
②乙醇和氧气燃烧:________________________________________现象:
(4)乙醇的工业制法
a.发酵法
b.乙烯水化法:
(5)乙醇的用途: ________的乙醇溶液用于医疗消毒。
3.醇
(1)醇的通式_________________ 饱和一元醇的通式
(2)醇的化学性质:
a.醇与钠的反应:CH3-CH-CH3 + Na→
b.与氢卤酸的反应:ROH + HX→
c.醇的催化氧化
+ O2 → + O2→
注意:醇发生催化氧化的条件:
d.醇的消去反应:
CH3CH2CH2OH与浓硫酸混合加热至170℃____________________________________
注意:醇发生消去反应的条件:
4.几种重要的醇
(1)甲醇 分子式___________,结构简式________,又名木精(源于木材干馏),有毒。
(2)乙二醇:结构简式______________,无色、粘稠、有甜味的液体,凝固点低。
HOCH2CH2OH + Na→
HOCH2CH2OH + O2→
HOCH2CH2OH与浓硫酸混合加热170℃________________________________________
HOCH2CH2OH与浓硫酸混合加热140℃___________________________________(环状)
用途:______________________________________ ________________________。
(3)丙三醇 :结构简式________________俗称_________,无色、粘稠、有甜味,吸湿性强。
用途:____________________________________________ ___________________。
5.苯酚(最简单的酚)
(1)苯酚的分子结构
分子式:_______________;结构简式:______________,所有原子 一个平面上。
(2)苯酚的物理性质
纯净的苯酚是____色有_____气味的_______,俗称 。露置在空气中因小部分氧化而显________,常温下在水中的溶解度 ,高于65℃与水以任意比例互溶,苯酚 溶于乙醇等有机溶剂。其浓溶液有腐蚀性,有毒,如不慎沾在皮肤上,立即用______擦洗,再用水冲洗。
(3)苯酚的结构特点:酚中的羟基和苯环相互影响
a.羟基受苯环的影响而使羟基中的氢容易电离出H+,而表现出 性;
b.羟基对苯环的影响,使苯环上的邻、对位上的氢被激活,而容易发生 反应。
(4)苯酚的化学性质
a.羟基氢的活泼性
①弱酸性: + NaOH→ 现象:__ ___
再向上述反应后的溶液中通入CO2,现象_______________________________,反应方程式________________________________________________________________________。
盐酸、碳酸、乙酸、苯酚、碳酸氢根离子的酸性强弱顺序:
b.取代反应: + Br2 → 现象___________________
(说明:本反应用于苯酚的定量和定性检测。)
c.显色反应
苯酚溶液遇Fe3+显示________色,利用这一反应也可作为苯酚的定性检测。
d.加成反应: + H2→
e.氧化反应:在空气中逐渐被氧化而显粉红色。
(5)苯酚的用途
苯酚是一种重要的化工原料,主要用于制造 (电木)等,还广泛用于合成纤维、医药、合成香料、染料、农药等。
苯酚的稀溶液具有消毒、杀菌的功效,药皂中常含有少量的苯酚。
酚醛树脂制取的反应方程式:
五.醛 羧酸
1.乙醛
(1)乙醛的组成与分子结构
分子式: ;结构简式: ;结构式: ;官能团: ;
(2)乙醛的物理性质
色、有 气味的 体;沸点: , 挥发、易燃烧;密度比水 ;溶解性: ,易溶于乙醇、乙醚、氯仿等溶剂。
(3)乙醛的化学性质
a. 氧化反应
Ⅰ银镜反应
①实验操作:a.银氨溶液的配制: ;
b.在银氨溶液中滴入3滴乙醛,振荡;
c.将试管放在 中加热。
②实验现象: 。
③涉及到的方程式: 、 、
。
Ⅱ与新制氢氧化铜反应
①实验操作:a.Cu(OH)2的配制: ;
b.在新制Cu(OH)2中加入0.5mL乙醛;
c.将试管放在 中加热。
②实验现象: 。
③涉及到的方程式: 、
。
Ⅲ被氧气完全氧化(燃烧)或催化氧化
CH3CHO + O2 ;CH3CHO + O2
b.还原反应(与氢气的加成)
CH3CHO + H2
2.甲醛
(1)甲醛的分子结构
分子式: ;结构简式: ;结构式: ;核磁共振谱上可以看到 个峰,空间构型为 ,甲醛分子结构中相当于含 个醛基。
(2)甲醛的物理性质
甲醛俗称 ,在通常状况下是一种 色、 气味的 体。有毒(它是室内空气污染源之一,如胶合板、油漆等); 溶于水,浓度在 的甲醛水溶液俗称 ,具有 性,可作 。
(3)甲醛的化学性质
a.氧化反应
银镜反应: ;
新制氢氧化铜反应: ;
氧气催化氧化: 。
b.还原反应 氢气加成: 。
c.与苯酚缩聚反应(制酚醛树脂)
n + n HCHO
3.醛
(1)醛类的结构可表示为 ,饱和一元醛的通式为 或 。
(2)醛基中碳元素的化合价为 价。
(3)醛基既有氧化性,又有还原性。
5.乙酸
(1)乙酸的分子结构
分子式 , 结构式 ,结构简式 ,官能团 。
(2)乙酸的物理性质
乙酸俗称 ,是一种 色、 味 溶于水的液体,当温度低于16.60C时为晶体,所以乙酸又称 。
(3)乙酸的化学性质
a.具有弱酸性,具有酸的通性:① ②
③ ④ ⑤
CH3COOH +
在稀醋酸溶液中滴加紫色石蕊溶液、碳酸钠溶液的现象分别是 、 ,有关方程式为 。
b.酯化反应: 。
+
CH3CH2OH + HO-NO2→
乙酸乙酯的制取实验
(1)浓H2SO4的作用:____ _(2)盛反应液的试管口要_____________________
(3)导管_______________ ______________________________ __________
(4)饱和Na2CO3的作用:______________ _________________________________________
(5)不能用Na0H代替Na2CO3,_______________________________________________________
6.羧酸
(1)羧酸的概念: 叫羧酸。
饱和一元羧酸的通式: 或
(2)羧酸的分类
(3)羧酸的酸性随碳原子数的增加而减弱,甲酸是一元羧酸中酸性最强的酸。
(4)甲酸
结构式: ,官能团: ,所以甲酸兼有 和 的性质。
a.具有羧酸的性质
b.具有醛的性质
7.缩聚反应:
对苯二甲酸和乙二醇作用形成高分子酯:
乳酸分子作用形成高聚物:
8.酯
(1)酯的概念: 叫酯。
酯的通式: 饱和一元羧酸酯的通式:
(2)酯的物理性质: 色 味的 ,密度 ,
溶于水,易溶于乙醇、乙醚。
(3)酯的化学性质
a.水解反应:酯在酸性或碱性条件下发生水解。
注意:甲酸某酯的特殊性。
专题5 生命活动的物质基础
糖类、脂肪、蛋白质、氨基酸
物质 葡萄糖 麦芽糖 蔗糖 淀粉 纤维素
组成
类别
结构
还原性
氨基酸分子的结构含________、__________官能团,具有______、________性质。
氨基酸在酸或碱的存在下加热,通过一分子的____基与另一分子的_____基间脱去一分子____,缩合形成含有肽键的化合物,叫做成肽反应。
茚三酮溶液中加入氨基酸溶液,显紫色。
蛋白质的性质
1:具有两性
2:能够水解
3:盐析:加浓的无机盐溶液〔如Na2SO4、(NH4)2SO4等〕,
4:变性:在热、强酸、强碱、重金属盐、甲醛、酒精、苯酚溶液、紫外线等作用下变性
5: 颜色反应
(1) 加浓硝酸变黄色
(2) 加双缩脲试剂显紫玫瑰色
1.有机合成的常规方法
(1)官能团的引入:
①引入羟基(-OH):烯烃与水加成;醛(酮)与氢气加成;卤代烃的碱性水解;酯的水解等;
②引入卤原子:烃与X2的取代;不饱和烃与HX或X2的加成;醇与HX的取代等。
③引入双键:某些醇或卤代烃的消去引入C=C;醇的氧化引入C=O等。
(2)官能团的消除:
①通过加成消除不饱和键;
②通过消去或氧化或酯化等消除羟基(-OH);
③通过加成或氧化等消除醛基(-CHO)
④通过消去或水解消除卤原子。
(3)官能团间的衍变:
①一元合成路线 R-CH=CH2 卤代烃→一元醇→一元醛→一元羧酸→酯
②二元合成路线:CH2=CH2→CH2X-CH2X
→二元醇→二元醛→二元羧酸→链酯、环酯、高分子酯
2.有机合成的一般思路
(1)判断原料、产物各有哪些官能团,官能团如何转化、如何引入和保护。
(2)读懂信息,认真分析信息中涉及到官能团或碳链结构的变化、与原料和产品有何联系。
(3)采用顺推、逆推或中间向两边推的推理方式得出合成路线。
省略短线
双键叁键保留
短线替换
共用电子对
略去碳氢
元素符号
CH3—C
CH3
CH3
—CH3
—CH2
,CH3
—CH
CH3
—CH3,
—CH2
CH3
—CH2
—CH2
—CH3
CH3
—CH
—CH2
—CH3
CH3
—CH
CH3
CH3
CH3
CH2
—CH3
—CH2
CH3
—CH
—CH2
—CH3
CH3
CH3
—CH3
CH3—
CH2
—CH
CH3
—CH
CH2
CH2
CH3
—CH
CH3
—CH3
—CH
CH3
—C—、
O
CH2=C
C2H5
—CH2
—CH3
CH2=
CH
—CH2
—OH
CH2=CH
—CH=C
—CH2
—OH
OH
卤代烃
按照烃基结构的不同
按照取代卤原子的不同
按照取代卤原子的多少
OH
CH3
—CH
CH3
—CH2
—OH
CH3
—CH
CH3
—CH
OH
—CH3
—OH
—OH
—OH
催化剂
加热
点燃
OH
CH3COOH + H18O-CH2CH3
催化剂
加热
羧酸
按照烃基结构的不同
按照碳原子的多少
按照羟基的多少
HX
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
