乙醇(福建省泉州市南安市)
图片预览




文档简介
课件16张PPT。第二单元 食品中的有机化合物
第一课时 乙醇乙醇的用途 颜 色 :
气 味 :
状 态:
挥发性:
密 度:
溶解性:无色透明特殊香味液体比水小跟水以任意比互溶
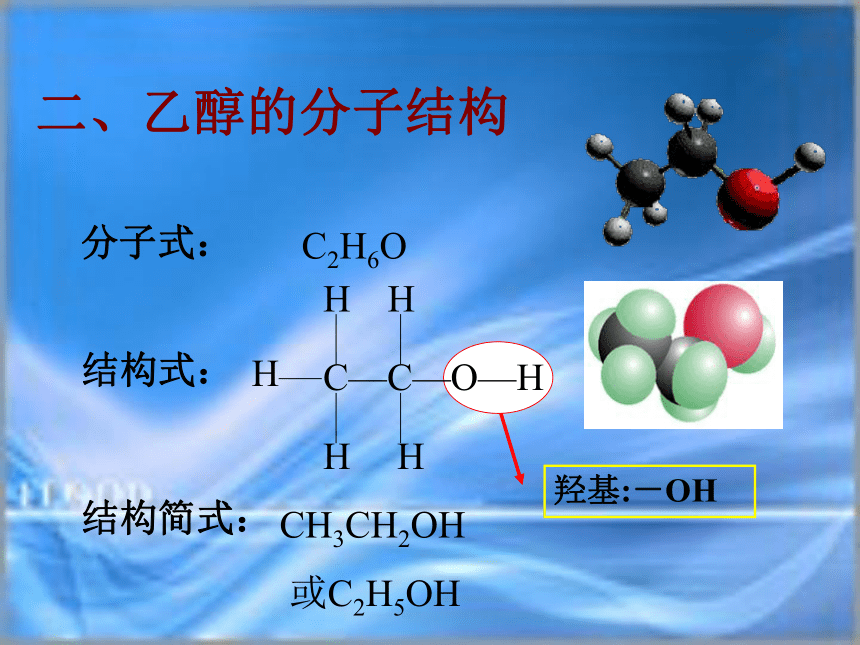
能够溶解多种无机物和有机物易挥发一、乙醇的物理性质二、乙醇的分子结构羟基:-OH [活动与探究]分别往装有无水乙醇和水的
试管和烧杯中投入小粒金属钠,观察、记录实验
现象,并和煤油中的钠比较。装有无水乙醇的试管内钠沉于底部,有无色气泡在钠粒表面生成后逸出液面,最终钠粒消失,液体仍为无色透明。
装有水的烧杯中,钠熔成小球,浮游于水面,剧烈反应,气体逸出,钠很快消失
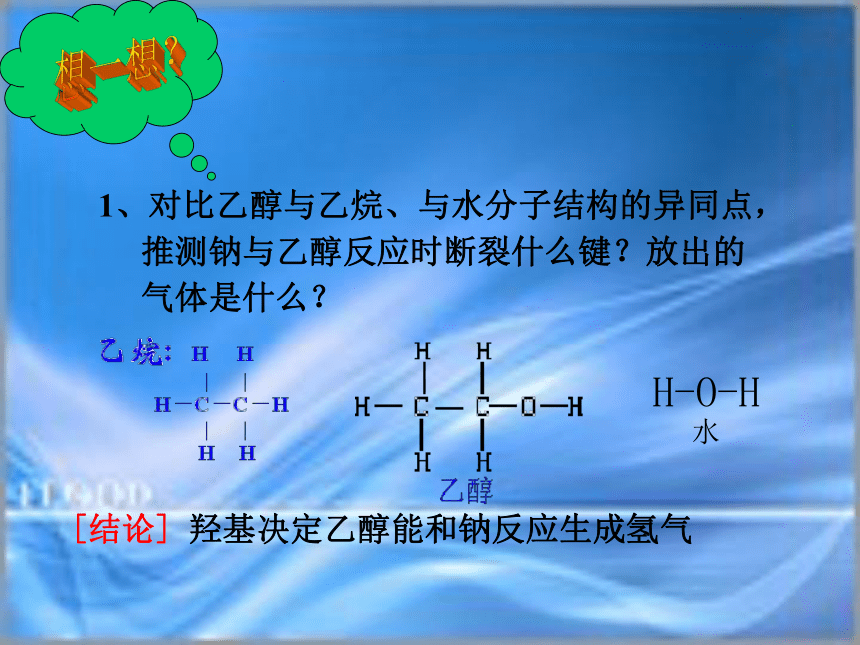
钠在煤油中无明显现象[实验现象]:1、对比乙醇与乙烷、与水分子结构的异同点,推测钠与乙醇反应时断裂什么键?放出的气体是什么?想一想?H-O-H
水[结论]?羟基决定乙醇能和钠反应生成氢气
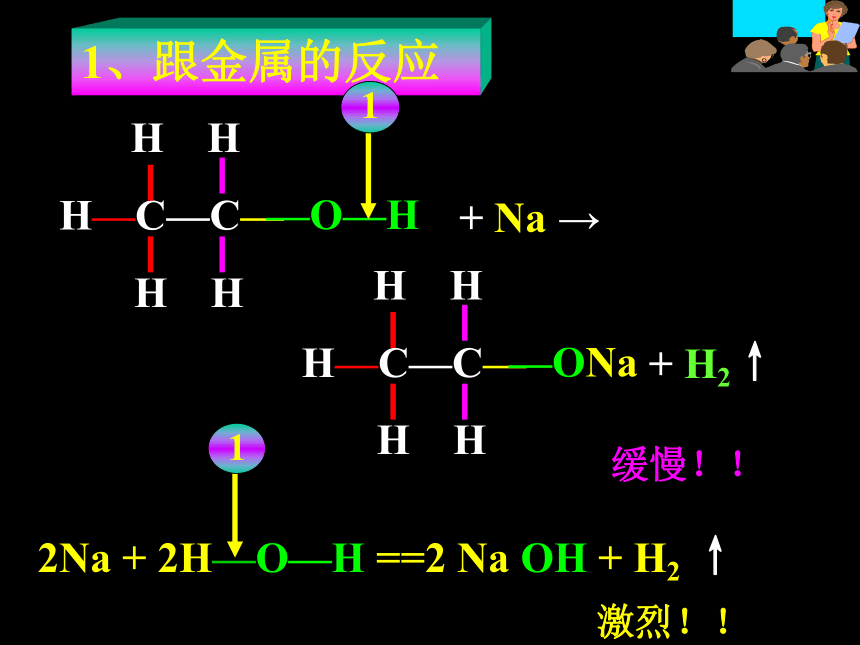
1、跟金属的反应+ Na →+ H2↑2Na + 2H—O—H ==2 Na OH + H2 ↑缓慢!!激烈!!2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 其它活泼金属如钾、钙、镁等也可与乙醇反应三、乙醇的化学性质1、乙醇与钠的反应例如:乙醇与镁反应的化学方程式2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑2、乙醇的氧化反应乙醇在空气中燃烧?: 现象:产生淡蓝色火焰,同时放出大量热。 三、乙醇的化学性质 [活动探究二]
①用试管取少量无水乙醇
②加热一端绕成螺旋状的铜丝至红热
③将铜丝趁热插到盛有乙醇的试管内
④反复操作几次,观察铜丝颜色和液体
气味的变化。a.铜丝红色→黑色→红色反复变化[思考]铜丝在此实验中起什么作用?[实验现象]b.在试管口可以闻到刺激性气味红色→黑色黑色→红色总反应方程式:?乙醛
刺激性气味液体铜丝在实验中作催化剂 3.乙醇催化氧化: 工业上利用此原理生产乙醛C2H6OC2H4O①与活泼金属反应
②氧化反应--燃烧
--催化氧化物理性质:
分子结构:
化学性质:
反应中乙醇断键位置?乙醇-OH1.能用来检验酒精中是否含有水的
试剂是( )A: CuSO4·5H2OC: 浓硫酸B:CuSO4D:金属钠练 习 题√2.将铜片放在酒精灯上加热片刻后,立即浸入下列溶液
中,充分接触后取出洗净,干燥后铜片质量将不发生改变
的是( )
A.硝酸 B.无水乙醇
C. 石灰水 D. 盐酸B快乐是一天,
不快乐也是一天,
我们何不天天快乐! !
第一课时 乙醇乙醇的用途 颜 色 :
气 味 :
状 态:
挥发性:
密 度:
溶解性:无色透明特殊香味液体比水小跟水以任意比互溶
能够溶解多种无机物和有机物易挥发一、乙醇的物理性质二、乙醇的分子结构羟基:-OH [活动与探究]分别往装有无水乙醇和水的
试管和烧杯中投入小粒金属钠,观察、记录实验
现象,并和煤油中的钠比较。装有无水乙醇的试管内钠沉于底部,有无色气泡在钠粒表面生成后逸出液面,最终钠粒消失,液体仍为无色透明。
装有水的烧杯中,钠熔成小球,浮游于水面,剧烈反应,气体逸出,钠很快消失
钠在煤油中无明显现象[实验现象]:1、对比乙醇与乙烷、与水分子结构的异同点,推测钠与乙醇反应时断裂什么键?放出的气体是什么?想一想?H-O-H
水[结论]?羟基决定乙醇能和钠反应生成氢气
1、跟金属的反应+ Na →+ H2↑2Na + 2H—O—H ==2 Na OH + H2 ↑缓慢!!激烈!!2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 其它活泼金属如钾、钙、镁等也可与乙醇反应三、乙醇的化学性质1、乙醇与钠的反应例如:乙醇与镁反应的化学方程式2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑2、乙醇的氧化反应乙醇在空气中燃烧?: 现象:产生淡蓝色火焰,同时放出大量热。 三、乙醇的化学性质 [活动探究二]
①用试管取少量无水乙醇
②加热一端绕成螺旋状的铜丝至红热
③将铜丝趁热插到盛有乙醇的试管内
④反复操作几次,观察铜丝颜色和液体
气味的变化。a.铜丝红色→黑色→红色反复变化[思考]铜丝在此实验中起什么作用?[实验现象]b.在试管口可以闻到刺激性气味红色→黑色黑色→红色总反应方程式:?乙醛
刺激性气味液体铜丝在实验中作催化剂 3.乙醇催化氧化: 工业上利用此原理生产乙醛C2H6OC2H4O①与活泼金属反应
②氧化反应--燃烧
--催化氧化物理性质:
分子结构:
化学性质:
反应中乙醇断键位置?乙醇-OH1.能用来检验酒精中是否含有水的
试剂是( )A: CuSO4·5H2OC: 浓硫酸B:CuSO4D:金属钠练 习 题√2.将铜片放在酒精灯上加热片刻后,立即浸入下列溶液
中,充分接触后取出洗净,干燥后铜片质量将不发生改变
的是( )
A.硝酸 B.无水乙醇
C. 石灰水 D. 盐酸B快乐是一天,
不快乐也是一天,
我们何不天天快乐! !
