离子键(浙江省台州市椒江区)
图片预览




文档简介
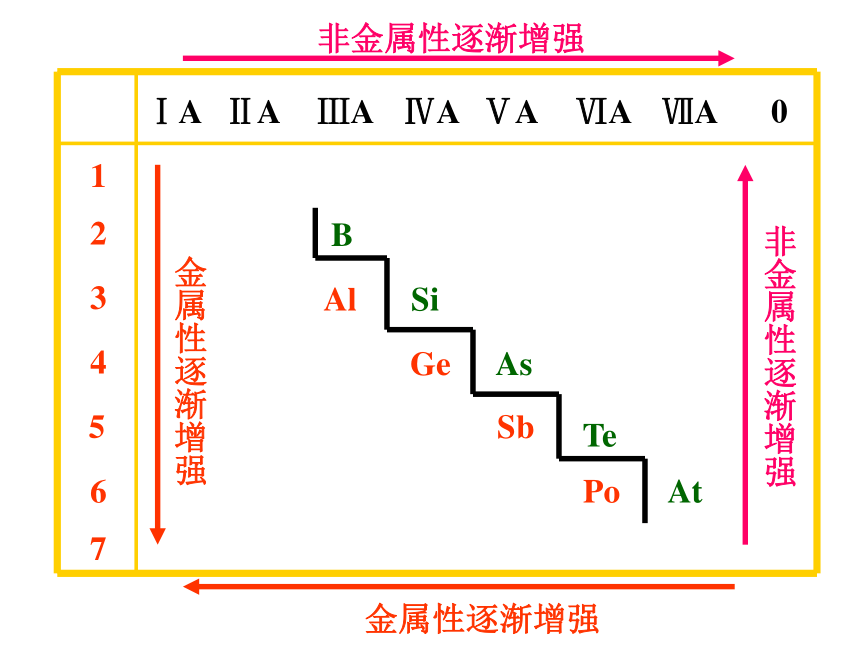
课件19张PPT。 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强元素周期表的分区说明金属区:左下角非金属区:右上角两性区:金属和非金属交界 元素周期表的意义1、预测新元素2、寻找原料?农药-----F、Cl、S、P、As
?半导体----金属与非金属的分界线附近
?催化剂-----过渡元素
?耐高温、耐腐蚀的合金-----过渡金属知识应用2、一些科学家预言,存在稳定的超重元素,原子序数为117。由此,下列说法正确的是( )
A、元素位于第七周期,第ⅥA族
B、该单质呈液态
C、该元素的气态氢化物很稳定
D、最高正价为+7价D1、镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的描述中不正确的是( )
A、在化合物中呈+2价 B、单质与水反应放出H2
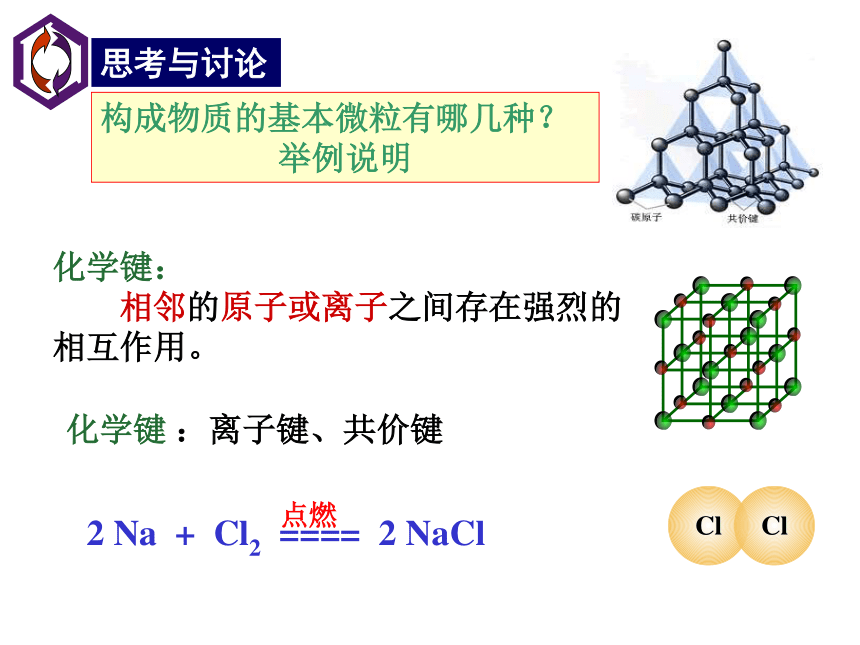
C、氢氧化合物呈两性 D、碳酸盐难溶于水C微粒之间的相互作用力构成物质的基本微粒有哪几种?
举例说明化学键:
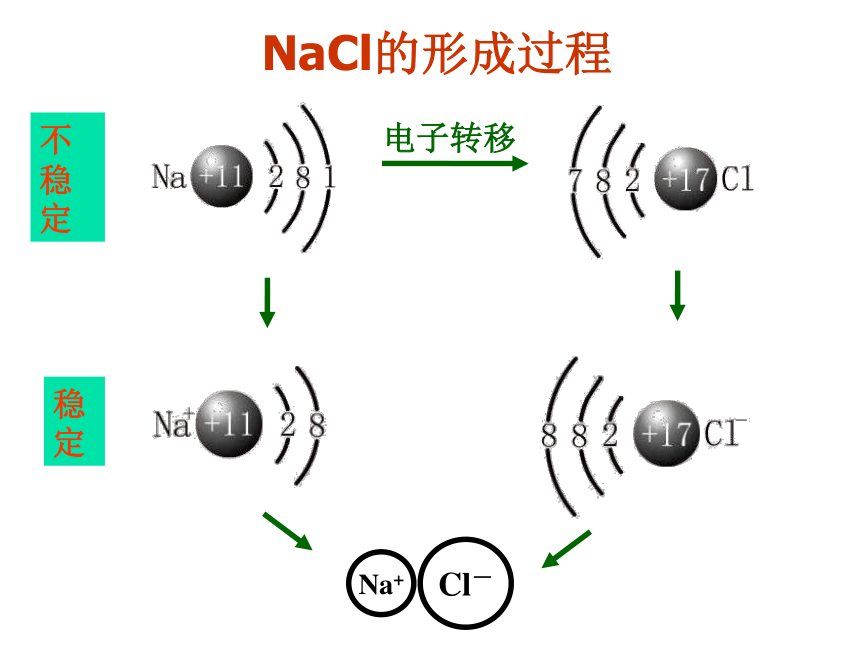
相邻的原子或离子之间存在强烈的相互作用。化学键 :离子键、共价键电子转移不稳定稳定NaCl的形成过程钠离子与氯离子之间存在着什么作用呢?相
互
作
用静电作用静电吸引静电排斥原子核与电子之间原子核之间、电子之间 阴、阳离子之间1、定义:使阴、阳离子结合成化合物的静电作用。 离 子 键2、成键粒子:阴、阳离子3、成键作用力:静电作用(吸引和排斥)讨论:哪些原子比较容易形成阴、阳离子呢?4、成键规律:活泼金属和活泼非金属离子间能形成(IA、ⅡA)(VIA、VⅡA)特殊:NH4Cl、NH4NO3等5、存在:离子化合物(大多数盐、碱、金属氧化物)下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A、10与19 B、6与16
C、19与9 D、14与8练习C 含有离子键的化合物就是离子化合物。电子式:在元素符号周围用 ? 或 × 来表示原子的最外层电子的式子。 电子式①原子的电子式:Na · ·Mg ·②离子的电子式:Na+Mg2+(1)原子的电子式:把其最外层电子数用 “.”或 “×”来表示。(2)简单阳离子的电子式:就是本身的离子符号(3)阴离子的电子式:不但要画出最外层电子数,而且还用“[ ]”括起来,并在右上角标出“n·-”电荷字样。电子式书写注意点:AB型AB2型A2B型注:阴、阳离子的电子式相间写,相同离子不能合并。③离子化合物的电子式 :NaClNa2OMgCl2 写出下列微粒的电子式:
硫原子, 铝原子, 硫离子, 溴离子写出下列化合物的电子式Na2O、MgO练习:1、下列电子式中正确的是( ) D2、下列电子式中正确的是( ) C离子键的强弱根据离子键的成因,离子键的强弱取决于成键离子的半径以及所带电荷数,离子的半径越小,所带电荷数越多,离子键越强。
如比较NaCl和MgCl2 NaCl和NaBr用电子式表示离子键形成过程用电子式表示氯化钠的形成过程 用电子式表示溴化镁的形成过程 3、用电子式表示下列离子化合物的形成
过程,其中正确的是( )C
?半导体----金属与非金属的分界线附近
?催化剂-----过渡元素
?耐高温、耐腐蚀的合金-----过渡金属知识应用2、一些科学家预言,存在稳定的超重元素,原子序数为117。由此,下列说法正确的是( )
A、元素位于第七周期,第ⅥA族
B、该单质呈液态
C、该元素的气态氢化物很稳定
D、最高正价为+7价D1、镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的描述中不正确的是( )
A、在化合物中呈+2价 B、单质与水反应放出H2
C、氢氧化合物呈两性 D、碳酸盐难溶于水C微粒之间的相互作用力构成物质的基本微粒有哪几种?
举例说明化学键:
相邻的原子或离子之间存在强烈的相互作用。化学键 :离子键、共价键电子转移不稳定稳定NaCl的形成过程钠离子与氯离子之间存在着什么作用呢?相
互
作
用静电作用静电吸引静电排斥原子核与电子之间原子核之间、电子之间 阴、阳离子之间1、定义:使阴、阳离子结合成化合物的静电作用。 离 子 键2、成键粒子:阴、阳离子3、成键作用力:静电作用(吸引和排斥)讨论:哪些原子比较容易形成阴、阳离子呢?4、成键规律:活泼金属和活泼非金属离子间能形成(IA、ⅡA)(VIA、VⅡA)特殊:NH4Cl、NH4NO3等5、存在:离子化合物(大多数盐、碱、金属氧化物)下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A、10与19 B、6与16
C、19与9 D、14与8练习C 含有离子键的化合物就是离子化合物。电子式:在元素符号周围用 ? 或 × 来表示原子的最外层电子的式子。 电子式①原子的电子式:Na · ·Mg ·②离子的电子式:Na+Mg2+(1)原子的电子式:把其最外层电子数用 “.”或 “×”来表示。(2)简单阳离子的电子式:就是本身的离子符号(3)阴离子的电子式:不但要画出最外层电子数,而且还用“[ ]”括起来,并在右上角标出“n·-”电荷字样。电子式书写注意点:AB型AB2型A2B型注:阴、阳离子的电子式相间写,相同离子不能合并。③离子化合物的电子式 :NaClNa2OMgCl2 写出下列微粒的电子式:
硫原子, 铝原子, 硫离子, 溴离子写出下列化合物的电子式Na2O、MgO练习:1、下列电子式中正确的是( ) D2、下列电子式中正确的是( ) C离子键的强弱根据离子键的成因,离子键的强弱取决于成键离子的半径以及所带电荷数,离子的半径越小,所带电荷数越多,离子键越强。
如比较NaCl和MgCl2 NaCl和NaBr用电子式表示离子键形成过程用电子式表示氯化钠的形成过程 用电子式表示溴化镁的形成过程 3、用电子式表示下列离子化合物的形成
过程,其中正确的是( )C
