能量(浙江省台州市椒江区)
图片预览







文档简介
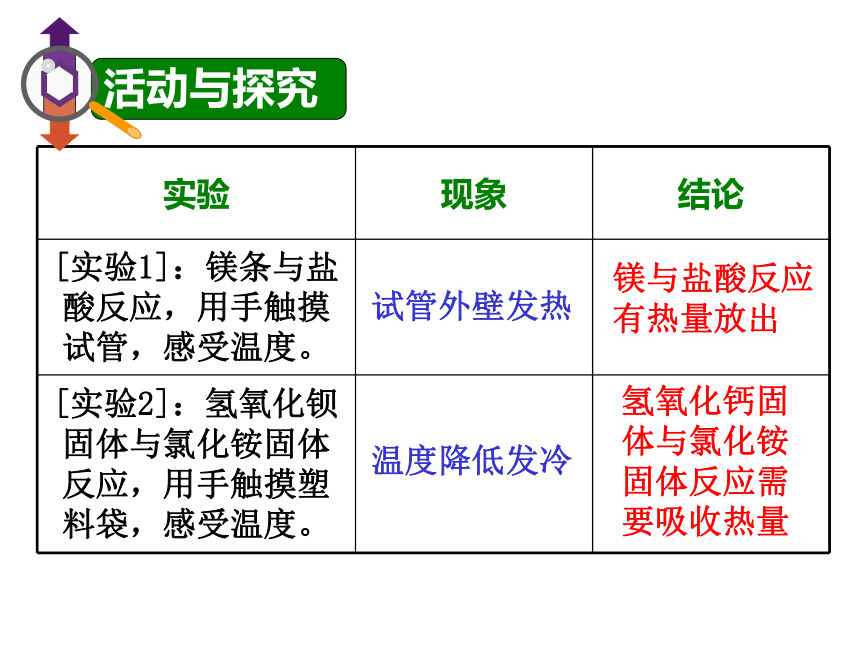
课件22张PPT。化学反应中的热量卖火柴的小女孩身着单衣蹲在墙角,尽力使自己倦缩起来,以抗御越来越深地渗入骨髓的寒冷,但她最终明白这是徒劳的。绝望中,小女孩划着一根火柴,这小小的火光给了她一丝温暖,于是,她便一根一根地让火柴燃烧起来…… 化学反应中伴随能量的变化,能量以热能、光能、电能等多种形式表现出来。化学反应中的能量变化 化学反应中的能量变化,主要表现为热量的放出或吸收。化学反应中的热量变化活动与探究试管外壁发热镁与盐酸反应
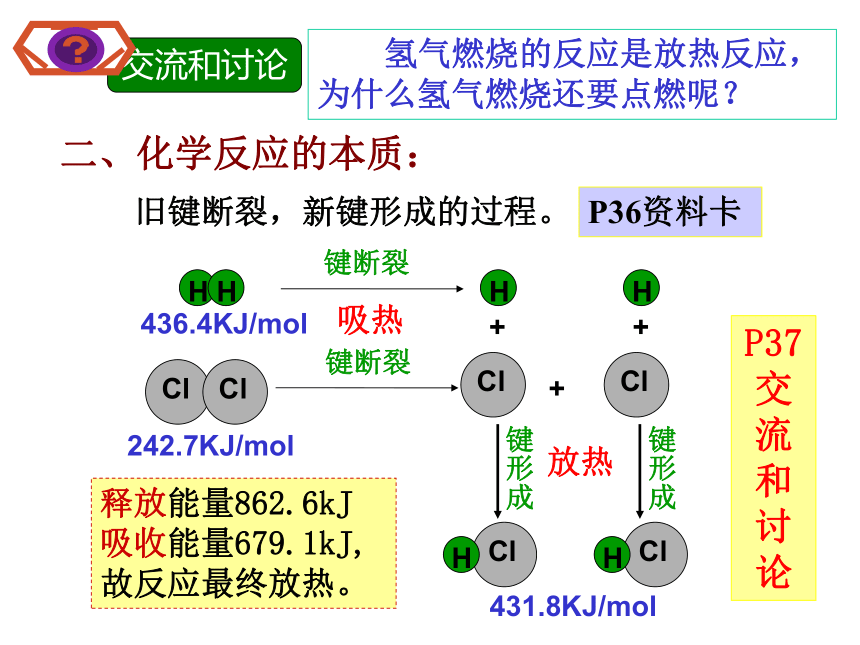
有热量放出温度降低发冷氢氧化钙固体与氯化铵固体反应需要吸收热量放热反应:化学上把有热量放出的化学反应。一、化学反应中的热量变化吸热反应:化学上把有吸收热量的化学反应。放热反应:①酸碱中和反应 ②所有燃烧反应 ③活泼金属与酸反应 ④大多数的化合反应 ⑤铝热反应 ⑥浓硫酸、CaO等溶解… 等P35交流和讨论理论解释:任何物质都含有能量, 不同物质所含能量不同能量变化符合守恒定律反应的能量是否从无到有,凭空演变出来的??E(反)> ?E(生)?E(反)< ?E(生)能量又来自于哪里呢? 氢气燃烧的反应是放热反应,为什么氢气燃烧还要点燃呢?二、化学反应的本质:旧键断裂,新键形成的过程。P36资料卡释放能量862.6kJ
吸收能量679.1kJ,
故反应最终放热。 436.4KJ/mol242.7KJ/mol431.8KJ/mol吸热放热P37交流和讨论三、反应热1、定义:化学反应中吸收或放出的能量放热反应: ?H为“-”或 ?H < 0吸热反应: ?H为“+”或 ?H > 02、符号:?H表示3、单位:KJ/mol(KJ·mol-1)4、反应热的表示方法:四、热化学方程式H2(g)+ Cl2(g)== 2HCl(g)?H = - 184.6KJ/mol1、定义:表明反应所放出或吸收的热量的化学方程式1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出了184.6KJ的热量。事实探究C(s)+H2O(g)==CO(g)+H2(g) ?H = +131.3 KJ/molH2(g)+ 1/2O2(g)== H2O(l) ?H= - 285.8KJ/mol2H2(g)+ O2(g)== 2H2O(l) ?H= - 571.6KJ/mol事实探究H2(g)+ 1/2O2(g)== H2O(g) ?H= - 241.8KJ/mol比较归纳3、书写热化学方程式时应注意:(1)需注明反应的温度和压强 (不注明指常温常压)。(2)注明?H并注明 “+”或“-”,单位KJ/mol(3)要注明反应物和生成物的状态。气体 gas 液体 liquid 固体 solid(4)热化学方程式的化学计量数只表示物质的量,所以化学计量数可以是分数、小数。(5)化学计量数与?H成正比P35问题解决1、在101325Pa和25oC条件下,2molH2与1molO2反应放出484kJ热量,下列热化学方程式正确的是( )
A.2H2+O2=2H2O; △H=-484kJ/mol
B.H2O(g)= H2(g)+ 1/2O2(g); △H=+242kJ/mol
C.2H2(g)+ O2(g)=2H2O(l); △H=-484kJ/mol
D.H2(g)+1/2 O2(g)= H2O(l); △H=+242kJ/mol
C练习巩固2. 已知1mol乙醇完全燃烧生成二氧化碳和液态水时将放出1366.8kJ热量,写出该反应的热化学方程式。C2H6O(l)+3O2(g)==2CO2(g)+3H2O(l) △H=-1366.8kJ/mol3、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5kJ热量,乙硼烷燃烧的热化学方程式为: 。练习巩固当今人类所使用的燃料主要有哪些?化石燃料“西气东输”工程已经启动,从燃料的效能角度分析,为什么大力去开发天然气呢?五、热值几种燃料的热值热值:在一定条件下单位质量的物质完全燃烧所放出的热量。① 燃料充分燃烧的条件有哪些?
②燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
③ 导致酸雨的主要原因之一是什么?
④ 怎样高效、清洁地利用煤炭?
⑤怎样提高固体和液体燃料的燃烧效率?六、提高燃料的使用效率空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面煤中所含硫在燃烧时会生成SO2要有适当过量的空气,燃料与空气要有足够大的接触面积
巩固练习1、下列说法正确的是( )
A、化学反应除了生成新物质外,还伴随着能量变化
B、放热的反应在常温下一定易进行
C、反应是放热还是吸热是由反应物和生成物所具有的总能量的相对大小决定的
D、需加热才能发生的反应一定是吸热反应AC巩固练习1、下列反应既属于氧化还原反应,又属于放热反应 的是( )
A、铝片与稀硫酸的反应
B、 Ba(OH)2晶体与NH4Cl固体的反应
C、灼烧的碳与二氧化碳的反应
D、甲烷在氧气中的燃烧反应AD练习巩固C(金刚石,s)+ O2(g)==CO2(g)
?H = -395.5KJ/mol5.已知C(石墨,s)+ O2(g)==CO2(g)
?H = -393.4KJ/mol写出石墨转化为金刚石的化学方程式,并判断哪种物质更稳定。C(金刚石,s)== C(石墨,s)
?H = -2.9KJ/mol更稳定课后作业1、阅读教材“资料”“阅读”部分
2、查阅有关资料,了解当前能源技术的发展,预测未来能源技术的突破,想象有可能开发的新能源,以书面形式成文。本课结束放热反应吸热反应化学反应中的能量变化示意图书P37图2-4
有热量放出温度降低发冷氢氧化钙固体与氯化铵固体反应需要吸收热量放热反应:化学上把有热量放出的化学反应。一、化学反应中的热量变化吸热反应:化学上把有吸收热量的化学反应。放热反应:①酸碱中和反应 ②所有燃烧反应 ③活泼金属与酸反应 ④大多数的化合反应 ⑤铝热反应 ⑥浓硫酸、CaO等溶解… 等P35交流和讨论理论解释:任何物质都含有能量, 不同物质所含能量不同能量变化符合守恒定律反应的能量是否从无到有,凭空演变出来的??E(反)> ?E(生)?E(反)< ?E(生)能量又来自于哪里呢? 氢气燃烧的反应是放热反应,为什么氢气燃烧还要点燃呢?二、化学反应的本质:旧键断裂,新键形成的过程。P36资料卡释放能量862.6kJ
吸收能量679.1kJ,
故反应最终放热。 436.4KJ/mol242.7KJ/mol431.8KJ/mol吸热放热P37交流和讨论三、反应热1、定义:化学反应中吸收或放出的能量放热反应: ?H为“-”或 ?H < 0吸热反应: ?H为“+”或 ?H > 02、符号:?H表示3、单位:KJ/mol(KJ·mol-1)4、反应热的表示方法:四、热化学方程式H2(g)+ Cl2(g)== 2HCl(g)?H = - 184.6KJ/mol1、定义:表明反应所放出或吸收的热量的化学方程式1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出了184.6KJ的热量。事实探究C(s)+H2O(g)==CO(g)+H2(g) ?H = +131.3 KJ/molH2(g)+ 1/2O2(g)== H2O(l) ?H= - 285.8KJ/mol2H2(g)+ O2(g)== 2H2O(l) ?H= - 571.6KJ/mol事实探究H2(g)+ 1/2O2(g)== H2O(g) ?H= - 241.8KJ/mol比较归纳3、书写热化学方程式时应注意:(1)需注明反应的温度和压强 (不注明指常温常压)。(2)注明?H并注明 “+”或“-”,单位KJ/mol(3)要注明反应物和生成物的状态。气体 gas 液体 liquid 固体 solid(4)热化学方程式的化学计量数只表示物质的量,所以化学计量数可以是分数、小数。(5)化学计量数与?H成正比P35问题解决1、在101325Pa和25oC条件下,2molH2与1molO2反应放出484kJ热量,下列热化学方程式正确的是( )
A.2H2+O2=2H2O; △H=-484kJ/mol
B.H2O(g)= H2(g)+ 1/2O2(g); △H=+242kJ/mol
C.2H2(g)+ O2(g)=2H2O(l); △H=-484kJ/mol
D.H2(g)+1/2 O2(g)= H2O(l); △H=+242kJ/mol
C练习巩固2. 已知1mol乙醇完全燃烧生成二氧化碳和液态水时将放出1366.8kJ热量,写出该反应的热化学方程式。C2H6O(l)+3O2(g)==2CO2(g)+3H2O(l) △H=-1366.8kJ/mol3、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5kJ热量,乙硼烷燃烧的热化学方程式为: 。练习巩固当今人类所使用的燃料主要有哪些?化石燃料“西气东输”工程已经启动,从燃料的效能角度分析,为什么大力去开发天然气呢?五、热值几种燃料的热值热值:在一定条件下单位质量的物质完全燃烧所放出的热量。① 燃料充分燃烧的条件有哪些?
②燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
③ 导致酸雨的主要原因之一是什么?
④ 怎样高效、清洁地利用煤炭?
⑤怎样提高固体和液体燃料的燃烧效率?六、提高燃料的使用效率空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面煤中所含硫在燃烧时会生成SO2要有适当过量的空气,燃料与空气要有足够大的接触面积
巩固练习1、下列说法正确的是( )
A、化学反应除了生成新物质外,还伴随着能量变化
B、放热的反应在常温下一定易进行
C、反应是放热还是吸热是由反应物和生成物所具有的总能量的相对大小决定的
D、需加热才能发生的反应一定是吸热反应AC巩固练习1、下列反应既属于氧化还原反应,又属于放热反应 的是( )
A、铝片与稀硫酸的反应
B、 Ba(OH)2晶体与NH4Cl固体的反应
C、灼烧的碳与二氧化碳的反应
D、甲烷在氧气中的燃烧反应AD练习巩固C(金刚石,s)+ O2(g)==CO2(g)
?H = -395.5KJ/mol5.已知C(石墨,s)+ O2(g)==CO2(g)
?H = -393.4KJ/mol写出石墨转化为金刚石的化学方程式,并判断哪种物质更稳定。C(金刚石,s)== C(石墨,s)
?H = -2.9KJ/mol更稳定课后作业1、阅读教材“资料”“阅读”部分
2、查阅有关资料,了解当前能源技术的发展,预测未来能源技术的突破,想象有可能开发的新能源,以书面形式成文。本课结束放热反应吸热反应化学反应中的能量变化示意图书P37图2-4
