会考复习-元素周期表,元素周期律(浙江省舟山市)
文档属性
| 名称 | 会考复习-元素周期表,元素周期律(浙江省舟山市) |  | |
| 格式 | rar | ||
| 文件大小 | 363.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-08-30 08:12:00 | ||
图片预览





文档简介
课件14张PPT。会考复习之
元素周期表
元素周期律
元素周期表的编排原则原子序数 =核电荷数
=质子数
=核外电子数(电中性原子) ⑴ 按原子序数的递增顺序从左到右排列 ⑵ 将电子层数相同的元素排列成一个横行(周期) ⑶ 把最外层电子数相同的元素按电子层数递增
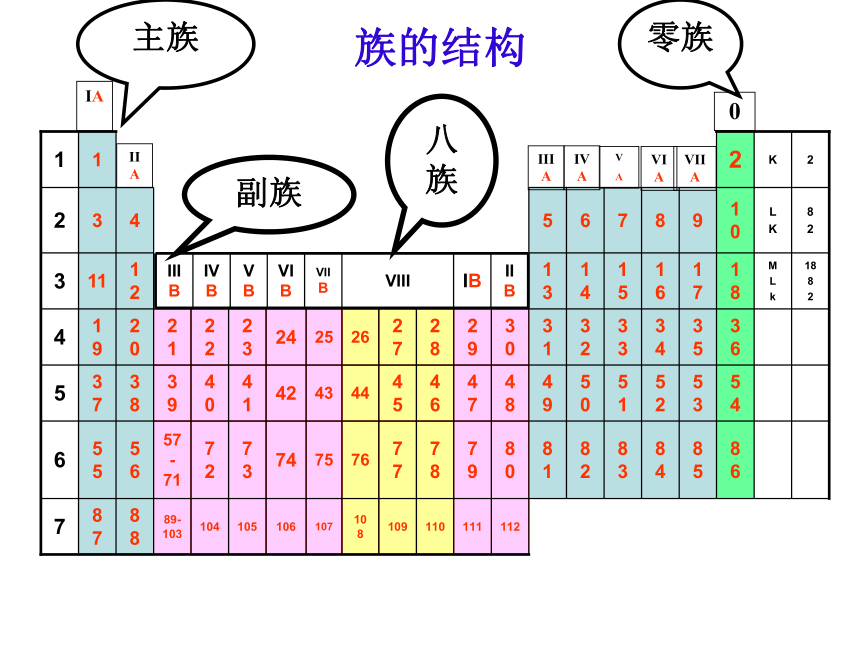
的顺序从上到下排成纵行。(族)IAIIAIIIAIVAV
AVIAVIIA0主族副族八族零族族的结构元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:第5周期:第6周期:不完全周期第7周期:周期序数 = 电子层数 (横向)小结:(1)周期数(7) :三短、三长、一不全
(2)周期序数 = 核外电子层数 。
(3)每一周期都是从碱金属开始,过渡到卤素,
到稀有气体结束 。
(4)族数(16) :七主、七副、0和Ⅷ
(5)主族序数 = 最外层电子数元素周期表分区(1)金属区:周期表的左下方(2)非金属区:周期表的右上方(3)稀有气体区:周期表的最右方[练习]:1、第三周期第IVA族的元素原子序数是:
2、Na元素的原子序数为11,相邻的同族元素的原子序数是:
3、短周期元素中,
族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
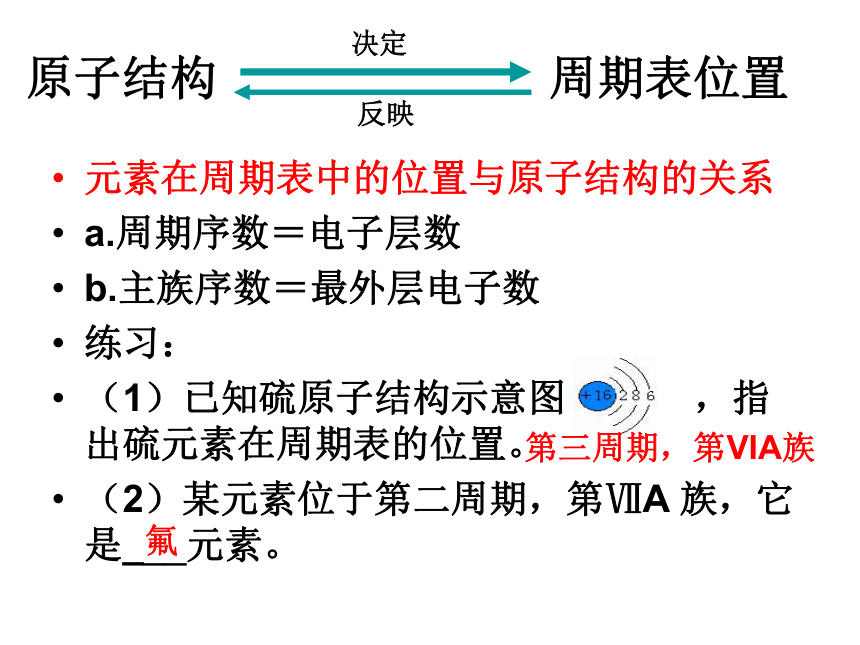
周期序数=族序数2倍的有:143,19H,Be,AlC,SLi元素在周期表中的位置与原子结构的关系
a.周期序数=电子层数
b.主族序数=最外层电子数
练习:
(1)已知硫原子结构示意图 ,指出硫元素在周期表的位置。
(2)某元素位于第二周期,第ⅦA 族,它是___元素。原子结构 周期表位置决定反映第三周期,第VIA族氟2.元素主要化合价的周期性变化
①氧元素无正价,氟元素无正价,
金属元素无负价,惰性元素为零价。
②元素的最高正价=最外层电子数
③只有非金属才有负价,
且∣负价数值∣+∣正价数值∣=8。二、元素周期律
1.元素最外层电子数周期性变化
最外层电子数由1递增到8(除了第一周期)元素性质的周期性变化规律是元素原子核外电子排布周期性变化的必然结果。 3.原子半径的周期性变化
①同一周期,从左到右,原子半径依次减小。
②同一主族,从上到下,原子半径依次增大。
③核外电子数相同的微粒,核电荷数越大,半径越小。 4.元素的金属性与非金属性强弱变化
金属性逐渐增强非金属性逐渐增强金属性逐渐增强非金属性逐渐增强B
Al Si
Ge As
Sb Te
Po At 半径由大变小半径由小变大 元素金属性 元素单质与酸反应的难易 元素单质与水反应的难易元素的最高价氧化物的水化物的碱性强弱元素最高价氧化物的水化物的酸性强弱元素单质与氢气反应的难易 气态氢化物的稳定性 元素非金属性(易~强)(强~强)(易~强)(强~强)(易~强)(稳定~强)规 律相互置换相互置换元素的金属性、非金属性:练习1. 金属性最强的元素(不包括放射性元素) ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素
(不包括放射性元素)是 。CsFClCs2、 同电子层的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性是:H3XO4A、非金属性强弱为:X>Y>Z
B、气态氢化物的稳定性由强到弱为X、Y、Z
C、原子半径大小是:XD、对应阴离子的还原性按X、Y、Z顺序减弱3.X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是
A.X>Y>Z B. Y>X>Z
C. Z>X>Y D. Z>Y>X
4.下列微粒半径之比大于1的是
A. B.
C. D.5、能说明氯的非金属性比硫强的事实是
A、氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢
B、向硫化氢的水溶液中通入氯气可得到淡黄色的硫
C、氯气能与水反应而硫不能
D、氯原子最外电子层上有7个电子而硫最外电子层上有6个电子6、1-18号中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是内层电子总数的一半,Y的二价阴离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是
A、Z是酸性氧化物 B、Z的水化物是碱
C、Z的化学式为X2Y D、Z的水化物的酸性强于硫酸7、某元素最高正价氧化物对应的水化物的化学式是 H2XO4,这种元素的气态氢化物的化学式为
A、 HX B、 H2X C、 XH3 D、 XH4
8、A元素的最高正化合价和负化合价的绝对值之差6,B元素与A元素的原子次外层上的电子数均为8,A与B可形成化合物BA2,则该化合物是
A、MgCl2 B、CaF2 C、SiO2 D、CS2
元素周期表
元素周期律
元素周期表的编排原则原子序数 =核电荷数
=质子数
=核外电子数(电中性原子) ⑴ 按原子序数的递增顺序从左到右排列 ⑵ 将电子层数相同的元素排列成一个横行(周期) ⑶ 把最外层电子数相同的元素按电子层数递增
的顺序从上到下排成纵行。(族)IAIIAIIIAIVAV
AVIAVIIA0主族副族八族零族族的结构元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:第5周期:第6周期:不完全周期第7周期:周期序数 = 电子层数 (横向)小结:(1)周期数(7) :三短、三长、一不全
(2)周期序数 = 核外电子层数 。
(3)每一周期都是从碱金属开始,过渡到卤素,
到稀有气体结束 。
(4)族数(16) :七主、七副、0和Ⅷ
(5)主族序数 = 最外层电子数元素周期表分区(1)金属区:周期表的左下方(2)非金属区:周期表的右上方(3)稀有气体区:周期表的最右方[练习]:1、第三周期第IVA族的元素原子序数是:
2、Na元素的原子序数为11,相邻的同族元素的原子序数是:
3、短周期元素中,
族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有:143,19H,Be,AlC,SLi元素在周期表中的位置与原子结构的关系
a.周期序数=电子层数
b.主族序数=最外层电子数
练习:
(1)已知硫原子结构示意图 ,指出硫元素在周期表的位置。
(2)某元素位于第二周期,第ⅦA 族,它是___元素。原子结构 周期表位置决定反映第三周期,第VIA族氟2.元素主要化合价的周期性变化
①氧元素无正价,氟元素无正价,
金属元素无负价,惰性元素为零价。
②元素的最高正价=最外层电子数
③只有非金属才有负价,
且∣负价数值∣+∣正价数值∣=8。二、元素周期律
1.元素最外层电子数周期性变化
最外层电子数由1递增到8(除了第一周期)元素性质的周期性变化规律是元素原子核外电子排布周期性变化的必然结果。 3.原子半径的周期性变化
①同一周期,从左到右,原子半径依次减小。
②同一主族,从上到下,原子半径依次增大。
③核外电子数相同的微粒,核电荷数越大,半径越小。 4.元素的金属性与非金属性强弱变化
金属性逐渐增强非金属性逐渐增强金属性逐渐增强非金属性逐渐增强B
Al Si
Ge As
Sb Te
Po At 半径由大变小半径由小变大 元素金属性 元素单质与酸反应的难易 元素单质与水反应的难易元素的最高价氧化物的水化物的碱性强弱元素最高价氧化物的水化物的酸性强弱元素单质与氢气反应的难易 气态氢化物的稳定性 元素非金属性(易~强)(强~强)(易~强)(强~强)(易~强)(稳定~强)规 律相互置换相互置换元素的金属性、非金属性:练习1. 金属性最强的元素(不包括放射性元素) ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素
(不包括放射性元素)是 。CsFClCs2、 同电子层的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性是:H3XO4
B、气态氢化物的稳定性由强到弱为X、Y、Z
C、原子半径大小是:X
A.X>Y>Z B. Y>X>Z
C. Z>X>Y D. Z>Y>X
4.下列微粒半径之比大于1的是
A. B.
C. D.5、能说明氯的非金属性比硫强的事实是
A、氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢
B、向硫化氢的水溶液中通入氯气可得到淡黄色的硫
C、氯气能与水反应而硫不能
D、氯原子最外电子层上有7个电子而硫最外电子层上有6个电子6、1-18号中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是内层电子总数的一半,Y的二价阴离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是
A、Z是酸性氧化物 B、Z的水化物是碱
C、Z的化学式为X2Y D、Z的水化物的酸性强于硫酸7、某元素最高正价氧化物对应的水化物的化学式是 H2XO4,这种元素的气态氢化物的化学式为
A、 HX B、 H2X C、 XH3 D、 XH4
8、A元素的最高正化合价和负化合价的绝对值之差6,B元素与A元素的原子次外层上的电子数均为8,A与B可形成化合物BA2,则该化合物是
A、MgCl2 B、CaF2 C、SiO2 D、CS2
同课章节目录
