会考复习元素化合物二氧化硫的性质和应用(浙江省舟山市)
文档属性
| 名称 | 会考复习元素化合物二氧化硫的性质和应用(浙江省舟山市) |

|
|
| 格式 | rar | ||
| 文件大小 | 373.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-08-30 00:00:00 | ||
图片预览




文档简介
课件11张PPT。会考复习元素化合物
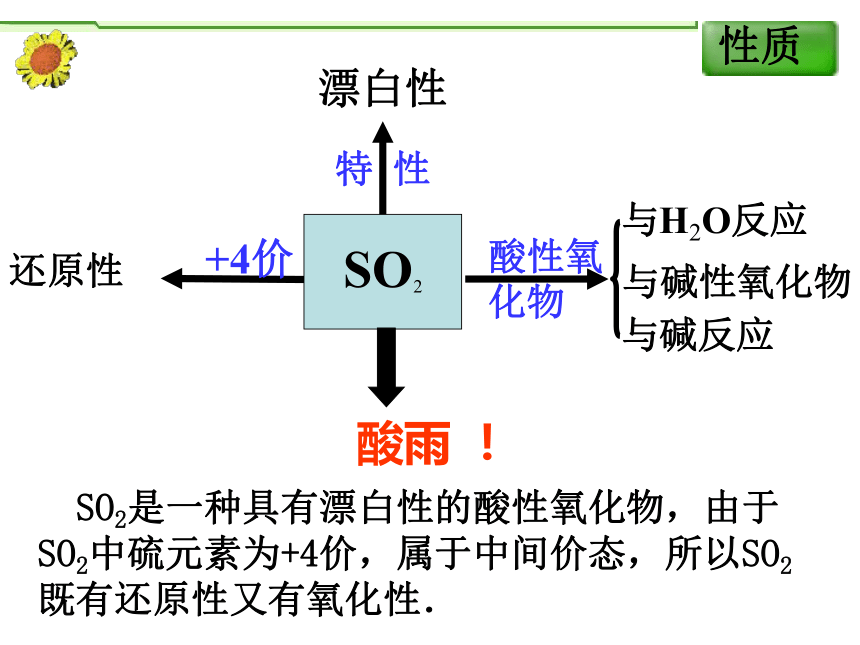
--二氧化硫的性质和应用 无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40).SO2还原性酸雨 ! SO2是一种具有漂白性的酸性氧化物,由于SO2中硫元素为+4价,属于中间价态,所以SO2既有还原性又有氧化性.(1)②中的实验现象是 此实验证实了SO2水溶液显
(2)⑤中的品红溶液 ,证明SO2 有 性。
(3)①中的实验现象是 ,证明SO2 有 性。
(4)③的作用是
反应方程式是变红酸性褪色漂白溶液褪色还原吸收二氧化硫,防止其污染环境SO2+2NaOH=Na2SO3+H2O⑴与水反应 ⑵与碱反应⑶与碱性氧化物的反应(不稳定的中强酸)酸性氧化物的性质还原性漂白性 SO2 与某些有色物质结合生成无色物质,但是这些无色物质不稳定,容易分解而恢复原来的颜色.SO2不能漂白酸碱指示剂,如SO2只能使紫色石蕊试液变红,不能使它褪色。SO2+ Cl2 +2H2O = 2HCl+H2SO4 简单应用:若将等物质的量的SO2和Cl2这两种气体混合后,同时作用于潮湿的红色布条,可观察到红布条
A、慢慢褪色 B、立即褪色
C、先褪色后恢复原来颜色 D、不褪色SO2能使溴水、KMnO4溶液褪色表现的是SO2的还原性
SO2使品红褪色表现的是其漂白性。SO2+Br2+2H2O=H2SO4+2HBr5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4DSO2+Cl2+2H2O = 2HCl+H2SO4 问题1: SO2能使溴水、KMnO4溶液褪色与
SO2使品红褪色,实质相同吗? 几种漂白性物质的比较暂时性永久性永久性永久性化学过程化学过程化学过程化学过程HClO强氧化性Na2O2氧化性H2O2氧化性生成不稳定的无色物质过氧化氢过氧化钠氯水二氧化硫②酸雨的成因和防治 ②酸雨的成因和防治氨水法石灰石-石膏法
--二氧化硫的性质和应用 无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40).SO2还原性酸雨 ! SO2是一种具有漂白性的酸性氧化物,由于SO2中硫元素为+4价,属于中间价态,所以SO2既有还原性又有氧化性.(1)②中的实验现象是 此实验证实了SO2水溶液显
(2)⑤中的品红溶液 ,证明SO2 有 性。
(3)①中的实验现象是 ,证明SO2 有 性。
(4)③的作用是
反应方程式是变红酸性褪色漂白溶液褪色还原吸收二氧化硫,防止其污染环境SO2+2NaOH=Na2SO3+H2O⑴与水反应 ⑵与碱反应⑶与碱性氧化物的反应(不稳定的中强酸)酸性氧化物的性质还原性漂白性 SO2 与某些有色物质结合生成无色物质,但是这些无色物质不稳定,容易分解而恢复原来的颜色.SO2不能漂白酸碱指示剂,如SO2只能使紫色石蕊试液变红,不能使它褪色。SO2+ Cl2 +2H2O = 2HCl+H2SO4 简单应用:若将等物质的量的SO2和Cl2这两种气体混合后,同时作用于潮湿的红色布条,可观察到红布条
A、慢慢褪色 B、立即褪色
C、先褪色后恢复原来颜色 D、不褪色SO2能使溴水、KMnO4溶液褪色表现的是SO2的还原性
SO2使品红褪色表现的是其漂白性。SO2+Br2+2H2O=H2SO4+2HBr5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4DSO2+Cl2+2H2O = 2HCl+H2SO4 问题1: SO2能使溴水、KMnO4溶液褪色与
SO2使品红褪色,实质相同吗? 几种漂白性物质的比较暂时性永久性永久性永久性化学过程化学过程化学过程化学过程HClO强氧化性Na2O2氧化性H2O2氧化性生成不稳定的无色物质过氧化氢过氧化钠氯水二氧化硫②酸雨的成因和防治 ②酸雨的成因和防治氨水法石灰石-石膏法
同课章节目录
