硫酸(浙江省台州市椒江区)
图片预览








文档简介
课件29张PPT。盐酸 硫酸 硝酸“三大强酸”?H2SO4硫酸酸的通性1、 能和酸碱指示剂反应遇到紫色石蕊试液变红遇到酚酞试液不变色2、和碱发生中和反应:如:2NaOH+ H2SO4=Na2SO4+2H2O3、和碱性氧化物反应:如:CuO+ H2SO4=CuSO4+H2O4、和活泼金属反应:5、和某些盐发生复分解反应:H2SO4=2H++SO42-有关反应的化学方程式、离子方程式:
BaCl2 + H2SO4== BaSO4 ↓ + 2HCl Zn+2H+ = Zn2++H2 ↑Fe2O3 + 3H2SO4== Fe2(SO4)3+ 3H2O 2NaOH + H2SO4== Na2SO4+ 2H2O Zn + H2SO4== ZnSO4+ H2 ↑Fe2O3+6H+=2Fe3++3H2OOH-+H+ = H2OBa2++ SO42- = BaSO4↓色 态:无 色, 油状液体
沸 点 :高 (338 ?C ) ,难挥发性酸
用途:实验室制取易挥发性(如HCl ,HNO3)浓硫酸的物理性质密 度 :大(1.84g/mL)
变化规律:硫酸溶液的密度随质量分数的增大而增大溶解性 :溶解度大(互溶)
并放出大量的热。
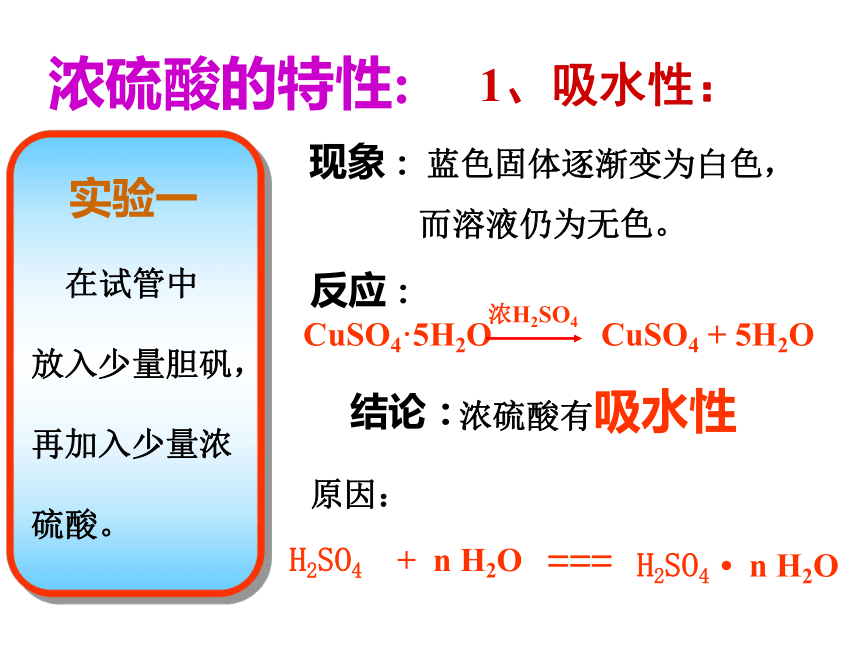
怎样稀释浓硫酸?浓硫酸稀释时的操作: 正确操作: 将浓硫酸沿器壁缓缓地注入水中,并用玻棒不断搅拌,使热量迅速扩散。切记:不可把水倒进浓硫酸中!浓硫酸的特性:1、吸水性:现象: 蓝色固体逐渐变为白色,
而溶液仍为无色。反应:结论:浓硫酸有吸水性原因:可用于干燥: H2、O2、N2 、 CO 、 CH4 、 Cl2 、CO2 、 HCl 、 SO2等); 不可干燥 :碱性气体(NH3)、
还原性气体 (HI、HBr 、H2S 等)用途:可作干燥剂思考:把一瓶浓硫酸打开瓶盖露置在空气中一段时间之后,会有什么变化? 答:质量变大了。因为浓硫酸有吸水性,吸收空气中的水分后使质量增加。 2、脱水性现象:变黑解释: 纸的主要成份是纤维素,
由C、H、O三种元素组成。结论:浓硫酸有脱水性 浓硫酸能把纸中的H、O元素按水的比例(2:1)脱去思
考
浓硫酸沾在皮肤上的紧急处理:应该立刻用干布拭去,再大量的清水冲洗,再涂上一层3%—5%的小苏打(NaHCO3)溶液。若浓碱液沾在皮肤上该怎么办? 清华学子刘海洋浓硫酸泼熊事件学会比较区别 吸水性: 吸收游离水或结晶水 脱水性:将有机物中的氢、氧元素按水的比例脱去。吸水性与脱水性有何区别?现象: ①固:红→黑 ②气:无色有刺激性气味,使酸性KMnO4溶液退色;使品红溶液退色;使紫色石蕊试液变红。 ③液:无→棕黑→蓝色。思考:在这个反应中,硫酸起了什么作用?CuO+H2SO4==CuSO4+H2O(1)与金属反应体现氧化性体现酸性总反应式:被还原的硫酸只占了1/2转移了2个电子3、强氧化性常温:能与活泼金属反应。与铁、铝等接触时会发生钝化。注意: 钝化并非不反应,是因为氧化而钝化。铁、铝等表面因氧化生成一层致密的氧化膜,阻止内部金属继续跟浓硫酸反应,这种现象称为“钝化”。通常情况下,浓硫酸可用铁制容器或铝制容器贮存和运输。[思考]浓硫酸在加热时能氧化铜,那么能氧化其他金属吗? 加热:能与大多数金属(Au、Pt除外)反应, 规律:H之前金属与浓硫酸反应,产物复杂,大纲不作要求,但要注意反应不生成H2。浓硫酸与不活泼金属反应,生成物中金属显高价,同时生成二氧化硫。 稀硫酸与活泼金属反应生成H2氧化性由H+体现弱氧化性浓硫酸加热可与大多数金属、非金属反应生成SO2氧化性由+6价S体现强氧化性⑵、与某些非金属反应 0+4失4e—+6+4得2×2e—还原剂氧化剂H2S+ H2SO4(浓) =S ↓+2H2O+SO2 ↑2HI+H2SO4(浓)=I2+SO2 ↑ +2H2O⑶ 、 与H2S ,HI等强还原剂的反应-20失2e-+6+4得2e-现象: 蔗糖变黑,体积膨胀,呈疏松海绵状,放出有刺激性气味的气体,放出大量热。反应:结论: 体现出浓硫酸的吸水性、脱水性和强氧化性实验:向蔗糖中加入浓硫酸结论:浓硫酸具有吸水性、 脱水性、强氧化性 设计一实验,证明浓硫酸与碳反应的生成物含有二氧化硫、二氧化碳 和 水。无水硫酸铜品红溶液品红溶液酸性高锰酸钾溶液石灰水证明含SO2除去SO2证明无SO2 ,
已经除尽证明含CO2证明含水思考题变蓝色褪色褪色不褪色变浑浊硫酸的用途:
1.制易挥发性酸——难挥发性 2.制蓄电池——强电解质;
3.酸洗、制化肥——酸性; 4.干燥剂——吸水性;
5.制炸药——强氧化性.● SO42-的检验方法 在中学化学里常常先用盐酸把溶液酸化,以排除CO32-、SO32-、Ag+等可能造成的干扰,再加入BaCl2溶液,根据是否有白色沉淀出现来判断原溶液中是否有SO42-存在。X+HCl溶液酸化排除CO32-、SO32-、Ag+干扰+BaCl2溶液白色沉淀证明SO42-存在2、硫酸在下列用途或反应中各表现的性质是:
A、强酸性 B、难挥发性 C、吸水性
D、脱水性 E、强氧化性
(1)实验室制SO2气体________;
(2)干燥H2、SO2等气体________;
(3)用铝槽车装运浓硫酸________;
(4)清洗镀件表面氧化物________;
(5)浓硫酸使湿润石蕊试纸变红,后来又变黑
________________________________________________ 1.如何鉴别失去标签的稀硫酸和浓硫酸?请 同学们提出尽可能多的方案 1、将下列现象中硫酸表现出来的性质写在空白处:(1)敞口放置浓硫酸时,质量增加,
(2)把CuSO4?5H2O 晶体放入浓硫酸中,变白色,
(3)锌粒放入稀硫酸中,有气体放出,
(4)把木屑放入浓硫酸中,变黑, 练习:吸水性吸水性酸性、氧化性脱水性2、储存浓硫酸的铁罐外口出现严重的腐蚀现象,这体现浓硫酸的 ( )
A.脱水性和吸水性 B.吸水性和酸性
C.强氧化性和吸水性 D.不挥发性与酸性B讨论:如何用实验方法鉴别
NaCl、Na2SO4、NaNO3、Na2CO3四种溶液?NaCl、Na2SO4、NaNO3、Na2CO3+ Ba(NO3)2有白色沉淀生成无白色沉淀生成Na2SO4、Na2CO3NaCl、NaNO3继续加HCl取原溶液加AgNO3溶液白色沉淀消失白色沉淀不消失有白色沉
淀生成无白色沉
淀生成Na2CO3Na2SO4NaClNaNO3H2S+ H2SO4(浓) =S ↓+2H2O+SO2 ↑2HI+H2SO4(浓)=I2+SO2 ↑ +2H2O与H2S ,HI等强还原剂的反应
BaCl2 + H2SO4== BaSO4 ↓ + 2HCl Zn+2H+ = Zn2++H2 ↑Fe2O3 + 3H2SO4== Fe2(SO4)3+ 3H2O 2NaOH + H2SO4== Na2SO4+ 2H2O Zn + H2SO4== ZnSO4+ H2 ↑Fe2O3+6H+=2Fe3++3H2OOH-+H+ = H2OBa2++ SO42- = BaSO4↓色 态:无 色, 油状液体
沸 点 :高 (338 ?C ) ,难挥发性酸
用途:实验室制取易挥发性(如HCl ,HNO3)浓硫酸的物理性质密 度 :大(1.84g/mL)
变化规律:硫酸溶液的密度随质量分数的增大而增大溶解性 :溶解度大(互溶)
并放出大量的热。
怎样稀释浓硫酸?浓硫酸稀释时的操作: 正确操作: 将浓硫酸沿器壁缓缓地注入水中,并用玻棒不断搅拌,使热量迅速扩散。切记:不可把水倒进浓硫酸中!浓硫酸的特性:1、吸水性:现象: 蓝色固体逐渐变为白色,
而溶液仍为无色。反应:结论:浓硫酸有吸水性原因:可用于干燥: H2、O2、N2 、 CO 、 CH4 、 Cl2 、CO2 、 HCl 、 SO2等); 不可干燥 :碱性气体(NH3)、
还原性气体 (HI、HBr 、H2S 等)用途:可作干燥剂思考:把一瓶浓硫酸打开瓶盖露置在空气中一段时间之后,会有什么变化? 答:质量变大了。因为浓硫酸有吸水性,吸收空气中的水分后使质量增加。 2、脱水性现象:变黑解释: 纸的主要成份是纤维素,
由C、H、O三种元素组成。结论:浓硫酸有脱水性 浓硫酸能把纸中的H、O元素按水的比例(2:1)脱去思
考
浓硫酸沾在皮肤上的紧急处理:应该立刻用干布拭去,再大量的清水冲洗,再涂上一层3%—5%的小苏打(NaHCO3)溶液。若浓碱液沾在皮肤上该怎么办? 清华学子刘海洋浓硫酸泼熊事件学会比较区别 吸水性: 吸收游离水或结晶水 脱水性:将有机物中的氢、氧元素按水的比例脱去。吸水性与脱水性有何区别?现象: ①固:红→黑 ②气:无色有刺激性气味,使酸性KMnO4溶液退色;使品红溶液退色;使紫色石蕊试液变红。 ③液:无→棕黑→蓝色。思考:在这个反应中,硫酸起了什么作用?CuO+H2SO4==CuSO4+H2O(1)与金属反应体现氧化性体现酸性总反应式:被还原的硫酸只占了1/2转移了2个电子3、强氧化性常温:能与活泼金属反应。与铁、铝等接触时会发生钝化。注意: 钝化并非不反应,是因为氧化而钝化。铁、铝等表面因氧化生成一层致密的氧化膜,阻止内部金属继续跟浓硫酸反应,这种现象称为“钝化”。通常情况下,浓硫酸可用铁制容器或铝制容器贮存和运输。[思考]浓硫酸在加热时能氧化铜,那么能氧化其他金属吗? 加热:能与大多数金属(Au、Pt除外)反应, 规律:H之前金属与浓硫酸反应,产物复杂,大纲不作要求,但要注意反应不生成H2。浓硫酸与不活泼金属反应,生成物中金属显高价,同时生成二氧化硫。 稀硫酸与活泼金属反应生成H2氧化性由H+体现弱氧化性浓硫酸加热可与大多数金属、非金属反应生成SO2氧化性由+6价S体现强氧化性⑵、与某些非金属反应 0+4失4e—+6+4得2×2e—还原剂氧化剂H2S+ H2SO4(浓) =S ↓+2H2O+SO2 ↑2HI+H2SO4(浓)=I2+SO2 ↑ +2H2O⑶ 、 与H2S ,HI等强还原剂的反应-20失2e-+6+4得2e-现象: 蔗糖变黑,体积膨胀,呈疏松海绵状,放出有刺激性气味的气体,放出大量热。反应:结论: 体现出浓硫酸的吸水性、脱水性和强氧化性实验:向蔗糖中加入浓硫酸结论:浓硫酸具有吸水性、 脱水性、强氧化性 设计一实验,证明浓硫酸与碳反应的生成物含有二氧化硫、二氧化碳 和 水。无水硫酸铜品红溶液品红溶液酸性高锰酸钾溶液石灰水证明含SO2除去SO2证明无SO2 ,
已经除尽证明含CO2证明含水思考题变蓝色褪色褪色不褪色变浑浊硫酸的用途:
1.制易挥发性酸——难挥发性 2.制蓄电池——强电解质;
3.酸洗、制化肥——酸性; 4.干燥剂——吸水性;
5.制炸药——强氧化性.● SO42-的检验方法 在中学化学里常常先用盐酸把溶液酸化,以排除CO32-、SO32-、Ag+等可能造成的干扰,再加入BaCl2溶液,根据是否有白色沉淀出现来判断原溶液中是否有SO42-存在。X+HCl溶液酸化排除CO32-、SO32-、Ag+干扰+BaCl2溶液白色沉淀证明SO42-存在2、硫酸在下列用途或反应中各表现的性质是:
A、强酸性 B、难挥发性 C、吸水性
D、脱水性 E、强氧化性
(1)实验室制SO2气体________;
(2)干燥H2、SO2等气体________;
(3)用铝槽车装运浓硫酸________;
(4)清洗镀件表面氧化物________;
(5)浓硫酸使湿润石蕊试纸变红,后来又变黑
________________________________________________ 1.如何鉴别失去标签的稀硫酸和浓硫酸?请 同学们提出尽可能多的方案 1、将下列现象中硫酸表现出来的性质写在空白处:(1)敞口放置浓硫酸时,质量增加,
(2)把CuSO4?5H2O 晶体放入浓硫酸中,变白色,
(3)锌粒放入稀硫酸中,有气体放出,
(4)把木屑放入浓硫酸中,变黑, 练习:吸水性吸水性酸性、氧化性脱水性2、储存浓硫酸的铁罐外口出现严重的腐蚀现象,这体现浓硫酸的 ( )
A.脱水性和吸水性 B.吸水性和酸性
C.强氧化性和吸水性 D.不挥发性与酸性B讨论:如何用实验方法鉴别
NaCl、Na2SO4、NaNO3、Na2CO3四种溶液?NaCl、Na2SO4、NaNO3、Na2CO3+ Ba(NO3)2有白色沉淀生成无白色沉淀生成Na2SO4、Na2CO3NaCl、NaNO3继续加HCl取原溶液加AgNO3溶液白色沉淀消失白色沉淀不消失有白色沉
淀生成无白色沉
淀生成Na2CO3Na2SO4NaClNaNO3H2S+ H2SO4(浓) =S ↓+2H2O+SO2 ↑2HI+H2SO4(浓)=I2+SO2 ↑ +2H2O与H2S ,HI等强还原剂的反应
