离子反应(浙江省台州市椒江区)
图片预览




文档简介
课件15张PPT。离 子 反 应在下列物质中:①CH3COOH ②HCl
③KOH ④Ba(OH)2 ⑤AgCl ⑥Na2SO4
⑦C2H5OH ⑧H2O ⑨SO2 ⑩Cu
(1)属于电解质的是____________
(2)属于非电解质的是____________
①②③④⑤⑥⑧ ⑦ ⑨练习: 40mL 40mL 40mL 40mL 40mL
0.001mol/L 0.1mol/L 0.1mol/L 0.1mol/L 0.1mol/L
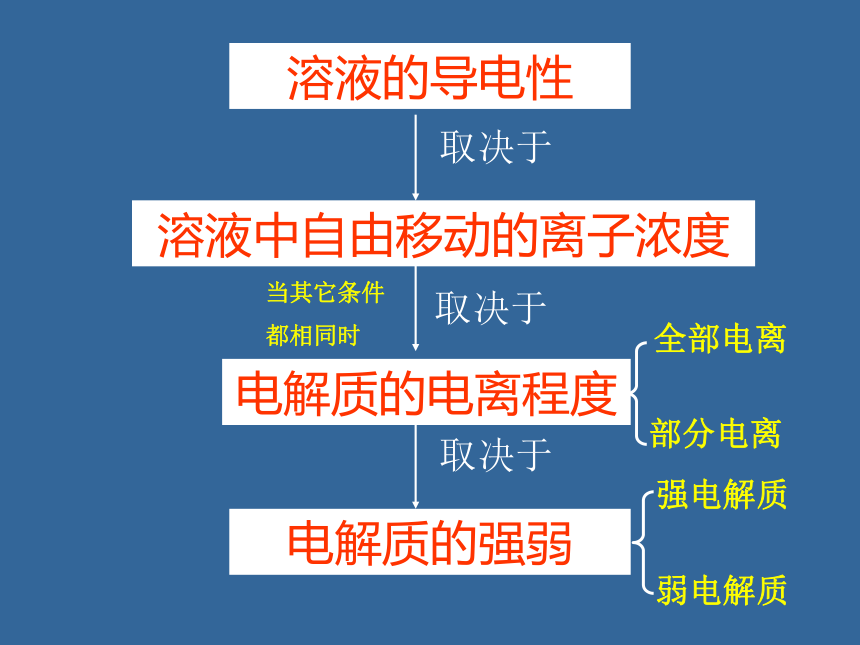
NaCl溶液 NaCl 溶液 氨水 盐酸 醋酸溶液 暗 亮 暗 亮 暗电解质溶液导电性的探究溶液的导电性溶液中自由移动的离子浓度电解质的电离程度电解质的强弱全部电离部分电离强电解质弱电解质完全电离部分电离离子离子
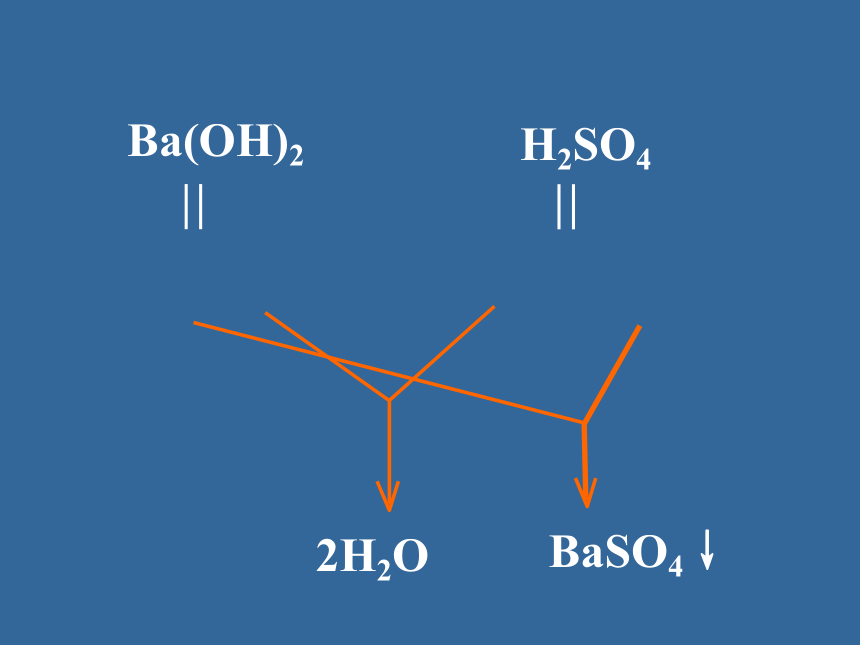
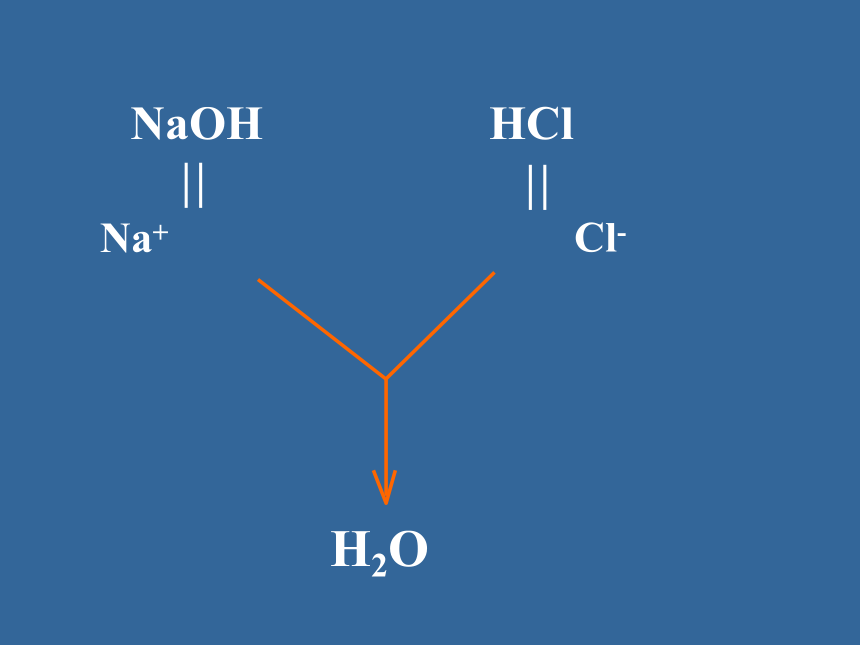
分子大多数盐、强酸、强碱弱酸、弱碱水==强弱电解质的差异H2SO4Ba(OH)2HClNaOHNH3·H2OCH3COOH书写原则 在溶液中的反应,反应物或生成物有可溶性的强酸、强碱、盐出现,在离子方程式的书写中一律拆成相应的离子形式,其余一律用化学式表示。强酸:盐酸、硫酸、硝酸等;强碱:氢氧化钠、氢氧化钾等可溶性的盐:氯化钠、硫酸铜、硝酸钾等H+ + OH- == H2O等离子方程式代表了一类反应.1、离子反应的实质:2、发生离子反应的条件某些离子浓度减少 的过程复分解反应的条件易挥发的物质难电离的物质难溶的物质书写离子反应方程式的注意点:“一看”反应是否符合实际;“二看”能否写出离子反应方程式;“三看”化学用语是否正确;“四看”离子配比是否合理;“五看”两个守恒是否符合;“六看”是否注意量的不同,产物不同;B试一试:
1.在无色溶液中能大量共存的离子是 ( )
A.Na+、Mg2+、Cl-、SO42- B.K+、 Mg2+、OH-、NO3-
C. Na+、Ca2+、Cl-、CO32- D. Na+、 K+、MnO4-、 SO42- 2.有人欲配制含有四种不同阴阳离子的水溶液,下列能配制成的是 ( )
A.Fe2+、H+、NO3-、Cl- B.Ca2+、H+、Cl-、HCO3-
C.Mg2+、Al3+、Cl-、SO42- D.Na+、Ca2+ 、CO32- 、NO3-AC
③KOH ④Ba(OH)2 ⑤AgCl ⑥Na2SO4
⑦C2H5OH ⑧H2O ⑨SO2 ⑩Cu
(1)属于电解质的是____________
(2)属于非电解质的是____________
①②③④⑤⑥⑧ ⑦ ⑨练习: 40mL 40mL 40mL 40mL 40mL
0.001mol/L 0.1mol/L 0.1mol/L 0.1mol/L 0.1mol/L
NaCl溶液 NaCl 溶液 氨水 盐酸 醋酸溶液 暗 亮 暗 亮 暗电解质溶液导电性的探究溶液的导电性溶液中自由移动的离子浓度电解质的电离程度电解质的强弱全部电离部分电离强电解质弱电解质完全电离部分电离离子离子
分子大多数盐、强酸、强碱弱酸、弱碱水==强弱电解质的差异H2SO4Ba(OH)2HClNaOHNH3·H2OCH3COOH书写原则 在溶液中的反应,反应物或生成物有可溶性的强酸、强碱、盐出现,在离子方程式的书写中一律拆成相应的离子形式,其余一律用化学式表示。强酸:盐酸、硫酸、硝酸等;强碱:氢氧化钠、氢氧化钾等可溶性的盐:氯化钠、硫酸铜、硝酸钾等H+ + OH- == H2O等离子方程式代表了一类反应.1、离子反应的实质:2、发生离子反应的条件某些离子浓度减少 的过程复分解反应的条件易挥发的物质难电离的物质难溶的物质书写离子反应方程式的注意点:“一看”反应是否符合实际;“二看”能否写出离子反应方程式;“三看”化学用语是否正确;“四看”离子配比是否合理;“五看”两个守恒是否符合;“六看”是否注意量的不同,产物不同;B试一试:
1.在无色溶液中能大量共存的离子是 ( )
A.Na+、Mg2+、Cl-、SO42- B.K+、 Mg2+、OH-、NO3-
C. Na+、Ca2+、Cl-、CO32- D. Na+、 K+、MnO4-、 SO42- 2.有人欲配制含有四种不同阴阳离子的水溶液,下列能配制成的是 ( )
A.Fe2+、H+、NO3-、Cl- B.Ca2+、H+、Cl-、HCO3-
C.Mg2+、Al3+、Cl-、SO42- D.Na+、Ca2+ 、CO32- 、NO3-AC
