含硫化合物的性质和应用(浙江省台州市椒江区)
文档属性
| 名称 | 含硫化合物的性质和应用(浙江省台州市椒江区) |

|
|
| 格式 | rar | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-08-30 00:00:00 | ||
图片预览











文档简介
课件38张PPT。第一单元 含硫化合物的性质和应用二氧化硫的性质与作用专题4 硫氮和可持续发展 食品“化妆品”——二氧化硫SO2气体知多少?3、市场有一些豆腐皮、粉丝、银耳,二氧化硫残留超标严重,危害人体健康。2、空气质量日报的主要内容:SO2、NO2和总悬浮颗粒1、在大气中形成酸雨:PH<5.6的雨水,我国和北欧、北美一起构成世界三大酸雨区4、点燃火柴、燃放鞭炮均能生成SO2。课题:现有一小试管的的SO2,怎样了解它的物理性质?观察----------------无色气体生活经验----------有毒分子量-------------密度比空气重闻气味-------------有刺激性气味溶解实验---------易溶于水(发生呼吸道疾病)1体积水大约能溶解40体积的SO2 课题:SO2与CO2组成上相似,它是不是酸性氧化物?请设计实验来验证?方案二:向SO2的水溶液中滴加石蕊,若变红说明SO2能与水反应生成酸,是酸性氧化物。方案三:向集满SO2的试管中滴加少量溶有酚酞的NaOH水溶液,若红色褪去,说明SO2能与碱反应,是酸性氧化物。方案一:测SO2的水溶液的PH值,若PH<7,是酸性氧化物。 SO2 + Ca(OH)2 ==CaSO3 ↓+ H2OSO2 + CaSO3 + H2O == Ca(HSO3)2思考:将足量的SO2气体缓慢地通入澄清石灰水,可能会有什么现象,为什么?现象:先产生白色沉淀,后逐渐溶解思考:能否用澄清石灰水鉴别SO2 和 CO2,若不行,如何用化学方法鉴别? 实 验
向集满SO2的小试管中迅速滴加1-2滴品红,密封,充分振荡,观察颜色变化;再加热,观察颜色变化。可使品红溶液褪色,加热又恢复红色 SO2+品红→ 无色物质 → SO2+品红△①强氧化性:HClO、Na2O2、 H2O2②与有色物质结合:SO2③吸附性:焦炭现象:原理:课题:根据化合价和氧化还原性之间的关系,再推测CO2和SO2性质上还有何差异?[结论]:碳+4价为最高价态,硫+4价为中间价态,
所以SO2既有氧化性,又有还原性。 实 验
向一支试管中加入5ml SO2水溶液,滴加BaCl2溶液,再滴加0.5ml3%的H2O2溶液,振荡放置片刻后滴加稀盐酸观察实验现象。滴加BaCl2没有明显现象
滴加H2O2有白色沉淀生成
加盐酸后白色沉淀不消失现象 不同。前者缘于SO2的还原性,发生的是氧化还原反应。后者缘于其漂白性,发生的是非氧化还原反应.思考:SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗? 思考:二氧化硫和氯气都能用来漂白,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将 [ ]
A 、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、可能失去漂白性D1.为什么人们谈论酸雨时常常将其与二氧化硫联系在—起?
2.空气中的二氧化硫主要有哪些来源?
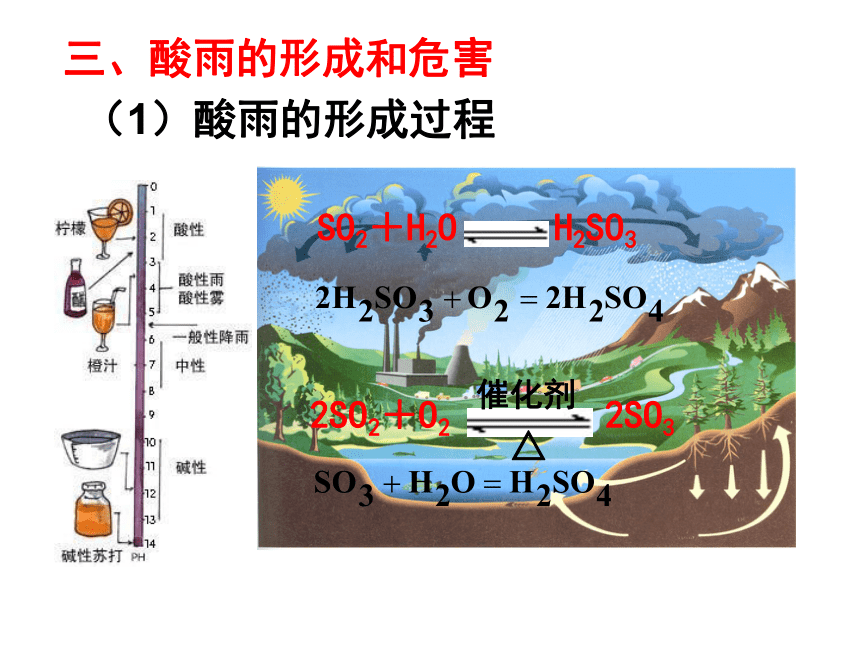
三、酸雨的形成和危害(1)酸雨的形成过程SO2+H2O H2SO3(2)酸雨的危害①影响水生物的繁殖;②使土壤肥力下降,逐渐酸化;③加快了桥梁、雕塑等建筑物的腐蚀速度。(3)酸雨的防治①研究开发能代替化石燃料的新能源;②对含硫燃料进行预先脱硫处理;③对释放的二氧化硫进行处理或回收利用;氢能、太阳能、核能。④提高全民的环保意识,加强国际合作。第一单元 含硫化合物的性质和应用硫酸的制备和性质H2SO4S一、硫酸的工业制法 三种原料:硫或含硫矿石 空气 98.3%的浓硫酸 三种设备:沸腾炉、接触室、吸收塔(1)或(3)SO3+ H2O=== H2SO4二、硫酸的性质稀硫酸——酸的通性H2SO4==2H++SO42-(1)使指示剂变色:石蕊变红,酚酞不变色
(2)与氢前金属反应生成氢气:
Zn+2H+=Zn2++H2 ↑
(3)与碱性氧化物反应:CuO+2H+=Cu2++H2O
(4)与碱反应:Fe(OH)3+3H+=Fe3++3H2O
(5)与盐反应:CO32-+2H+=H2O+CO2 ↑浓硫酸活动:观察浓硫酸,归纳物理性质(一)物理性质无色油状液体,难挥发,易溶于水,与水以任意比混合,溶于水时放出大量的热常见浓硫酸质量分数为98.3%,密度1.84g/cm3,浓度为18.4mol/L(二) 浓硫酸的特性1、吸水性思考为什么浓硫酸可作干燥剂?-----可用作干燥剂CuSO4?5H2O + H2SO4(浓)== CuSO4 + H2SO4 ?5H2O H2SO4(浓) + nH2O == H2SO4 ?nH2O 实验P91实验1用途:干燥O2 、 H2 、 Cl 2 、CO2 等酸性和中性气体,但不能干燥 NH3思考:吸水性与脱水性有什么区别?2、脱水性-----强腐蚀性实验P91实验2实验现象:蔗糖变黑;体积膨胀;放出大量热;产生使品红褪色的气体。 思考讨论蔗糖脱水实验中,能使品红褪色的气体是什么?如何产生?此现象又说明了什么?3、强氧化性 (1)与非金属反应 CO2 ↑ +2SO2 ↑+2H2O?1、用双线桥法分析上述反应,指出氧化剂、还原剂。?2、设计实验证明产物的成分?应用比较:写出Mg与稀硫酸、浓硫酸反应的化学方程式
CuSO4+SO2↑+ 2H2O(表现氧化性)(表现酸性)(2)与绝大多数金属反应 实验演示CuO+H2SO4==CuSO4+H2OMg+2H2SO4 (浓)==MgSO4+SO2↑+ 2H2OMg + H2SO4 ==MgSO4+ H2↑(除了Pt、Au)稀H2SO4-----强氧化性-----由S(+6)体现稀H2SO4-----弱氧化性-----由H+体现P92实验3事实讨论工业上通常用铁或铝制的容器来储存和运输浓硫酸,为什么?常温下,生成一层致密的氧化膜,H2SO4难以再跟内部的金属继续反应。我们把这种现象叫做钝化。钝化:冷、浓硫酸与Fe、Al反应硫酸:强酸性— 酸的通性吸水性— 干燥剂
脱水性— 炭化与还原性化合物反应巩固复习强氧化性与绝大数金属反应(冷浓硫酸与Fe、Al钝化)与非金属反应H2S+3H2SO4(浓)===
2KI+2H2SO4(浓)===4SO2 ↑ +3H2OI2+SO2 ↑ +K2SO4+2H2O浓、稀硫酸的比较思考:如何区别浓硫酸和稀硫酸??用天平同体积两溶液 ?用CuSO4?5H2O
?用纸 ?用蔗糖 ?用Cu加热 ?常温用铁
?用炭加热......◎硫酸在下列用途或反应中各表现的性质是:
A.酸性 B.吸水性C.脱水性D.强氧化性
(1)实验室制取氢气;
(2)可用作H2、SO2、Cl2等气体的干燥剂;
(3)铝制容器可盛放浓硫酸;
(4)浓硫酸能使湿润的蓝色石蕊试纸变红,后来又变黑;
(5)浓硫酸与金属铜加热反应;
(6)将浓H2S04加到浓盐酸中产生白雾。问题解决用废铜屑与硫酸反应制CuSO4,以下两种方法哪个好?为什么? (1)Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑ (2)2Cu+O2=2CuO CuO+H2SO4=CuSO4+H2O
向50mL18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量( ) A、等于0.9mol B、大于0.45mol 小于0.9mol C、等于0.45mol ?? D、小于0.45mol问题解决硫酸盐第一单元 含硫化合物的性质和应用硫和含硫化合物的相互转化常见的含硫矿物硫磺 (S)黄铁矿(FeS2)石膏(CaSO4·2H2O)重晶石(BaSO4)芒硝(Na2SO4·10H2O)-2 0 +4 +6强还原性既有氧化性又有还原性只有氧化性H2S
Na2S
HgSSSO2
H2SO3
Na2SO3SO3
H2SO4
Na2SO4硫元素常见化合价及相应化合物的性质SFeSNa2SO4H2SO4SO3Na2SO3H2SO3SO2HgSH2S-2 0 +4 +6 含硫化合物的相互转化BaSO4硫单质(3)化学性质(2)物理性质:黄色固体,硬而脆,不溶于水,
微溶于酒精,易溶于二硫化碳,密度比水大(1)存在:火山喷口附近①与金属反应 :②与氢气反应 :③与氧气反应 :硫化氢(1)物理性质: 无色,有臭鸡蛋气味的气体,
有剧毒,常温下溶解度为2.6 。(2)化学性质:①可燃性 :②还原性 :(3)制取:③酸性 :H2S + 2NaOH== Na2S+2H2O1、下列转化需要加入氧化剂才能实现的是( )
A.H2S SO2 B. H2SO4 SO2
C.SO42- BaSO4 D. SO32- SO2
2、既有氧化性又有还原性的酸是( )
A. 碳酸 B. 亚硫酸
C. 硫酸 D. 高氯酸课堂练习AB3、已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. H2O2 D. Cl2
C问题解决:一铁罐车运载浓硫酸发生事故。思考:
1、铁可与硫酸反应,为何可将浓硫酸密闭在铁罐中?在此铁罐出口处腐蚀严重,这说明了浓硫酸具有什么性质?
2、清洗此铁罐时一定要远离火源,为什么呢?
3、道路被破坏,树木被烧死的原因是什么呢?
4、如何处理被泄露的硫酸呢?
向集满SO2的小试管中迅速滴加1-2滴品红,密封,充分振荡,观察颜色变化;再加热,观察颜色变化。可使品红溶液褪色,加热又恢复红色 SO2+品红→ 无色物质 → SO2+品红△①强氧化性:HClO、Na2O2、 H2O2②与有色物质结合:SO2③吸附性:焦炭现象:原理:课题:根据化合价和氧化还原性之间的关系,再推测CO2和SO2性质上还有何差异?[结论]:碳+4价为最高价态,硫+4价为中间价态,
所以SO2既有氧化性,又有还原性。 实 验
向一支试管中加入5ml SO2水溶液,滴加BaCl2溶液,再滴加0.5ml3%的H2O2溶液,振荡放置片刻后滴加稀盐酸观察实验现象。滴加BaCl2没有明显现象
滴加H2O2有白色沉淀生成
加盐酸后白色沉淀不消失现象 不同。前者缘于SO2的还原性,发生的是氧化还原反应。后者缘于其漂白性,发生的是非氧化还原反应.思考:SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗? 思考:二氧化硫和氯气都能用来漂白,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将 [ ]
A 、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、可能失去漂白性D1.为什么人们谈论酸雨时常常将其与二氧化硫联系在—起?
2.空气中的二氧化硫主要有哪些来源?
三、酸雨的形成和危害(1)酸雨的形成过程SO2+H2O H2SO3(2)酸雨的危害①影响水生物的繁殖;②使土壤肥力下降,逐渐酸化;③加快了桥梁、雕塑等建筑物的腐蚀速度。(3)酸雨的防治①研究开发能代替化石燃料的新能源;②对含硫燃料进行预先脱硫处理;③对释放的二氧化硫进行处理或回收利用;氢能、太阳能、核能。④提高全民的环保意识,加强国际合作。第一单元 含硫化合物的性质和应用硫酸的制备和性质H2SO4S一、硫酸的工业制法 三种原料:硫或含硫矿石 空气 98.3%的浓硫酸 三种设备:沸腾炉、接触室、吸收塔(1)或(3)SO3+ H2O=== H2SO4二、硫酸的性质稀硫酸——酸的通性H2SO4==2H++SO42-(1)使指示剂变色:石蕊变红,酚酞不变色
(2)与氢前金属反应生成氢气:
Zn+2H+=Zn2++H2 ↑
(3)与碱性氧化物反应:CuO+2H+=Cu2++H2O
(4)与碱反应:Fe(OH)3+3H+=Fe3++3H2O
(5)与盐反应:CO32-+2H+=H2O+CO2 ↑浓硫酸活动:观察浓硫酸,归纳物理性质(一)物理性质无色油状液体,难挥发,易溶于水,与水以任意比混合,溶于水时放出大量的热常见浓硫酸质量分数为98.3%,密度1.84g/cm3,浓度为18.4mol/L(二) 浓硫酸的特性1、吸水性思考为什么浓硫酸可作干燥剂?-----可用作干燥剂CuSO4?5H2O + H2SO4(浓)== CuSO4 + H2SO4 ?5H2O H2SO4(浓) + nH2O == H2SO4 ?nH2O 实验P91实验1用途:干燥O2 、 H2 、 Cl 2 、CO2 等酸性和中性气体,但不能干燥 NH3思考:吸水性与脱水性有什么区别?2、脱水性-----强腐蚀性实验P91实验2实验现象:蔗糖变黑;体积膨胀;放出大量热;产生使品红褪色的气体。 思考讨论蔗糖脱水实验中,能使品红褪色的气体是什么?如何产生?此现象又说明了什么?3、强氧化性 (1)与非金属反应 CO2 ↑ +2SO2 ↑+2H2O?1、用双线桥法分析上述反应,指出氧化剂、还原剂。?2、设计实验证明产物的成分?应用比较:写出Mg与稀硫酸、浓硫酸反应的化学方程式
CuSO4+SO2↑+ 2H2O(表现氧化性)(表现酸性)(2)与绝大多数金属反应 实验演示CuO+H2SO4==CuSO4+H2OMg+2H2SO4 (浓)==MgSO4+SO2↑+ 2H2OMg + H2SO4 ==MgSO4+ H2↑(除了Pt、Au)稀H2SO4-----强氧化性-----由S(+6)体现稀H2SO4-----弱氧化性-----由H+体现P92实验3事实讨论工业上通常用铁或铝制的容器来储存和运输浓硫酸,为什么?常温下,生成一层致密的氧化膜,H2SO4难以再跟内部的金属继续反应。我们把这种现象叫做钝化。钝化:冷、浓硫酸与Fe、Al反应硫酸:强酸性— 酸的通性吸水性— 干燥剂
脱水性— 炭化与还原性化合物反应巩固复习强氧化性与绝大数金属反应(冷浓硫酸与Fe、Al钝化)与非金属反应H2S+3H2SO4(浓)===
2KI+2H2SO4(浓)===4SO2 ↑ +3H2OI2+SO2 ↑ +K2SO4+2H2O浓、稀硫酸的比较思考:如何区别浓硫酸和稀硫酸??用天平同体积两溶液 ?用CuSO4?5H2O
?用纸 ?用蔗糖 ?用Cu加热 ?常温用铁
?用炭加热......◎硫酸在下列用途或反应中各表现的性质是:
A.酸性 B.吸水性C.脱水性D.强氧化性
(1)实验室制取氢气;
(2)可用作H2、SO2、Cl2等气体的干燥剂;
(3)铝制容器可盛放浓硫酸;
(4)浓硫酸能使湿润的蓝色石蕊试纸变红,后来又变黑;
(5)浓硫酸与金属铜加热反应;
(6)将浓H2S04加到浓盐酸中产生白雾。问题解决用废铜屑与硫酸反应制CuSO4,以下两种方法哪个好?为什么? (1)Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑ (2)2Cu+O2=2CuO CuO+H2SO4=CuSO4+H2O
向50mL18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量( ) A、等于0.9mol B、大于0.45mol 小于0.9mol C、等于0.45mol ?? D、小于0.45mol问题解决硫酸盐第一单元 含硫化合物的性质和应用硫和含硫化合物的相互转化常见的含硫矿物硫磺 (S)黄铁矿(FeS2)石膏(CaSO4·2H2O)重晶石(BaSO4)芒硝(Na2SO4·10H2O)-2 0 +4 +6强还原性既有氧化性又有还原性只有氧化性H2S
Na2S
HgSSSO2
H2SO3
Na2SO3SO3
H2SO4
Na2SO4硫元素常见化合价及相应化合物的性质SFeSNa2SO4H2SO4SO3Na2SO3H2SO3SO2HgSH2S-2 0 +4 +6 含硫化合物的相互转化BaSO4硫单质(3)化学性质(2)物理性质:黄色固体,硬而脆,不溶于水,
微溶于酒精,易溶于二硫化碳,密度比水大(1)存在:火山喷口附近①与金属反应 :②与氢气反应 :③与氧气反应 :硫化氢(1)物理性质: 无色,有臭鸡蛋气味的气体,
有剧毒,常温下溶解度为2.6 。(2)化学性质:①可燃性 :②还原性 :(3)制取:③酸性 :H2S + 2NaOH== Na2S+2H2O1、下列转化需要加入氧化剂才能实现的是( )
A.H2S SO2 B. H2SO4 SO2
C.SO42- BaSO4 D. SO32- SO2
2、既有氧化性又有还原性的酸是( )
A. 碳酸 B. 亚硫酸
C. 硫酸 D. 高氯酸课堂练习AB3、已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. H2O2 D. Cl2
C问题解决:一铁罐车运载浓硫酸发生事故。思考:
1、铁可与硫酸反应,为何可将浓硫酸密闭在铁罐中?在此铁罐出口处腐蚀严重,这说明了浓硫酸具有什么性质?
2、清洗此铁罐时一定要远离火源,为什么呢?
3、道路被破坏,树木被烧死的原因是什么呢?
4、如何处理被泄露的硫酸呢?
