第一节化学反应能量变化(黑龙江省鹤岗市萝北县)
文档属性
| 名称 | 第一节化学反应能量变化(黑龙江省鹤岗市萝北县) |  | |
| 格式 | rar | ||
| 文件大小 | 202.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-09-05 09:47:00 | ||
图片预览





文档简介
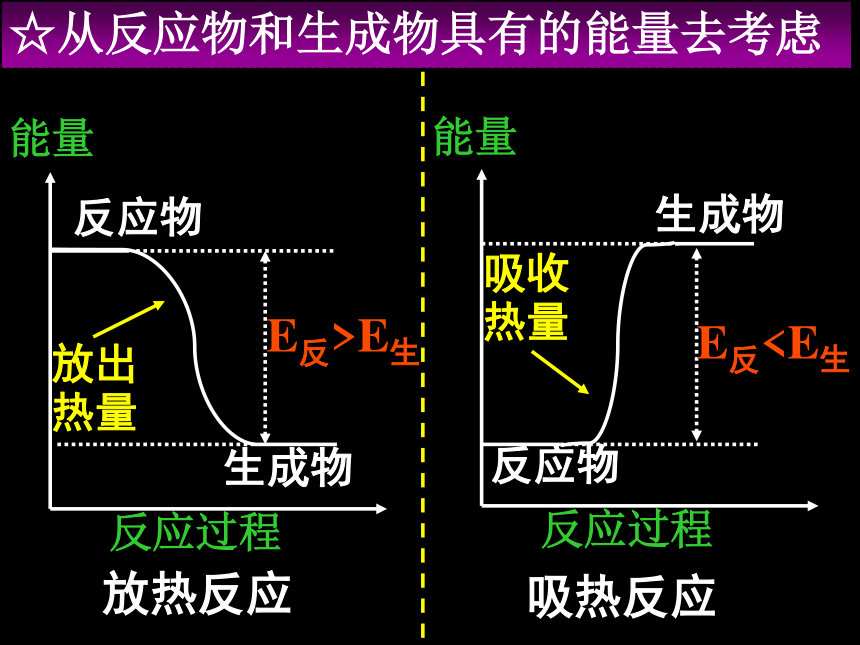
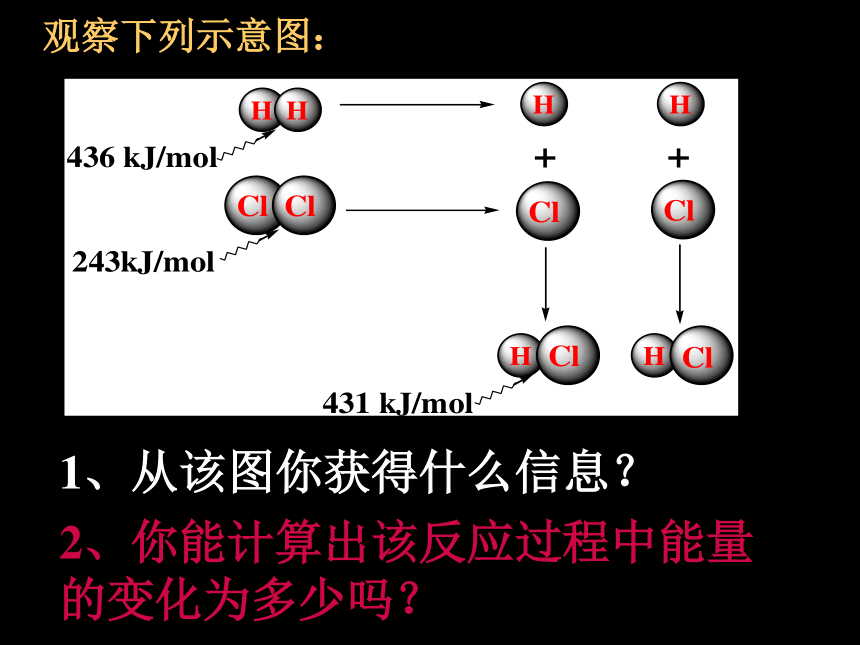
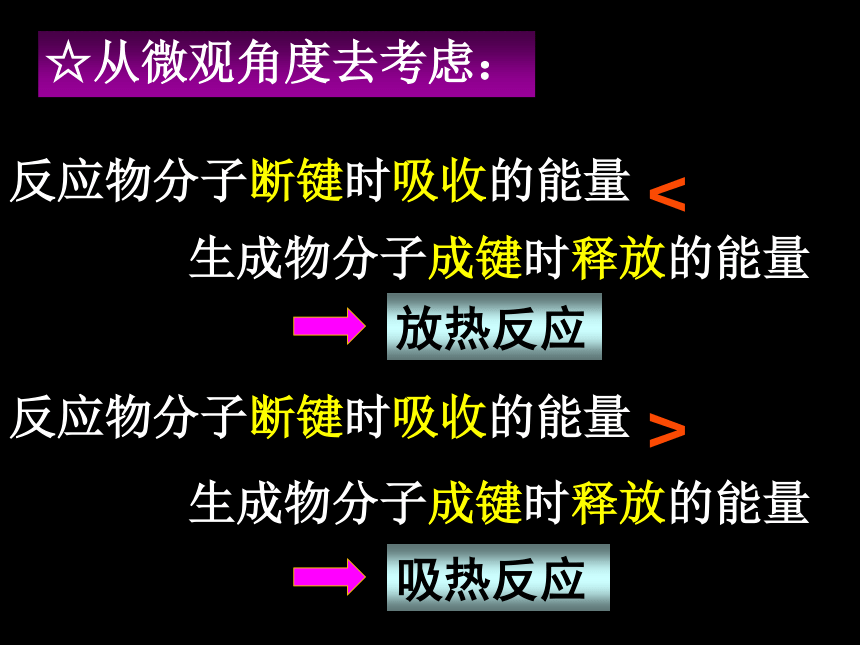
课件20张PPT。第一章 化学反应与能量第一节 化学反应与能量的变化[课题一] 化学反应为什么伴随着能量的变化?☆从反应物和生成物具有的能量去考虑放热反应吸热反应能量反应过程反应物生成物放出热量能量反应过程反应物生成物吸收热量E反>E生E反生成物分子成键时释放的能量思考体系的能量如何变化?升高还是降低?
环境的能量如何变化?升高还是降低?
规定放热反应的ΔH 为“-”,是站在谁的角度?体系还是环境?放热反应中环境+-反应:
C(石墨) C(金刚石)是吸热反应,由此可知( ) A. 石墨比金刚石更稳定 B. 该反应的ΔH > 0 C. 金刚石比石墨稳定 D. 金刚石和石墨不能相互转化AB[课题二] 如何在化学方程式中正确反映其热量变化?思考
交流与化学方程式相比,热化学方程式有哪些不同?
H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ/mol
H2(g)十1/2O2 (g)=H2O(l) △H=-285.8kJ/mol例:
例:
H2(g)+Cl2(g) = 2HCl(g) △H=-184.6 kJ/mol
1/2H2(g)+ 1/2Cl2(g) = HCl(g) △H=-92.3 kJ/mol★书写热化学方程式的注意事项②物质后需标聚集状态(s、l、g、aq)③在方程式后写下ΔH的数值和单位,方程式与ΔH用空格隔开。
④化学计量数单位是“mol”,而不是 “个”。①需注明反应的温度和压强如不注明条件,即指: 25℃ 1.01×105Pa;⑤ΔH的值必须与方程式的化学计量数对应。计量数加倍时, ΔH也要加倍。当反应逆向进行时, 其ΔH与正反应的数值相等,符号相反。
⑥热化学方程式一般不写反应条件;不标明生成沉淀或气体符号。
练习:
1、请解读下面的热化学方程式:C(s)+O2(g) = CO2(g) △H=-393.5 kJ/mol
C(s)+H2O(g) = CO(g)+H2(g) △H =+131.5 kJ/mol2、 0.3mol的气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为_________________________. △H=-2165kJ/mol 3、
S(g)+O2(g)=SO2 (g) ΔH1 = -a kJ/mol
S(s)+O2(g)=SO2 (g) ΔH2 = -bkJ/mol
则a b ΔH1ΔH2>< H2 + F2 = 2HF H2 + Cl2 = 2HCl
预测当生成2 mol HF和2 mol HCl时,哪个
反应放出的热量多?
说说你的理由? 如何验证你的预测?
环境的能量如何变化?升高还是降低?
规定放热反应的ΔH 为“-”,是站在谁的角度?体系还是环境?放热反应中环境+-反应:
C(石墨) C(金刚石)是吸热反应,由此可知( ) A. 石墨比金刚石更稳定 B. 该反应的ΔH > 0 C. 金刚石比石墨稳定 D. 金刚石和石墨不能相互转化AB[课题二] 如何在化学方程式中正确反映其热量变化?思考
交流与化学方程式相比,热化学方程式有哪些不同?
H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ/mol
H2(g)十1/2O2 (g)=H2O(l) △H=-285.8kJ/mol例:
例:
H2(g)+Cl2(g) = 2HCl(g) △H=-184.6 kJ/mol
1/2H2(g)+ 1/2Cl2(g) = HCl(g) △H=-92.3 kJ/mol★书写热化学方程式的注意事项②物质后需标聚集状态(s、l、g、aq)③在方程式后写下ΔH的数值和单位,方程式与ΔH用空格隔开。
④化学计量数单位是“mol”,而不是 “个”。①需注明反应的温度和压强如不注明条件,即指: 25℃ 1.01×105Pa;⑤ΔH的值必须与方程式的化学计量数对应。计量数加倍时, ΔH也要加倍。当反应逆向进行时, 其ΔH与正反应的数值相等,符号相反。
⑥热化学方程式一般不写反应条件;不标明生成沉淀或气体符号。
练习:
1、请解读下面的热化学方程式:C(s)+O2(g) = CO2(g) △H=-393.5 kJ/mol
C(s)+H2O(g) = CO(g)+H2(g) △H =+131.5 kJ/mol2、 0.3mol的气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为_________________________. △H=-2165kJ/mol 3、
S(g)+O2(g)=SO2 (g) ΔH1 = -a kJ/mol
S(s)+O2(g)=SO2 (g) ΔH2 = -bkJ/mol
则a b ΔH1ΔH2>< H2 + F2 = 2HF H2 + Cl2 = 2HCl
预测当生成2 mol HF和2 mol HCl时,哪个
反应放出的热量多?
说说你的理由? 如何验证你的预测?
