第三节化学反应热的计算(黑龙江省鹤岗市萝北县)
文档属性
| 名称 | 第三节化学反应热的计算(黑龙江省鹤岗市萝北县) |  | |
| 格式 | rar | ||
| 文件大小 | 387.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-09-05 09:59:00 | ||
图片预览







文档简介
课件25张PPT。第三节
化学反应热的计算下列数据表示H2的燃烧热吗? H2(g)+1/2O2(g)=H2O (g)△H1=-241.8kJ/mol H2(g)+1/2O2(g)=H2O (l)
△H=△H1+ △H2=-285.8kJ/mol判断 小组讨论任务这个反应的反应热能测出来吗?为什么?
(1)C(s)+1/2O2(g)==CO(g) ΔH1=?
① C(s)+1/2O2(g)==CO(g) △H1=?② CO(g)+1/2O2(g)=CO2(g)△H2=-283.0 kJ/mol③ C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol+)① + ② = ③ 则 ΔH1 + ΔH2 =ΔH3
ΔH1 =ΔH3- ΔH2 = -393.5kJ/mol+ 283.0kJ/mol= -110.5kJ/mol 不管化学反应是分一步完成或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的
途径无关。盖斯定律1802年8月8日生于瑞士日内瓦市一位画家家庭
1825年毕业于多尔帕特大学医学系,并取得医学博士学位。1826年弃医专攻化学
1828年由于在化学上的卓越贡献被选为圣彼得堡科学院院士
1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的热量。Gormain Henri Hess 1836年经过许多次实验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。
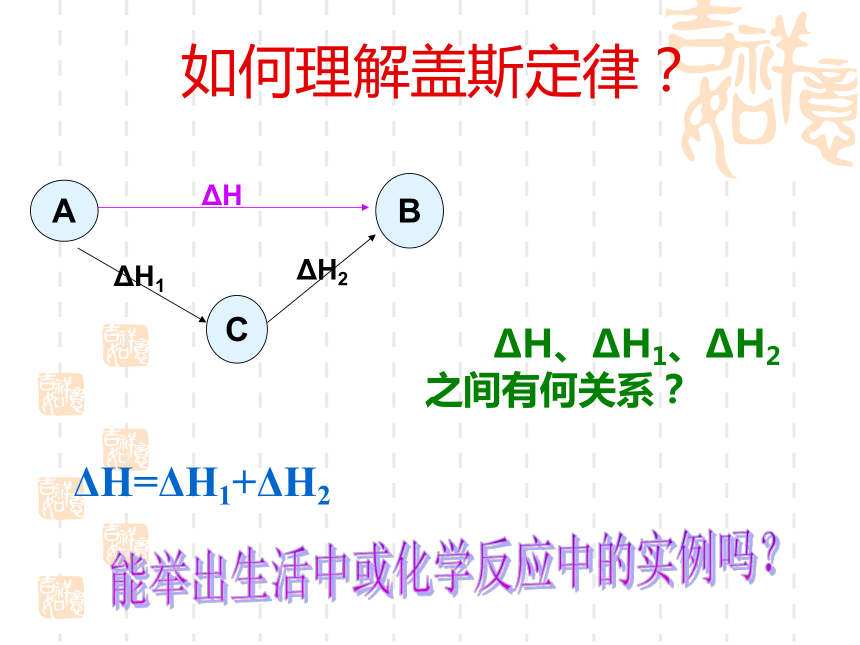
盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。 如何理解盖斯定律? ΔH、ΔH1、ΔH2
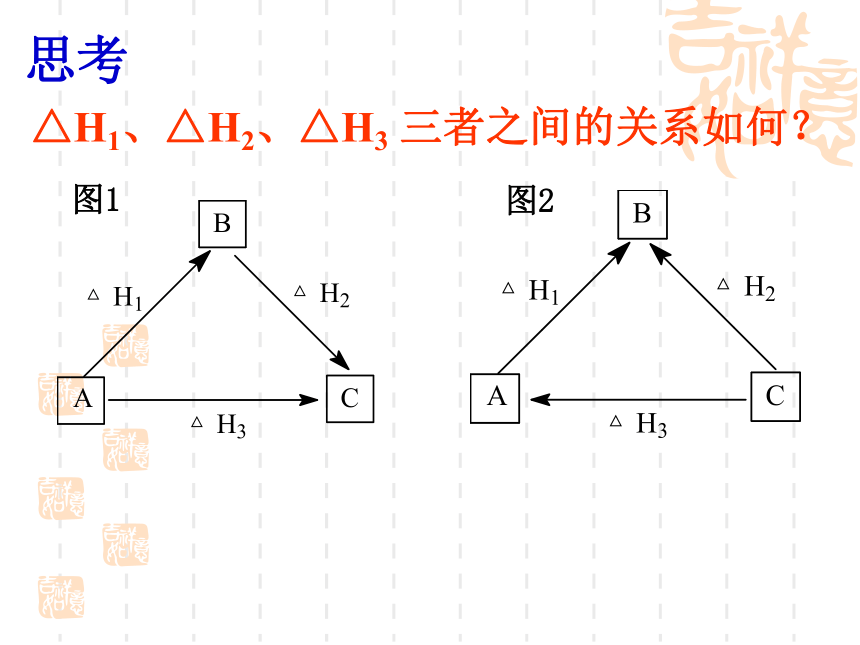
之间有何关系?ΔH=ΔH1+ΔH2BΔH能举出生活中或化学反应中的实例吗?△H1、△H2、△H3 三者之间的关系如何? 思考 图1图2ACA→B→CA→C△H1+△H2=△H3在具体实例中要注意图1图2CBC→A→BC→B△H3+△H1=△H2例一 25℃,101kPa时,使1.0g钠与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,求生成1mol氯化钠的反应热 解:
设生成1molNaCl放出的热量为x千焦
钠与氯气起反应的化学方程式如下:
Na(s)+1/2Cl2 (g)== NaCl(s
Na的摩尔质量为23g/mol,所以
1.0g : 23g = 17.87kJ : xkJ
X=411kJ
由钠与氯气反应生成氯化钠为放热反应
所以:由钠与氯气反应生成氯化钠的反应热为-411kJ/mol
解:钠与氯气起反应的化学方程式如下:
Na(s)+1/2Cl2 (g)== NaCl(s)
设生成1molNaCl的反应热为x
Na的摩尔质量为23g/mol,所以
1.0g : -17.87kJ = 23g /mol : x
X=-411kJ/mol
答:由钠与氯气反应生成氯化钠的反应热为-411kJ/mol
教材:例2:乙醇的燃烧热△H=-1366.8kj/mol,在250C、101kpa时,1kg乙醇充分燃烧放出多少热量?例2:
解:1 kgC2H5OH的物质的量:n=m/M
1000g/46g/mol=21.74mol
1 kgC2H5OH燃烧后放出热量:
1366.8kJ/mol*21.74mol=2.9*104kJ
答:1 kgC2H5OH燃烧后放出 2.9*104kJ热量例三:已知下列反应的反应热
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) △H1=-870.3kj/mol
(2)C(s)+O2(g)==CO2(g) △H2=-393.5kj/mol
(3)H2(g)+1/2O2(g)==H2O(l) △H3=-285.8kj/mol
试计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)==CH3COOH(l)【解】分析各方程式的关系,知
将方程式按2[⑵ + ⑶] - ⑴组合得上述反应方程式
即:△H = 2[△H 2 + △H3] - △H1
△H =2[(-393.5kJ/mol) + (-285.8kJ/mol)]
-(-870.3kJ/mol)
= - 488.3kJ/mol
答:反应2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l)
反应热为- 488.3kJ/mol
例4:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)
说明:(1)可以在书中P7查找需要的数据
(2)并告诉大家你设计的理由。用一用盖斯定律石墨能直接变成金刚石吗?查燃烧热表知:
①C(石墨,s)+O2(g)==CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)==CO2(g) △H2=-395.0kJ/mol
所以, ①- ②得:
C(石墨,s)= C(金刚石,s) △H=+1.5kJ/mol 观察该热化学方程式,回答:金刚石能自动变成石墨吗?需要什么条件?盖斯定律 1、请用自己的话描述一下盖斯定律。
2、盖斯定律有哪些用途?总结归纳若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和。
用来计算难于测量或不能测量的反应的反应热.你知道神六的火箭燃料是什么吗?练习1:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol 2 、已知下列热化学方程式:
① △H=-285.8kJ/mol
② △H=-241.8kJ/mol
③ △H=-110.5kJ/mol
④ △H=-393.5kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是__________。
(2) H2的燃烧热为______;C的燃烧热为______
(3)燃烧10g H2生成液体水,放出的热量为____________.
(4)CO的燃烧热为________;其热化学方程式为____________________________.3、已知下列热化学方程式:
①
△H=-25kJ/mol
②
△H=-47kJ/mol
③
△H=+19kJ/mol
写出FeO(s)与CO反应生成Fe(s)和 的热化学方程式.△H=-11kJ/mol 4、在100 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s) +1/2O2(g) = CO(g); = -110.35 kJ/mol
CO(g) + 1/2O2(g) = CO2(g); = -282.57 kJ/mol
与这些碳完全燃烧相比,损失的热量是( )。
392.92 kJ B. 2489.44 kJ
C. 784.92 kJ D. 3274.3 kJC科学探索
△H=△H1+ △H2=-285.8kJ/mol判断 小组讨论任务这个反应的反应热能测出来吗?为什么?
(1)C(s)+1/2O2(g)==CO(g) ΔH1=?
① C(s)+1/2O2(g)==CO(g) △H1=?② CO(g)+1/2O2(g)=CO2(g)△H2=-283.0 kJ/mol③ C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol+)① + ② = ③ 则 ΔH1 + ΔH2 =ΔH3
ΔH1 =ΔH3- ΔH2 = -393.5kJ/mol+ 283.0kJ/mol= -110.5kJ/mol 不管化学反应是分一步完成或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的
途径无关。盖斯定律1802年8月8日生于瑞士日内瓦市一位画家家庭
1825年毕业于多尔帕特大学医学系,并取得医学博士学位。1826年弃医专攻化学
1828年由于在化学上的卓越贡献被选为圣彼得堡科学院院士
1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的热量。Gormain Henri Hess 1836年经过许多次实验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。
盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。 如何理解盖斯定律? ΔH、ΔH1、ΔH2
之间有何关系?ΔH=ΔH1+ΔH2BΔH能举出生活中或化学反应中的实例吗?△H1、△H2、△H3 三者之间的关系如何? 思考 图1图2ACA→B→CA→C△H1+△H2=△H3在具体实例中要注意图1图2CBC→A→BC→B△H3+△H1=△H2例一 25℃,101kPa时,使1.0g钠与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,求生成1mol氯化钠的反应热 解:
设生成1molNaCl放出的热量为x千焦
钠与氯气起反应的化学方程式如下:
Na(s)+1/2Cl2 (g)== NaCl(s
Na的摩尔质量为23g/mol,所以
1.0g : 23g = 17.87kJ : xkJ
X=411kJ
由钠与氯气反应生成氯化钠为放热反应
所以:由钠与氯气反应生成氯化钠的反应热为-411kJ/mol
解:钠与氯气起反应的化学方程式如下:
Na(s)+1/2Cl2 (g)== NaCl(s)
设生成1molNaCl的反应热为x
Na的摩尔质量为23g/mol,所以
1.0g : -17.87kJ = 23g /mol : x
X=-411kJ/mol
答:由钠与氯气反应生成氯化钠的反应热为-411kJ/mol
教材:例2:乙醇的燃烧热△H=-1366.8kj/mol,在250C、101kpa时,1kg乙醇充分燃烧放出多少热量?例2:
解:1 kgC2H5OH的物质的量:n=m/M
1000g/46g/mol=21.74mol
1 kgC2H5OH燃烧后放出热量:
1366.8kJ/mol*21.74mol=2.9*104kJ
答:1 kgC2H5OH燃烧后放出 2.9*104kJ热量例三:已知下列反应的反应热
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) △H1=-870.3kj/mol
(2)C(s)+O2(g)==CO2(g) △H2=-393.5kj/mol
(3)H2(g)+1/2O2(g)==H2O(l) △H3=-285.8kj/mol
试计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)==CH3COOH(l)【解】分析各方程式的关系,知
将方程式按2[⑵ + ⑶] - ⑴组合得上述反应方程式
即:△H = 2[△H 2 + △H3] - △H1
△H =2[(-393.5kJ/mol) + (-285.8kJ/mol)]
-(-870.3kJ/mol)
= - 488.3kJ/mol
答:反应2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l)
反应热为- 488.3kJ/mol
例4:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)
说明:(1)可以在书中P7查找需要的数据
(2)并告诉大家你设计的理由。用一用盖斯定律石墨能直接变成金刚石吗?查燃烧热表知:
①C(石墨,s)+O2(g)==CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)==CO2(g) △H2=-395.0kJ/mol
所以, ①- ②得:
C(石墨,s)= C(金刚石,s) △H=+1.5kJ/mol 观察该热化学方程式,回答:金刚石能自动变成石墨吗?需要什么条件?盖斯定律 1、请用自己的话描述一下盖斯定律。
2、盖斯定律有哪些用途?总结归纳若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和。
用来计算难于测量或不能测量的反应的反应热.你知道神六的火箭燃料是什么吗?练习1:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol 2 、已知下列热化学方程式:
① △H=-285.8kJ/mol
② △H=-241.8kJ/mol
③ △H=-110.5kJ/mol
④ △H=-393.5kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是__________。
(2) H2的燃烧热为______;C的燃烧热为______
(3)燃烧10g H2生成液体水,放出的热量为____________.
(4)CO的燃烧热为________;其热化学方程式为____________________________.3、已知下列热化学方程式:
①
△H=-25kJ/mol
②
△H=-47kJ/mol
③
△H=+19kJ/mol
写出FeO(s)与CO反应生成Fe(s)和 的热化学方程式.△H=-11kJ/mol 4、在100 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s) +1/2O2(g) = CO(g); = -110.35 kJ/mol
CO(g) + 1/2O2(g) = CO2(g); = -282.57 kJ/mol
与这些碳完全燃烧相比,损失的热量是( )。
392.92 kJ B. 2489.44 kJ
C. 784.92 kJ D. 3274.3 kJC科学探索
