摩尔质量(江西省吉安地区)
文档属性
| 名称 | 摩尔质量(江西省吉安地区) |  | |
| 格式 | rar | ||
| 文件大小 | 34.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-09-22 14:47:00 | ||
图片预览





文档简介
课件23张PPT。第一节 物质的量(第二课时)江西泰和 胡锋清物质的量(n)摩尔阿伏加德罗常数(NA):表示含有一定数目粒子的集合体:是物质的量的单位,符号为mol0.012 千克12C 所含的碳原子数
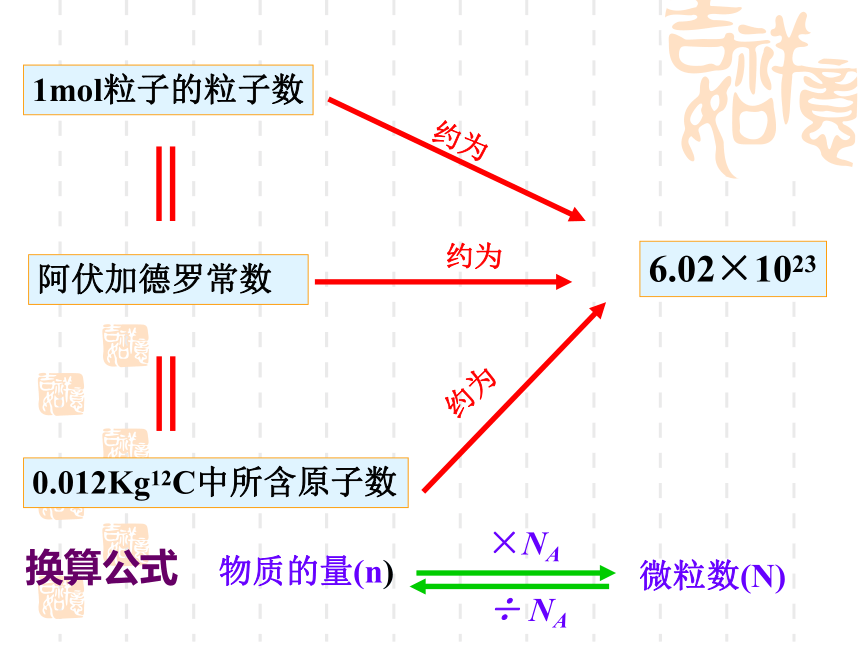
近似值:6.02 × 1023 mol-1复习: 1mol任何粒子的粒子数 物质的量是专门用于计量粒子数目的
物理量1mol粒子的粒子数0.012Kg12C中所含原子数阿伏加德罗常数6.02×1023约为约为约为换算公式下列关于阿伏加德罗常数的说法正确的是
( )
A、阿伏加德罗常数是12g碳中所含的碳原
子数
B、阿伏加德罗常数是0.012kg12C中所含的
原子数
C、阿伏加德罗常数是6.02×1023 mol-1
D、阿伏加德罗常数的符号为NA,近似值为
6.02×1023 mol-1复习题BD(1)在1mol CO分子中,
约含有 个CO分子,
约含有 个C原子,
约含有 个O原子,
约含有 个原子,
约含有 个质子,
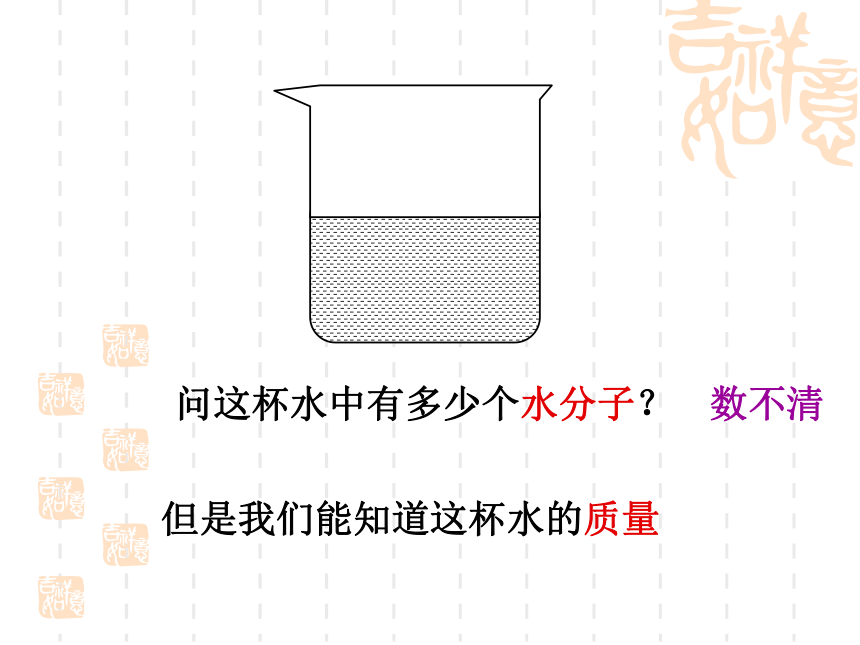
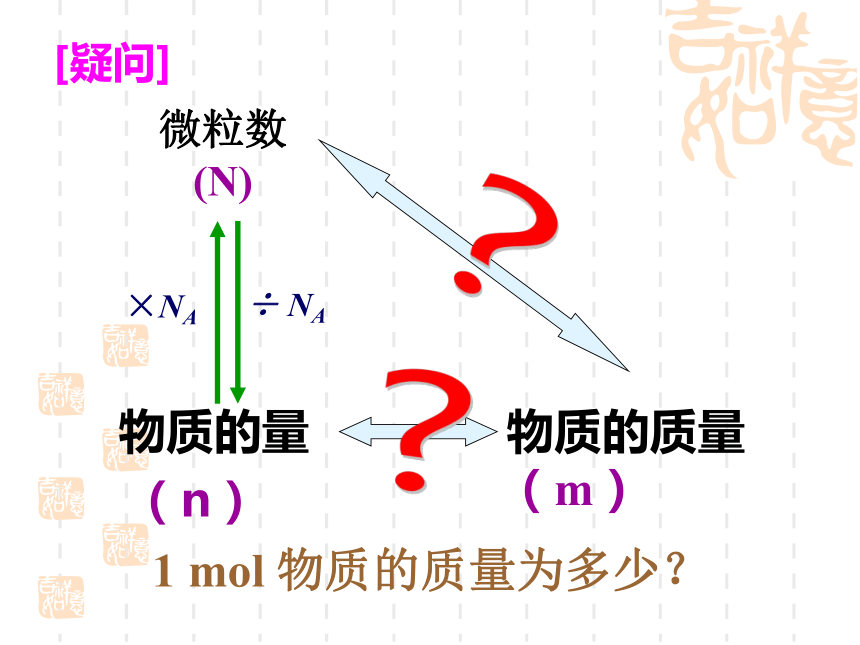
约含有 个电子,6.02×10236.02×10238.428×10241.204×10246.02×10238.428×1024复习题问这杯水中有多少个水分子?数不清但是我们能知道这杯水的质量[疑问] 物质的量
(n)?物质的质量(m)1 mol 物质的质量为多少?微粒数
(N) ×NA ÷ NA?假如一原子的质量为m1,12C原子的质量为mc其相对原子质量为A1,
则: A1=?
另一原子的质量为m2,其相对原子质量为A2
则:A2=?
问:A1/ A2=?
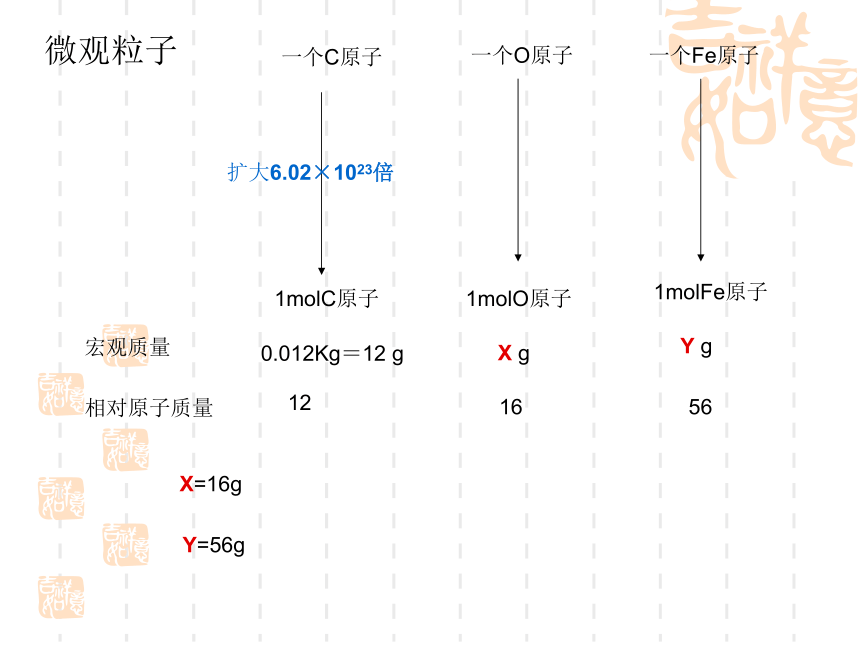
A1/ A2= m1/ m2也就是说原子的质量比=原子的相对原子质量比微观粒子一个C原子扩大6.02×1023倍1molC原子一个O原子一个Fe原子1molO原子1molFe原子宏观质量0.012Kg=12 g相对原子质量121656X gY gX=16gY=56g结论:1mol任何原子的质量在数值上都等于它们的相对原子质量那么1mol分子呢?分析:分子有原子构成,分子的相对分子质量等于它们的原子的相对原子质量的总和,1mol任何原子的质量在数值上等于它的相对原子质量,单位为克。则1 mol任何分子的质量就应该在数值上等于它的相对分子质量,单位为克 对于粒子中的离子有又将是怎样呢?对于离子来说,由于电子的质量很小,当原子得到或失去电子变成离子时,电子的质量可以忽略不计,因此,1mol离子的质量在数值上就等于该离子的式量,单位为克①1mol任何原子的质量以克为单位,在数值上等于这种原子的相对原子质量。 ②1mol任何分子的质量以克为单位,在数值上等于这种分子的相对分子质量。 ③1mol任何离子的质量以克为单位,在数值上等于这种离子的式量。(离子是通过原子失去或得到电子形成的,电子质量微小,可忽略不计) 结论64324435.52358.5课堂练习:分析归纳: 1mol粒子的质量以克为单位时在数值上都与该粒子式量相等1molH2O的质量_____18g36g54g 3molH2O的质量_____2molH2O的质量_____nmolH2O的质量____18ngH2O的摩尔质量为18g·mol-1想一想摩尔质量* 定义:单位物质的量的物质所具有的质量叫摩尔质量。 ** 单位:g/mol(或 g·mol-1)和 Kg/mol(或Kg·mol-1)*** 数值:等于粒子的式量。**** 表示方法:如,M(H2O)=18 g·mol-1符号为M物质的质量物质的量摩尔质量nmM =[例 1] 90克水的物质的量是多少?解: 水的相对分子质量是18,水的摩尔质量是 18g/mol 。n (H2O) = 90g18g/mol= 5 mol答:90克水的物质的量是5mol。相对原子质量
相对分子质量1mol物质的质量摩尔质量单位数值相
同1gg·mol-1区别练习:71gNa2SO4中含有Na+和SO42-的物质的量各是多少?n(Na2SO4)m(Na2SO4)M(Na2SO4)= ————= ————71g142g·mol-1=0.5mol则Na+的物质的量为1mol,SO42-的物质的量为0.5mol解:硫酸钠的相对分子质量为142,摩尔质量为142g·mol-1答:71gNa2SO4中含有Na+的物质的量为1mol,SO42-的物质的量为0.5mol回答 (1)100 mol H2O 质量是1800 g,含有6.02×1025个H2O分子。(2)0.1 mol OH-质量是1.7g,含6.02×1022个OH- 。物质的量的意义:是联系宏观和微观的纽带或桥梁。nmN?M?NA?NA?M小结摩尔质量定义:单位物质的量的物质所具有的质量 叫摩尔质量。 ** 单位:g/mol(或 g·mol-1)*** 数值:等于物质或粒子的式量。符号为M公式书上P47 第三大题的1(3)、4(1)、6上交。其余的做在书上。
步步高P72 1-19做好,明天校对。作业
近似值:6.02 × 1023 mol-1复习: 1mol任何粒子的粒子数 物质的量是专门用于计量粒子数目的
物理量1mol粒子的粒子数0.012Kg12C中所含原子数阿伏加德罗常数6.02×1023约为约为约为换算公式下列关于阿伏加德罗常数的说法正确的是
( )
A、阿伏加德罗常数是12g碳中所含的碳原
子数
B、阿伏加德罗常数是0.012kg12C中所含的
原子数
C、阿伏加德罗常数是6.02×1023 mol-1
D、阿伏加德罗常数的符号为NA,近似值为
6.02×1023 mol-1复习题BD(1)在1mol CO分子中,
约含有 个CO分子,
约含有 个C原子,
约含有 个O原子,
约含有 个原子,
约含有 个质子,
约含有 个电子,6.02×10236.02×10238.428×10241.204×10246.02×10238.428×1024复习题问这杯水中有多少个水分子?数不清但是我们能知道这杯水的质量[疑问] 物质的量
(n)?物质的质量(m)1 mol 物质的质量为多少?微粒数
(N) ×NA ÷ NA?假如一原子的质量为m1,12C原子的质量为mc其相对原子质量为A1,
则: A1=?
另一原子的质量为m2,其相对原子质量为A2
则:A2=?
问:A1/ A2=?
A1/ A2= m1/ m2也就是说原子的质量比=原子的相对原子质量比微观粒子一个C原子扩大6.02×1023倍1molC原子一个O原子一个Fe原子1molO原子1molFe原子宏观质量0.012Kg=12 g相对原子质量121656X gY gX=16gY=56g结论:1mol任何原子的质量在数值上都等于它们的相对原子质量那么1mol分子呢?分析:分子有原子构成,分子的相对分子质量等于它们的原子的相对原子质量的总和,1mol任何原子的质量在数值上等于它的相对原子质量,单位为克。则1 mol任何分子的质量就应该在数值上等于它的相对分子质量,单位为克 对于粒子中的离子有又将是怎样呢?对于离子来说,由于电子的质量很小,当原子得到或失去电子变成离子时,电子的质量可以忽略不计,因此,1mol离子的质量在数值上就等于该离子的式量,单位为克①1mol任何原子的质量以克为单位,在数值上等于这种原子的相对原子质量。 ②1mol任何分子的质量以克为单位,在数值上等于这种分子的相对分子质量。 ③1mol任何离子的质量以克为单位,在数值上等于这种离子的式量。(离子是通过原子失去或得到电子形成的,电子质量微小,可忽略不计) 结论64324435.52358.5课堂练习:分析归纳: 1mol粒子的质量以克为单位时在数值上都与该粒子式量相等1molH2O的质量_____18g36g54g 3molH2O的质量_____2molH2O的质量_____nmolH2O的质量____18ngH2O的摩尔质量为18g·mol-1想一想摩尔质量* 定义:单位物质的量的物质所具有的质量叫摩尔质量。 ** 单位:g/mol(或 g·mol-1)和 Kg/mol(或Kg·mol-1)*** 数值:等于粒子的式量。**** 表示方法:如,M(H2O)=18 g·mol-1符号为M物质的质量物质的量摩尔质量nmM =[例 1] 90克水的物质的量是多少?解: 水的相对分子质量是18,水的摩尔质量是 18g/mol 。n (H2O) = 90g18g/mol= 5 mol答:90克水的物质的量是5mol。相对原子质量
相对分子质量1mol物质的质量摩尔质量单位数值相
同1gg·mol-1区别练习:71gNa2SO4中含有Na+和SO42-的物质的量各是多少?n(Na2SO4)m(Na2SO4)M(Na2SO4)= ————= ————71g142g·mol-1=0.5mol则Na+的物质的量为1mol,SO42-的物质的量为0.5mol解:硫酸钠的相对分子质量为142,摩尔质量为142g·mol-1答:71gNa2SO4中含有Na+的物质的量为1mol,SO42-的物质的量为0.5mol回答 (1)100 mol H2O 质量是1800 g,含有6.02×1025个H2O分子。(2)0.1 mol OH-质量是1.7g,含6.02×1022个OH- 。物质的量的意义:是联系宏观和微观的纽带或桥梁。nmN?M?NA?NA?M小结摩尔质量定义:单位物质的量的物质所具有的质量 叫摩尔质量。 ** 单位:g/mol(或 g·mol-1)*** 数值:等于物质或粒子的式量。符号为M公式书上P47 第三大题的1(3)、4(1)、6上交。其余的做在书上。
步步高P72 1-19做好,明天校对。作业
