盐类的水解
图片预览





文档简介
课件17张PPT。欢迎指导
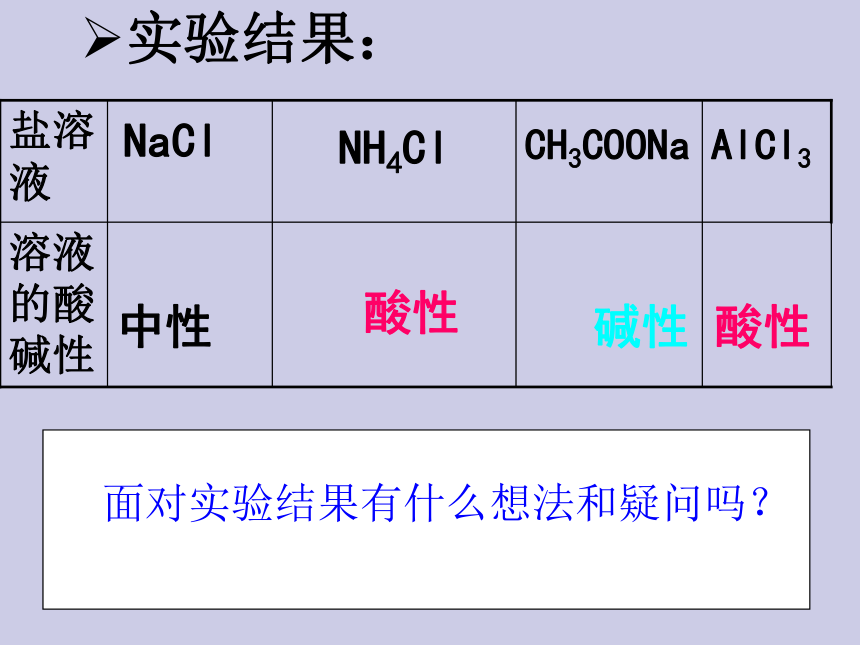
纯碱不是碱,是盐???返回 酸溶液呈酸性,碱溶液呈碱 性,那盐溶液呈什么性呢 ?一定呈中性吗?问题质疑[活动与探究 ]检验下列盐溶液的酸碱性.NaAcNH4ClNaCl返回AlCl3实验结果:碱性酸性中性溶液的酸碱性AlCl3CH3COONaNH4ClNaCl盐溶液酸性面对实验结果有什么想法和疑问吗?1)并非所有盐溶液都显中性,
为什么盐溶液有显酸性、有的显碱性、
有的显中性呢?
问题质疑
原理探讨以醋酸钠溶液为例,为什么醋酸钠溶液显碱性?
C( H+ ) C( OH- )有什么关系?醋酸钠和水发生反应破坏了水的电离平衡
(1)由实验结果可知,醋酸钠溶液呈碱性说
明溶液中的 C ( OH- )与C( H+ )有什
么关系?
(4)? 醋酸钠溶于水后会发生什么变化?对水的电离平衡会有什么样的影响?
醋酸钠在溶液中的变化:CH3COONa = CH3COO_ +Na+
H2O H+ + OH_
CH3COOH +CH3COONa + H2O CH3COOH+NaOHCH3COO- +H2O CH3COOH+OH_ 氯化铵在溶液中的变化:NH4Cl = NH4 + +Cl_
H2O OH_ + H+
NH3·H2O+NH4Cl + H2O NH3·H2O +H ClNH4 + + H2O NH3·H2O +H+
我们再来分析,氯化铵溶液呈酸性的 原因
盐类的水解:
在水溶液中盐电离产生的离子跟水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应
形式:盐+水 酸+碱 氯化钠在溶液中的变化:NaCl = Na + +Cl_
H2O OH_ + H+
我们已经知道盐类可以通过水解呈酸碱性,那为什么NaCl的水溶液是中性?有没发生水解呢?
氯化钠没发生水解水解的条件是什么?水解的实质是什么?形式:盐+水 酸+碱实质:使水的电离平衡移动盐类的水解:
在水溶液中盐电离产生的离子跟水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应水解的条件:生成弱电解质纯碱不是碱是盐??
Na2CO3Na+ + CO32-H2OOH- + H+
+HCO3- 注意:多元酸根的水解是分步进行的,其中第一
步水解的程度要远远大于第二步的水解程度。
下列物质在水溶液中不会发生水解的是
A (NH4)2SO4 B Na2 SO4
C Al3+2(SO4 )3 D Na F谢谢!
纯碱不是碱,是盐???返回 酸溶液呈酸性,碱溶液呈碱 性,那盐溶液呈什么性呢 ?一定呈中性吗?问题质疑[活动与探究 ]检验下列盐溶液的酸碱性.NaAcNH4ClNaCl返回AlCl3实验结果:碱性酸性中性溶液的酸碱性AlCl3CH3COONaNH4ClNaCl盐溶液酸性面对实验结果有什么想法和疑问吗?1)并非所有盐溶液都显中性,
为什么盐溶液有显酸性、有的显碱性、
有的显中性呢?
问题质疑
原理探讨以醋酸钠溶液为例,为什么醋酸钠溶液显碱性?
C( H+ )
(1)由实验结果可知,醋酸钠溶液呈碱性说
明溶液中的 C ( OH- )与C( H+ )有什
么关系?
(4)? 醋酸钠溶于水后会发生什么变化?对水的电离平衡会有什么样的影响?
醋酸钠在溶液中的变化:CH3COONa = CH3COO_ +Na+
H2O H+ + OH_
CH3COOH +CH3COONa + H2O CH3COOH+NaOHCH3COO- +H2O CH3COOH+OH_ 氯化铵在溶液中的变化:NH4Cl = NH4 + +Cl_
H2O OH_ + H+
NH3·H2O+NH4Cl + H2O NH3·H2O +H ClNH4 + + H2O NH3·H2O +H+
我们再来分析,氯化铵溶液呈酸性的 原因
盐类的水解:
在水溶液中盐电离产生的离子跟水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应
形式:盐+水 酸+碱 氯化钠在溶液中的变化:NaCl = Na + +Cl_
H2O OH_ + H+
我们已经知道盐类可以通过水解呈酸碱性,那为什么NaCl的水溶液是中性?有没发生水解呢?
氯化钠没发生水解水解的条件是什么?水解的实质是什么?形式:盐+水 酸+碱实质:使水的电离平衡移动盐类的水解:
在水溶液中盐电离产生的离子跟水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应水解的条件:生成弱电解质纯碱不是碱是盐??
Na2CO3Na+ + CO32-H2OOH- + H+
+HCO3- 注意:多元酸根的水解是分步进行的,其中第一
步水解的程度要远远大于第二步的水解程度。
下列物质在水溶液中不会发生水解的是
A (NH4)2SO4 B Na2 SO4
C Al3+2(SO4 )3 D Na F谢谢!
