高三《物质结构元素周期律》复习教案
图片预览

文档简介
授课地点:一.9 授课人:靳建军 课型:复习课 时间:2007.03.16下午第三节
高三《物质结构元素周期律》复习教案
马阔
教学目标:
1、进一步了解元素周期表的结构
2、理解元素周期律的实质并能熟练应用
3、掌握原子结构与元素性质的递变关系
4、能初步具有总结元素递变规律的能力,能把位、构、性初步联系起来并熟练运用
教学重点:
1、 元素周期律的实质
2、 原子结构与元素性质的递变规律
教学难点:
位、构、性三者之间的规律及其应用
教学方法:
回答法、归纳整理、讲练结合
教学用具:
多媒体
教学过程
一、元素周期表的结构
1、周期 第一周期 2种元素
短周期 第二周期 8种元素
第三周期 8种元素
周 期 第四周期 18种元素
(横向) 长周期 第五周期 18种元素
第六周期 32种元素
不完全周期:第七周期 26种元素
2、族
主族 (A) ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 共七个主族
副族 (B) ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB共七个副族
族
(纵向) 第VIII 族:三个纵行,位于ⅦB族与ⅠB族中间
零族:稀有气体元素
对应练习:
1.2002年,美国的一期《自然》杂志披露了劳伦斯贝克莱国家实验室在1999年所宣布发现的第116号和第118号超重元素的论文有假。而2000年,俄科学家却用另外的方法获得了第116号元素,因此第118号元素被从周期表上拿下来。如果第118号放回周期表中,则应在0族。那么第116号元素在周期表中的位置( )
A第六周期ⅥA族 B第八周期ⅥA族
C第七周期ⅦA族 D第七周期ⅥA族
2.我国的纳米基础研究能力已跻身于世界前列,例如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,化学式为RN,已知该化合物中的Rn+核外有28个电子,则R元素位于周期表的( )
A第三周期ⅤA族 B第四周期ⅢA族
C第五周期ⅢA族 D第四周期ⅤA族
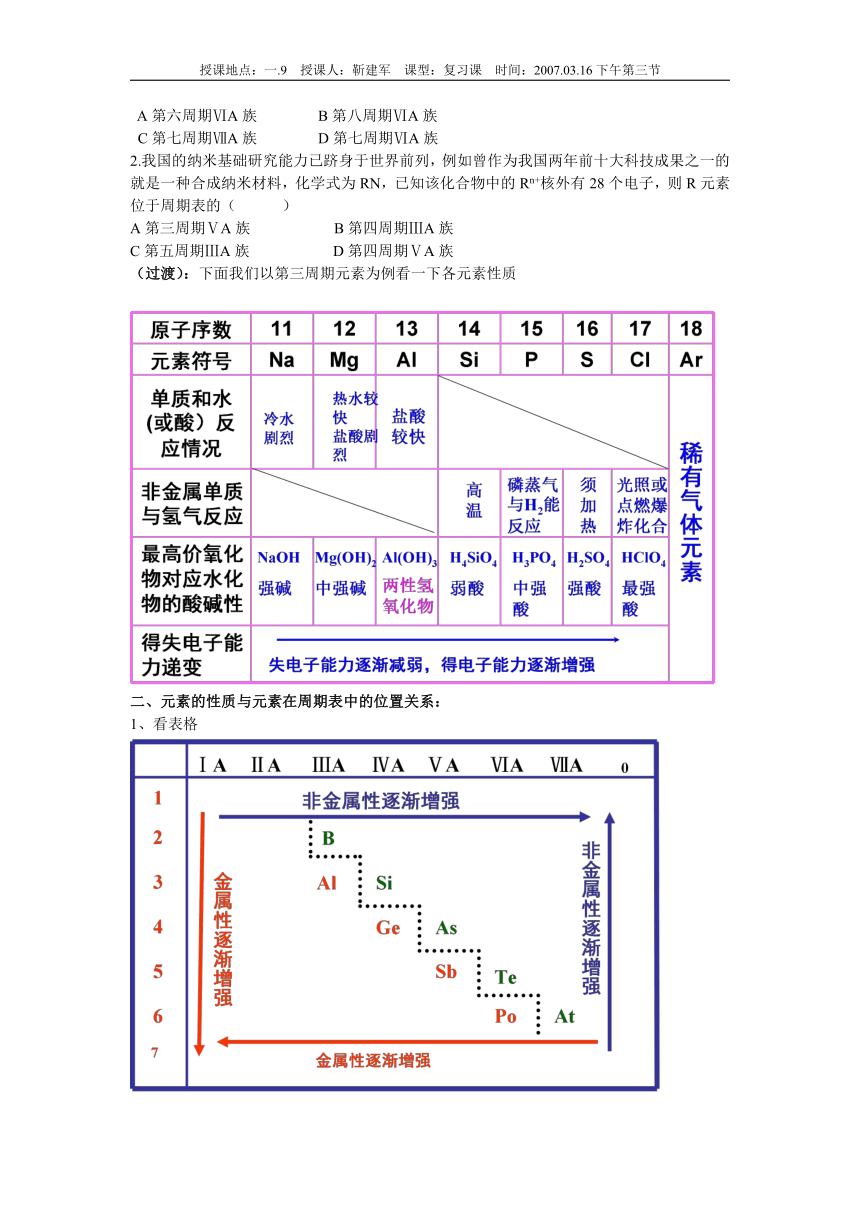
(过渡):下面我们以第三周期元素为例看一下各元素性质
二、元素的性质与元素在周期表中的位置关系:
1、看表格
2、比较元素的金属性强弱的方法是:
a.元素的单质和水或酸置换出氢气的难易
b.元素最高氧化物对应水化物的碱性强弱
c.金属单质和另外金属盐溶液中的置换反应
3、比较元素的非金属性强弱的方法是:
a.元素最高氧化物对应水化物的酸性强弱
b.元素单质和氢气反应生成气态氢化物的难易程度及气态氢化物的稳定性来判断。
c.非金属单质和另外非金属盐溶液中的置换反应
4、微粒半径大小的比较:
①同一元素的阳离子半径<相应原子半径,阴离子半径>相应原子半径,同种元素形成的不同价态的离子,价态越高,离子半径越小。
②同一周期元素原子,从左到右,原子半径逐渐变小,阴离子、阳离子半径也在变小,但阴离子半径>阳离子半径
③同一主族元素原子,从上到下,原子半径逐渐增大;同价态离子,从上到下,半径也增大
④相同电子层数的粒子,核电荷数越大,半径越小
练习、
一、已知同周期的X、Y、Z三元素的最高价氧化物的水化物的酸性由强到弱的顺序:HZO4>H2YO4>H3XO4 ,则下列判断正确的是( )
A.原子序数按 X、Y、Z 的顺序增大
B.原子半径按 X、Y、Z 的顺序减小
C.单质的氧化性按 X、Y、Z 的顺序减弱
D.气态氢化物的稳定性按 X、Y、Z 的顺序减弱
二、比较下列微粒的半径大小
1、同周期元素的原子或离子 Na、Mg、Al Cl-、S2-、P3-
2、同主族元素的原子或离子 Li、Na、K、Rb F- 、Cl-、Br-、I-
3、相同电子层结构的离子 O2-、F- 、Na+、Mg2+、Al3+
4、同一元素的原子与离子 Cl 、Cl-; Mg2+、Mg; Fe2+、Fe、Fe3+
思考:
1、同一周期阴、阳离子的电子层数一样吗?
2、X+和Y-的电子层结构相同,那么它们的离子结构是和X还是Y原子所在周期的稀有气体相同?X和Y的相对位置如何?
三、明确规律的普遍性与特殊性
小结
1.位置、结构、性质三者之间的关系:
综合练习
1、(98)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式表示为( )
A. XY B. XY2 C. XY3 D. X2Y3
2、(97)铍的原子序数为4,下列叙述正确的是 ( )
A.铍的原子半径大于硼的原子半径
B.氯化铍分子中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气
3、(2006年普通高等学校招生全国统一考试理科综合能力测试北京卷)R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A、若R(OH)n为强碱,则W(OH)n+1也为强碱
B、若HnXOm为强酸,则Y是活泼非金属元素
C、若Y的最低化合价为-2,则Z的最高正化合价为+6
D、若X的最高正化合价为+5,则五种元素都是非金属元素
4、ABC三种元素的原子具有相同的电子层数,B的核电荷数比A大2,C原子的电子总数比B原子的电子总数多4,1molA的单质跟盐酸反应可置换出11.2L标况下的H2,这时A转变成与Ne原子具有相同电子层结构的离子,试回答:
(1)写出下列元素名称A______B______C_____
(2)分别写出ABC的最高价氧化物对应水化物水溶液之间反应的离子方程式____ ;______ ____;____ ___
(3)A离子的氧化性比B离子的氧化性_____,这是由于______________
作业
练习册
板书设计
第五章物质结构元素周期律
1、 元素周期表的结构
二、元素的性质与元素在周期表中的位置关系
1、比较元素的金属性强弱的方法是:
2、比较元素的非金属性强弱的方法是
3、微粒半径大小的比较
三、明确规律的普遍性与特殊性
高三《物质结构元素周期律》复习教案
马阔
教学目标:
1、进一步了解元素周期表的结构
2、理解元素周期律的实质并能熟练应用
3、掌握原子结构与元素性质的递变关系
4、能初步具有总结元素递变规律的能力,能把位、构、性初步联系起来并熟练运用
教学重点:
1、 元素周期律的实质
2、 原子结构与元素性质的递变规律
教学难点:
位、构、性三者之间的规律及其应用
教学方法:
回答法、归纳整理、讲练结合
教学用具:
多媒体
教学过程
一、元素周期表的结构
1、周期 第一周期 2种元素
短周期 第二周期 8种元素
第三周期 8种元素
周 期 第四周期 18种元素
(横向) 长周期 第五周期 18种元素
第六周期 32种元素
不完全周期:第七周期 26种元素
2、族
主族 (A) ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 共七个主族
副族 (B) ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB共七个副族
族
(纵向) 第VIII 族:三个纵行,位于ⅦB族与ⅠB族中间
零族:稀有气体元素
对应练习:
1.2002年,美国的一期《自然》杂志披露了劳伦斯贝克莱国家实验室在1999年所宣布发现的第116号和第118号超重元素的论文有假。而2000年,俄科学家却用另外的方法获得了第116号元素,因此第118号元素被从周期表上拿下来。如果第118号放回周期表中,则应在0族。那么第116号元素在周期表中的位置( )
A第六周期ⅥA族 B第八周期ⅥA族
C第七周期ⅦA族 D第七周期ⅥA族
2.我国的纳米基础研究能力已跻身于世界前列,例如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,化学式为RN,已知该化合物中的Rn+核外有28个电子,则R元素位于周期表的( )
A第三周期ⅤA族 B第四周期ⅢA族
C第五周期ⅢA族 D第四周期ⅤA族
(过渡):下面我们以第三周期元素为例看一下各元素性质
二、元素的性质与元素在周期表中的位置关系:
1、看表格
2、比较元素的金属性强弱的方法是:
a.元素的单质和水或酸置换出氢气的难易
b.元素最高氧化物对应水化物的碱性强弱
c.金属单质和另外金属盐溶液中的置换反应
3、比较元素的非金属性强弱的方法是:
a.元素最高氧化物对应水化物的酸性强弱
b.元素单质和氢气反应生成气态氢化物的难易程度及气态氢化物的稳定性来判断。
c.非金属单质和另外非金属盐溶液中的置换反应
4、微粒半径大小的比较:
①同一元素的阳离子半径<相应原子半径,阴离子半径>相应原子半径,同种元素形成的不同价态的离子,价态越高,离子半径越小。
②同一周期元素原子,从左到右,原子半径逐渐变小,阴离子、阳离子半径也在变小,但阴离子半径>阳离子半径
③同一主族元素原子,从上到下,原子半径逐渐增大;同价态离子,从上到下,半径也增大
④相同电子层数的粒子,核电荷数越大,半径越小
练习、
一、已知同周期的X、Y、Z三元素的最高价氧化物的水化物的酸性由强到弱的顺序:HZO4>H2YO4>H3XO4 ,则下列判断正确的是( )
A.原子序数按 X、Y、Z 的顺序增大
B.原子半径按 X、Y、Z 的顺序减小
C.单质的氧化性按 X、Y、Z 的顺序减弱
D.气态氢化物的稳定性按 X、Y、Z 的顺序减弱
二、比较下列微粒的半径大小
1、同周期元素的原子或离子 Na、Mg、Al Cl-、S2-、P3-
2、同主族元素的原子或离子 Li、Na、K、Rb F- 、Cl-、Br-、I-
3、相同电子层结构的离子 O2-、F- 、Na+、Mg2+、Al3+
4、同一元素的原子与离子 Cl 、Cl-; Mg2+、Mg; Fe2+、Fe、Fe3+
思考:
1、同一周期阴、阳离子的电子层数一样吗?
2、X+和Y-的电子层结构相同,那么它们的离子结构是和X还是Y原子所在周期的稀有气体相同?X和Y的相对位置如何?
三、明确规律的普遍性与特殊性
小结
1.位置、结构、性质三者之间的关系:
综合练习
1、(98)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式表示为( )
A. XY B. XY2 C. XY3 D. X2Y3
2、(97)铍的原子序数为4,下列叙述正确的是 ( )
A.铍的原子半径大于硼的原子半径
B.氯化铍分子中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气
3、(2006年普通高等学校招生全国统一考试理科综合能力测试北京卷)R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A、若R(OH)n为强碱,则W(OH)n+1也为强碱
B、若HnXOm为强酸,则Y是活泼非金属元素
C、若Y的最低化合价为-2,则Z的最高正化合价为+6
D、若X的最高正化合价为+5,则五种元素都是非金属元素
4、ABC三种元素的原子具有相同的电子层数,B的核电荷数比A大2,C原子的电子总数比B原子的电子总数多4,1molA的单质跟盐酸反应可置换出11.2L标况下的H2,这时A转变成与Ne原子具有相同电子层结构的离子,试回答:
(1)写出下列元素名称A______B______C_____
(2)分别写出ABC的最高价氧化物对应水化物水溶液之间反应的离子方程式____ ;______ ____;____ ___
(3)A离子的氧化性比B离子的氧化性_____,这是由于______________
作业
练习册
板书设计
第五章物质结构元素周期律
1、 元素周期表的结构
二、元素的性质与元素在周期表中的位置关系
1、比较元素的金属性强弱的方法是:
2、比较元素的非金属性强弱的方法是
3、微粒半径大小的比较
三、明确规律的普遍性与特殊性
同课章节目录
