化学反应的焓变
图片预览






文档简介
课件19张PPT。敬请指导第一单元 化学反应中的热效应化学反应的焓变神州7号升空震感瞬间【分析下面反应是放热反应或吸热反应】
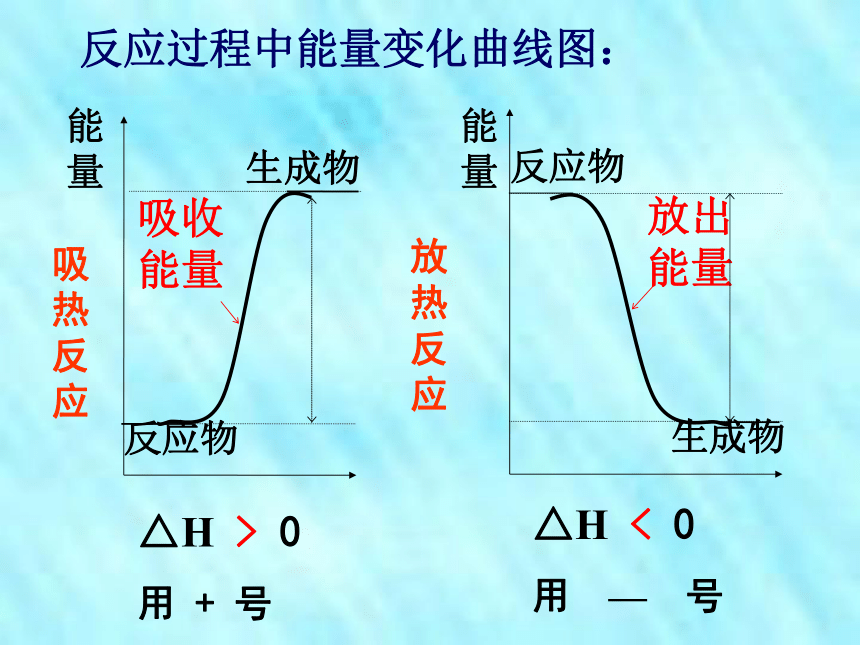
放热反应吸热反应2、符号:△H3、单位:kJ·mol-1 恒温、恒压下,化学反应过程中所吸收或释放的热量称为反应的焓变。 恒温下,化学反应过程中放出或吸收的热量叫做化学反应的反应热.焓变: 能量是守恒的,试从宏观上分析为什么有的反应会放出热量有的需要吸收热量呢? 反应物的总能量与生成物的总能量的相对大小。【探究1】【阅读P3页第一自然段】生成物反应物能量反应过程中能量变化曲线图:生成物反应物能量△H > 0
用 + 号△H < 0
用 — 号吸热反应放热反应能够表示反应热的化学方程式C(s)+ CO2(g)=2CO(g)
△H=+385.4KJ·mol-12H2(g)+ O2(g)=2H2O(l)
△H=-571.6KJ·mol-1H2(g)+1/2 O2(g)=H2O(l)
△H=-285.8KJ·mol-1【探究2】讨论热化学方程式中各物质
前面的化学计量数的意义2H2 + O2 = 2H2O 热化学方程式中,各物质的后面为什么要标明该物质的聚集状态呢?2H2(g)+O2(g)=2H2O(l)
△H=-571.6KJ·mol-12H2(g)+O2(g)=2H2O(g)
△H=-483.6KJ ·mol-1【探究3】 反应的焓变与反应物及生成物的聚集状态有关;
此外,反应的焓变还与反应温度、压强有关(若不注明则表示在298K、101kPa下).原因:(4)注明反应的温度和压强(若不注明则表示在298K、101kPa下) ;2、热化学方程式书写步骤:【例题】N2 (g)与H2 (g)反应生成1molNH3 (g) , 放出46.1KJ热量。(1)正确写出配平的化学方程式;(2)注明反应物和生成物的状态;(3)标明反应的焓变△H(注意单位和+、-)N2 +3H2 = 2NH3(g)(g)(g)△H=-92.2KJ·mol-1[练习1]写出下列反应的热化学方程式: 1、 1molC(石墨)与适量H2O (g)反应生成CO (g)和H2 (g) ,吸收131.3KJ热量。[练习2]写出下列反应的热化学方程式:
2、 1molNaOH(aq)与1molHCl(aq)发生
中和反应,放出48.6KJ热量。【练习2】参见课本P3交流与讨论)
A N2H4(g)+O2(g)=N2(g)+2H2O(g)
△H=534.4KJ ·mol-1
B N2H4 (g) + O2(g)=N2(g)+2H2O(g)
△H=-534.4KJ·mol-1
C N2H4(g) + O2(g)= N2(g)+2H2O(l)
△H=-534.4KJ·mol-1
D N2H4 +O2=N2+2H2O
△H=-534.4KJ·mol-1 E 1/2 N2H4(g) + 1/2 O2(g)= 1/2 N2(g)+H2O(g)
△H=-267.2KJ·mol-1
ⅹⅹⅹ 反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。3)要注明温度和压强:1)反应物和生成物要注明聚集状态: 3、书写热化学方程式应注意以下几点 2) △H的表示:
表明在:“+” “—”号
单位总是KJ/mol,但△H的数值与反应 式中的系数成比例旧键的断裂和新键形成放 出吸 收【探究4】试从微观上分析为什么有的反应会放出能量有的需要吸收能量反应物分子断键时吸收的能量>生成物分子成键时释放的能量 反应 反应【情况1】反应物分子断键时吸收的能量生成物分子成键时释放的能量【情况2】吸热放热【实例分析】吸收热量946KJ ·mol-1吸收热量498KJ ·mol-1N2 + O2 = 2NO吸热180KJ/mol【小结】化学反应放热反应吸热反应宏观解释微观解释热化学方程式谢 谢 大家
放热反应吸热反应2、符号:△H3、单位:kJ·mol-1 恒温、恒压下,化学反应过程中所吸收或释放的热量称为反应的焓变。 恒温下,化学反应过程中放出或吸收的热量叫做化学反应的反应热.焓变: 能量是守恒的,试从宏观上分析为什么有的反应会放出热量有的需要吸收热量呢? 反应物的总能量与生成物的总能量的相对大小。【探究1】【阅读P3页第一自然段】生成物反应物能量反应过程中能量变化曲线图:生成物反应物能量△H > 0
用 + 号△H < 0
用 — 号吸热反应放热反应能够表示反应热的化学方程式C(s)+ CO2(g)=2CO(g)
△H=+385.4KJ·mol-12H2(g)+ O2(g)=2H2O(l)
△H=-571.6KJ·mol-1H2(g)+1/2 O2(g)=H2O(l)
△H=-285.8KJ·mol-1【探究2】讨论热化学方程式中各物质
前面的化学计量数的意义2H2 + O2 = 2H2O 热化学方程式中,各物质的后面为什么要标明该物质的聚集状态呢?2H2(g)+O2(g)=2H2O(l)
△H=-571.6KJ·mol-12H2(g)+O2(g)=2H2O(g)
△H=-483.6KJ ·mol-1【探究3】 反应的焓变与反应物及生成物的聚集状态有关;
此外,反应的焓变还与反应温度、压强有关(若不注明则表示在298K、101kPa下).原因:(4)注明反应的温度和压强(若不注明则表示在298K、101kPa下) ;2、热化学方程式书写步骤:【例题】N2 (g)与H2 (g)反应生成1molNH3 (g) , 放出46.1KJ热量。(1)正确写出配平的化学方程式;(2)注明反应物和生成物的状态;(3)标明反应的焓变△H(注意单位和+、-)N2 +3H2 = 2NH3(g)(g)(g)△H=-92.2KJ·mol-1[练习1]写出下列反应的热化学方程式: 1、 1molC(石墨)与适量H2O (g)反应生成CO (g)和H2 (g) ,吸收131.3KJ热量。[练习2]写出下列反应的热化学方程式:
2、 1molNaOH(aq)与1molHCl(aq)发生
中和反应,放出48.6KJ热量。【练习2】参见课本P3交流与讨论)
A N2H4(g)+O2(g)=N2(g)+2H2O(g)
△H=534.4KJ ·mol-1
B N2H4 (g) + O2(g)=N2(g)+2H2O(g)
△H=-534.4KJ·mol-1
C N2H4(g) + O2(g)= N2(g)+2H2O(l)
△H=-534.4KJ·mol-1
D N2H4 +O2=N2+2H2O
△H=-534.4KJ·mol-1 E 1/2 N2H4(g) + 1/2 O2(g)= 1/2 N2(g)+H2O(g)
△H=-267.2KJ·mol-1
ⅹⅹⅹ 反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。3)要注明温度和压强:1)反应物和生成物要注明聚集状态: 3、书写热化学方程式应注意以下几点 2) △H的表示:
表明在:“+” “—”号
单位总是KJ/mol,但△H的数值与反应 式中的系数成比例旧键的断裂和新键形成放 出吸 收【探究4】试从微观上分析为什么有的反应会放出能量有的需要吸收能量反应物分子断键时吸收的能量>生成物分子成键时释放的能量 反应 反应【情况1】反应物分子断键时吸收的能量生成物分子成键时释放的能量【情况2】吸热放热【实例分析】吸收热量946KJ ·mol-1吸收热量498KJ ·mol-1N2 + O2 = 2NO吸热180KJ/mol【小结】化学反应放热反应吸热反应宏观解释微观解释热化学方程式谢 谢 大家
