2008-2009学年第一学期清江中学高二年级月考试卷-化学
文档属性
| 名称 | 2008-2009学年第一学期清江中学高二年级月考试卷-化学 |

|
|
| 格式 | rar | ||
| 文件大小 | 92.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-10-04 21:33:00 | ||
图片预览



文档简介
2008-2009学年第一学期清江中学高二年级月考试卷
化 学 试 题
分值 :120分 时间:100分钟
第Ⅰ卷(选择题 共48分)
一、选择题(本题共8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1、下列反应中,生成物的总能量小于反应物总能量的是
A、Ba(OH)2.8H2O与NH4Cl(固体)的反应 B、铁生锈
C、碳酸钙分解 D、焦碳在高温下与水蒸气反应
2、下列变化为放热反应的是
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如右图所示的化学反应
3、在2A+B3C+4D的反应中,下列用不同物质的变化表示
该反应的速率最快的是
A.vA=0.5mol·L-1·min-1 B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1 D.vD=1mol·L-1·min-1
4、反应H2(g)+I2(g) 2HI(g)的平衡常数为K1;反应HI(g) 1/ 2H2(g)+ 1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值)
A.K1= 2K2 B.K1= K22 C.K1 =1/K22 D.K1= 1/2K2
5、以下反应可以用熵判据来解释的是
A.硝酸铵自发地溶于水
B.CaO(s)+CO2(g)==CaCO3(s) △H=-175.7kJ/mol
C. NH4HCO3(S)+NH3(g)==(NH4)2CO3(S) △H=-74.9kJ/mol
D.2H2(g)+O2(g)==2H2O(l) △H=-285.8kJ/mol
6、国际石油价格多次上涨,为解决能源危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。已知热化学方程式:1/2C2H5OH(l)+3/2O2(g) CO2(g)+3/2H2O(l) △H=-683.4kJ/mol。下列有关说法正确的是
A.乙醇汽油是一种清洁能源,燃烧不会产生任何污染
B.在25℃、101KPa时,生成1mol水时放出683.4kJ的热量
C.乙醇的燃烧热为683.4kJ/mol
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol
7、在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)C(g)+D(g)已达平衡的是
A、混合气体的压强 B、混合气体的密度
C、混合气体的分子数目 D、混合气体的总物质的量
8、下列推论正确的是
A.S(s)+O2(g)=SO2(g) △H1,S(g)+O2(g)=SO2(g) △H2;则:△H1<△H2
B.C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H= —57.4kJ/mol,则:含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ
D.CaCO3(s)=CaO(s)+CO2(g) △H>0,△S>0,则:该反应任何温度下都能自发进行
二、选择题(本题共6小题,每小题4分,共24分,每小题有一至两个选项符合题意)
9、高温下,某反应达到平衡,平衡常数K=。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应化学方程式为CO+H2O CO2+H2 B.升高温度,逆反应速率减小
C.恒温恒容下,增大压强,H2浓度一定减小 D.该反应是焓变为正值
10、两个极易导热的密闭容器A和B(保持恒温),容器A容积恒定,容器B容积可变,在温度压强和起始体积相同的条件下往A和B中分别充入等物质的量的NO2,发生反应2NO2 ?N2O4 △H<0,以下说法正确的是
A.反应起始时,两容器中的反应速率关系是v(A)<v(B)
B.反应过程中,两容器内的反应速率关系为v(A)<v(B)
C.两容器内的反应达到平衡所需时间一定相同
D.反应达到平衡时,两容器内的压强关系是p(A)>p(B)
11、密闭容器中,反应xA(g)+yB(g) zC(g),达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的两倍,达到平衡时A的浓度降为0.3mol/L。下列判断正确的是:
A.x+yC.B的转化率降低 D.C的体积分数增大
12、在密闭容器中通入A、B两种气体,在一定条件下反应:
2A(g)+B(g)2C(g);ΔH<0。达到平衡后,改变一个条件(X),
下列量(Y)的变化一定符合图中曲线的是
X
Y
A
再加入A
B的转化率
B
再加入C
A的体积分数
C
增大压强
A的转化率
D
升高温度
混合气体平均摩尔质量
13、在密闭容器里通A、B两种气体,发生如下可逆反应
A(气)+2B(气) 2C(气)+2D(气);△H>0,下列示意图正确的是 ( )
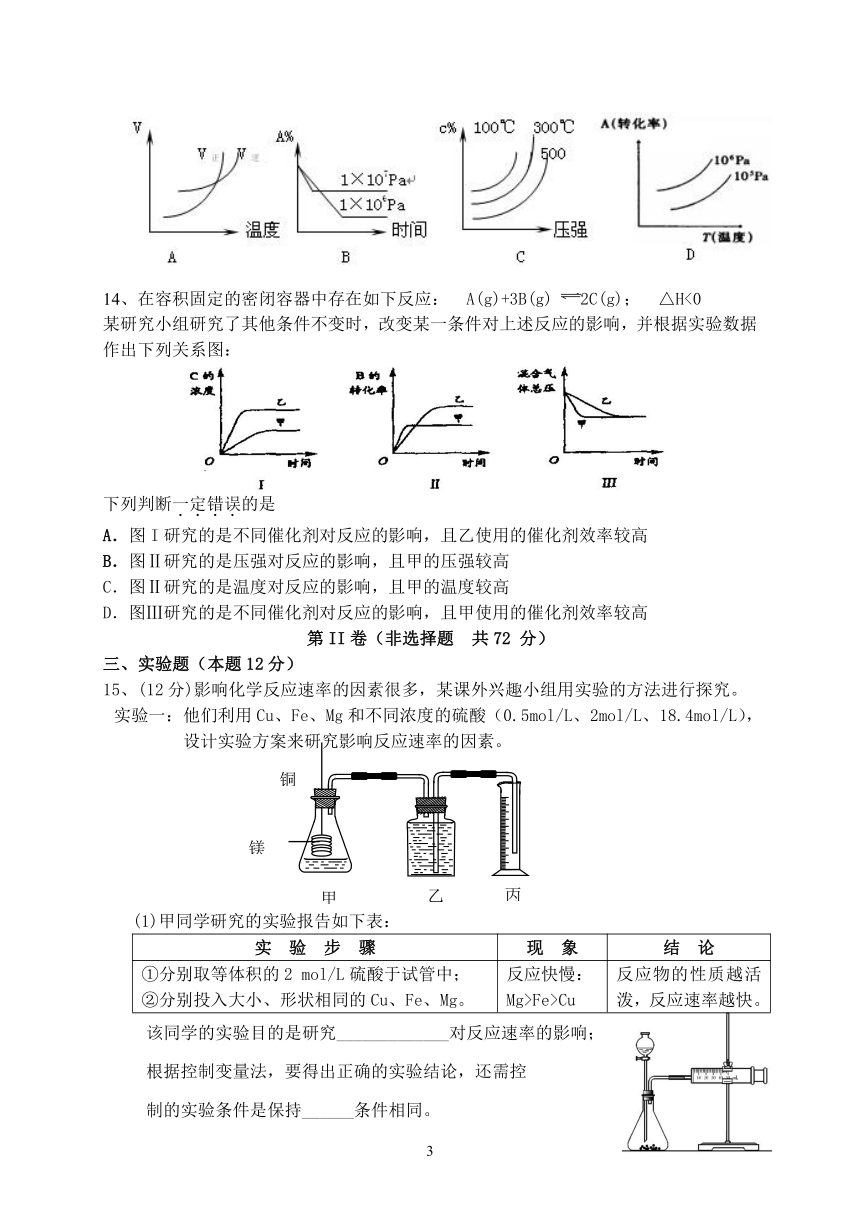
14、在容积固定的密闭容器中存在如下反应: A(g)+3B(g) 2C(g); △H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
第II卷(非选择题 共72 分)
三、实验题(本题12分)
15、(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
实 验 步 骤
现 象
结 论
①分别取等体积的2 mol/L硫酸于试管中;
②分别投入大小、形状相同的Cu、Fe、Mg。
反应快慢:
Mg>Fe>Cu
反应物的性质越活泼,反应速率越快。
该同学的实验目的是研究_____________对反应速率的影响;
根据控制变量法,要得出正确的实验结论,还需控
制的实验条件是保持______条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,
利用右图装置进行定量实验。完成该实验应选用
的实验药品是____;应该测定的实验数据是________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_______
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
四、填空题
16、(8分)在一定条件下,xA + yBzC,达到平衡,试填写下列空白:
⑴若A、B、C都是气体,减压后向逆反应方向移动,则x、y、x之间的关系是 。
⑵已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动。
⑶若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
⑷加热后C的百分含量减少,则正反应是 反应(选填“吸热”、“放热”)
17、(12分)在某一容积为5 L的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g);
反应中CO2的浓度随时间变化情况如右图:
(1) 根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=___ mol/(L·min);反应达平衡时,c(H2)=______________ mol/L,该温度下的平衡常数K= 。
(2) 不能作为判断该反应达到平衡的依据是________________。
① CO、H2O、CO2、H2的浓度都相等 ②正、逆反应速率都为零
③ CO、H2O、CO2、H2的浓度都不再发生变化 ④混合气体的密度不再发生变化
(3) 如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L。
(4)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果回答,如果升高温度该反应平衡向 方向移动。
18、(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) CH3OH(g)
不同温度时甲醇的物质的量随时间变化曲线如上右图所示。根据题意完成下列各题:
⑴ 反应达到平衡时,平衡常数表达式K = ,升高温度,K值
(填“增大”、“减小”或“不变”)。
⑵ 在500℃,从反应开始到平衡,H2的平均反应速率v(H2)= mol·(L·min)-1
⑶ 在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
e 平衡常数K增大
⑷ 据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
19、(10分)Ⅰ:水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。己知:
C (s) + H2O(g) CO (g) +H2 (g);△H =+131.3kJ?mol-1
C (s) + O2(g)=CO (g);△H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l);△H = -285.8kJ·mo1-1
(1)将2.4 g 炭转化为水煤气,再完全燃烧生成液态水,整个过程的
△H = kJ·mo1-1。
(2)由CO、H2在一定条件下可获得汽油的替代品——甲醇,甲醇的燃烧热为-726.5 kJ/mol,试写出由CO、H2生成甲醇的热化学方程式 。
Ⅱ:在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
T(℃)
700
800
1000
1200
K
0.6
0.9
1.7
2.6
(3) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.53 mol,若将混合气体加热至830℃,平衡时CO2的物质的量 (填“大于”、等于“”或“小于”)0.53 mol。
(4)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) CO(g)+H2O(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。
四、计算题:(本题共2小题,共16分)
20、(10分)在一定温度下,在一体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:
2X(g) + Y(g) a Z(g) + W(g) △H= -Q kJ·mol-1 (Q>0)(a是正整数)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1) 其它条件不变时,升高温度或向容器中通入X气体,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、X的浓度变化而变化的示意图:
(2)化学计量数a的值为 。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确? ,其理由是 。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W D.2 molX、1mol Y、1molZ
(5) X的转化率α= (用含Q、Q1的代数式表示)。
21、(10分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:
A(g)+2B(g) 3C(g),已知加入1molA和3molB且达平衡后生成a molC,问:
⑴平衡时C在反应混合气体中的体积分数是_______(用字母a表示)。
⑵在相同实验条件下,若在同一容器中改为加入2molA和6molB,达平衡后,C的物质的量为______mol(用字母a表示)。此时C在反应混合气中的体积分数____________ (填增大、减少或不变)。
⑶在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中的体积分数不变,则还应加入C mol。
⑷在同一容器中加入n molA和3n molB,在平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m之间变化,那么n与m的关系应是____________ (用字母m、n表示)。
清江中学高二年级月考化学试卷
答 题 纸
一、二、选择题:
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
答案
二、实验题
15、(12分) 实验一:(1) ___ _______、 ___ __。
(2) __ __;
_______ _____。
实验二:(1) _ ____。(2) ____ ___
四、填空题
16、(8分) ⑴ 。 ⑵ 。
⑶ 。 ⑷ 。
17、(12分) (1) ______________, 。
(2) ________________。 (3) ____________ __。
(4) 。
18、(10分)⑴ ,
⑵ ⑶
⑷
19、(10分) (1)
(2) 。
(3)
(4) 、 。
四、计算题:
20、(10分)(1)
(2) 。
(3) , 。
(4)
(5)
21、(10分)⑴____ ___
⑵____ _ _ 、____ ________
⑶ 。
⑷____________
答 案:
题号
1
2
3
4
5
6
7
8
答案
B
D
B
C
A
D
B
C
题号
9
10
11
12
13
14
答案
D
B
C
AC
AB
AB
15.(每空2分,共12分)
实验一:(1)反应物本身的性质对反应速率的关系;(2分)
温度相同;(2分)
(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;(2分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
实验二:(1)催化剂(或硫酸锰或Mn2+的催化作用);(2分)
(2)B (2分)
16、x+y>z 逆向 固态或液态 放热
17、(每空2分,共12分)
(1)0.003 0.03 1 (2)①②④ (3)0.03 (4)逆反应
18、(共10分,每空2分)(1)K=c(CH3OH)/c(CO)·c2(H2) 减小
(2)2nB/3tB (3)b c (4)Cu2O+CO2Cu+CO2
19.(10分)
(1) -78.7(2分) (2) CO(g) +2 H2(g)=CH3OH(l) △H = -128.1 kJ·mo1-1 (2分)
(3) <(2分) (4) 逆反应(1分) >0.9 (1分)
20、(共12分)
(1) 减小 (2分) (2) 1 (2分)
(3) 正确(2分) 2 molX和1 molY不可能完全反应 (2分)
(4) A (2分,有错不给分) (5) (2分)
21.⑴ ⑵2a 不变 (3)6 (4) n>
化 学 试 题
分值 :120分 时间:100分钟
第Ⅰ卷(选择题 共48分)
一、选择题(本题共8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1、下列反应中,生成物的总能量小于反应物总能量的是
A、Ba(OH)2.8H2O与NH4Cl(固体)的反应 B、铁生锈
C、碳酸钙分解 D、焦碳在高温下与水蒸气反应
2、下列变化为放热反应的是
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如右图所示的化学反应
3、在2A+B3C+4D的反应中,下列用不同物质的变化表示
该反应的速率最快的是
A.vA=0.5mol·L-1·min-1 B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1 D.vD=1mol·L-1·min-1
4、反应H2(g)+I2(g) 2HI(g)的平衡常数为K1;反应HI(g) 1/ 2H2(g)+ 1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值)
A.K1= 2K2 B.K1= K22 C.K1 =1/K22 D.K1= 1/2K2
5、以下反应可以用熵判据来解释的是
A.硝酸铵自发地溶于水
B.CaO(s)+CO2(g)==CaCO3(s) △H=-175.7kJ/mol
C. NH4HCO3(S)+NH3(g)==(NH4)2CO3(S) △H=-74.9kJ/mol
D.2H2(g)+O2(g)==2H2O(l) △H=-285.8kJ/mol
6、国际石油价格多次上涨,为解决能源危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。已知热化学方程式:1/2C2H5OH(l)+3/2O2(g) CO2(g)+3/2H2O(l) △H=-683.4kJ/mol。下列有关说法正确的是
A.乙醇汽油是一种清洁能源,燃烧不会产生任何污染
B.在25℃、101KPa时,生成1mol水时放出683.4kJ的热量
C.乙醇的燃烧热为683.4kJ/mol
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol
7、在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)C(g)+D(g)已达平衡的是
A、混合气体的压强 B、混合气体的密度
C、混合气体的分子数目 D、混合气体的总物质的量
8、下列推论正确的是
A.S(s)+O2(g)=SO2(g) △H1,S(g)+O2(g)=SO2(g) △H2;则:△H1<△H2
B.C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H= —57.4kJ/mol,则:含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ
D.CaCO3(s)=CaO(s)+CO2(g) △H>0,△S>0,则:该反应任何温度下都能自发进行
二、选择题(本题共6小题,每小题4分,共24分,每小题有一至两个选项符合题意)
9、高温下,某反应达到平衡,平衡常数K=。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应化学方程式为CO+H2O CO2+H2 B.升高温度,逆反应速率减小
C.恒温恒容下,增大压强,H2浓度一定减小 D.该反应是焓变为正值
10、两个极易导热的密闭容器A和B(保持恒温),容器A容积恒定,容器B容积可变,在温度压强和起始体积相同的条件下往A和B中分别充入等物质的量的NO2,发生反应2NO2 ?N2O4 △H<0,以下说法正确的是
A.反应起始时,两容器中的反应速率关系是v(A)<v(B)
B.反应过程中,两容器内的反应速率关系为v(A)<v(B)
C.两容器内的反应达到平衡所需时间一定相同
D.反应达到平衡时,两容器内的压强关系是p(A)>p(B)
11、密闭容器中,反应xA(g)+yB(g) zC(g),达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的两倍,达到平衡时A的浓度降为0.3mol/L。下列判断正确的是:
A.x+y
12、在密闭容器中通入A、B两种气体,在一定条件下反应:
2A(g)+B(g)2C(g);ΔH<0。达到平衡后,改变一个条件(X),
下列量(Y)的变化一定符合图中曲线的是
X
Y
A
再加入A
B的转化率
B
再加入C
A的体积分数
C
增大压强
A的转化率
D
升高温度
混合气体平均摩尔质量
13、在密闭容器里通A、B两种气体,发生如下可逆反应
A(气)+2B(气) 2C(气)+2D(气);△H>0,下列示意图正确的是 ( )
14、在容积固定的密闭容器中存在如下反应: A(g)+3B(g) 2C(g); △H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
第II卷(非选择题 共72 分)
三、实验题(本题12分)
15、(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
实 验 步 骤
现 象
结 论
①分别取等体积的2 mol/L硫酸于试管中;
②分别投入大小、形状相同的Cu、Fe、Mg。
反应快慢:
Mg>Fe>Cu
反应物的性质越活泼,反应速率越快。
该同学的实验目的是研究_____________对反应速率的影响;
根据控制变量法,要得出正确的实验结论,还需控
制的实验条件是保持______条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,
利用右图装置进行定量实验。完成该实验应选用
的实验药品是____;应该测定的实验数据是________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_______
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
四、填空题
16、(8分)在一定条件下,xA + yBzC,达到平衡,试填写下列空白:
⑴若A、B、C都是气体,减压后向逆反应方向移动,则x、y、x之间的关系是 。
⑵已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动。
⑶若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
⑷加热后C的百分含量减少,则正反应是 反应(选填“吸热”、“放热”)
17、(12分)在某一容积为5 L的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g);
反应中CO2的浓度随时间变化情况如右图:
(1) 根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=___ mol/(L·min);反应达平衡时,c(H2)=______________ mol/L,该温度下的平衡常数K= 。
(2) 不能作为判断该反应达到平衡的依据是________________。
① CO、H2O、CO2、H2的浓度都相等 ②正、逆反应速率都为零
③ CO、H2O、CO2、H2的浓度都不再发生变化 ④混合气体的密度不再发生变化
(3) 如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L。
(4)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果回答,如果升高温度该反应平衡向 方向移动。
18、(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) CH3OH(g)
不同温度时甲醇的物质的量随时间变化曲线如上右图所示。根据题意完成下列各题:
⑴ 反应达到平衡时,平衡常数表达式K = ,升高温度,K值
(填“增大”、“减小”或“不变”)。
⑵ 在500℃,从反应开始到平衡,H2的平均反应速率v(H2)= mol·(L·min)-1
⑶ 在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
e 平衡常数K增大
⑷ 据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
19、(10分)Ⅰ:水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。己知:
C (s) + H2O(g) CO (g) +H2 (g);△H =+131.3kJ?mol-1
C (s) + O2(g)=CO (g);△H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l);△H = -285.8kJ·mo1-1
(1)将2.4 g 炭转化为水煤气,再完全燃烧生成液态水,整个过程的
△H = kJ·mo1-1。
(2)由CO、H2在一定条件下可获得汽油的替代品——甲醇,甲醇的燃烧热为-726.5 kJ/mol,试写出由CO、H2生成甲醇的热化学方程式 。
Ⅱ:在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
T(℃)
700
800
1000
1200
K
0.6
0.9
1.7
2.6
(3) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.53 mol,若将混合气体加热至830℃,平衡时CO2的物质的量 (填“大于”、等于“”或“小于”)0.53 mol。
(4)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) CO(g)+H2O(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。
四、计算题:(本题共2小题,共16分)
20、(10分)在一定温度下,在一体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:
2X(g) + Y(g) a Z(g) + W(g) △H= -Q kJ·mol-1 (Q>0)(a是正整数)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1) 其它条件不变时,升高温度或向容器中通入X气体,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、X的浓度变化而变化的示意图:
(2)化学计量数a的值为 。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确? ,其理由是 。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W D.2 molX、1mol Y、1molZ
(5) X的转化率α= (用含Q、Q1的代数式表示)。
21、(10分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:
A(g)+2B(g) 3C(g),已知加入1molA和3molB且达平衡后生成a molC,问:
⑴平衡时C在反应混合气体中的体积分数是_______(用字母a表示)。
⑵在相同实验条件下,若在同一容器中改为加入2molA和6molB,达平衡后,C的物质的量为______mol(用字母a表示)。此时C在反应混合气中的体积分数____________ (填增大、减少或不变)。
⑶在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中的体积分数不变,则还应加入C mol。
⑷在同一容器中加入n molA和3n molB,在平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m之间变化,那么n与m的关系应是____________ (用字母m、n表示)。
清江中学高二年级月考化学试卷
答 题 纸
一、二、选择题:
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
答案
二、实验题
15、(12分) 实验一:(1) ___ _______、 ___ __。
(2) __ __;
_______ _____。
实验二:(1) _ ____。(2) ____ ___
四、填空题
16、(8分) ⑴ 。 ⑵ 。
⑶ 。 ⑷ 。
17、(12分) (1) ______________, 。
(2) ________________。 (3) ____________ __。
(4) 。
18、(10分)⑴ ,
⑵ ⑶
⑷
19、(10分) (1)
(2) 。
(3)
(4) 、 。
四、计算题:
20、(10分)(1)
(2) 。
(3) , 。
(4)
(5)
21、(10分)⑴____ ___
⑵____ _ _ 、____ ________
⑶ 。
⑷____________
答 案:
题号
1
2
3
4
5
6
7
8
答案
B
D
B
C
A
D
B
C
题号
9
10
11
12
13
14
答案
D
B
C
AC
AB
AB
15.(每空2分,共12分)
实验一:(1)反应物本身的性质对反应速率的关系;(2分)
温度相同;(2分)
(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;(2分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
实验二:(1)催化剂(或硫酸锰或Mn2+的催化作用);(2分)
(2)B (2分)
16、x+y>z 逆向 固态或液态 放热
17、(每空2分,共12分)
(1)0.003 0.03 1 (2)①②④ (3)0.03 (4)逆反应
18、(共10分,每空2分)(1)K=c(CH3OH)/c(CO)·c2(H2) 减小
(2)2nB/3tB (3)b c (4)Cu2O+CO2Cu+CO2
19.(10分)
(1) -78.7(2分) (2) CO(g) +2 H2(g)=CH3OH(l) △H = -128.1 kJ·mo1-1 (2分)
(3) <(2分) (4) 逆反应(1分) >0.9 (1分)
20、(共12分)
(1) 减小 (2分) (2) 1 (2分)
(3) 正确(2分) 2 molX和1 molY不可能完全反应 (2分)
(4) A (2分,有错不给分) (5) (2分)
21.⑴ ⑵2a 不变 (3)6 (4) n>
同课章节目录
