影响化学反应速率的因素
图片预览








文档简介
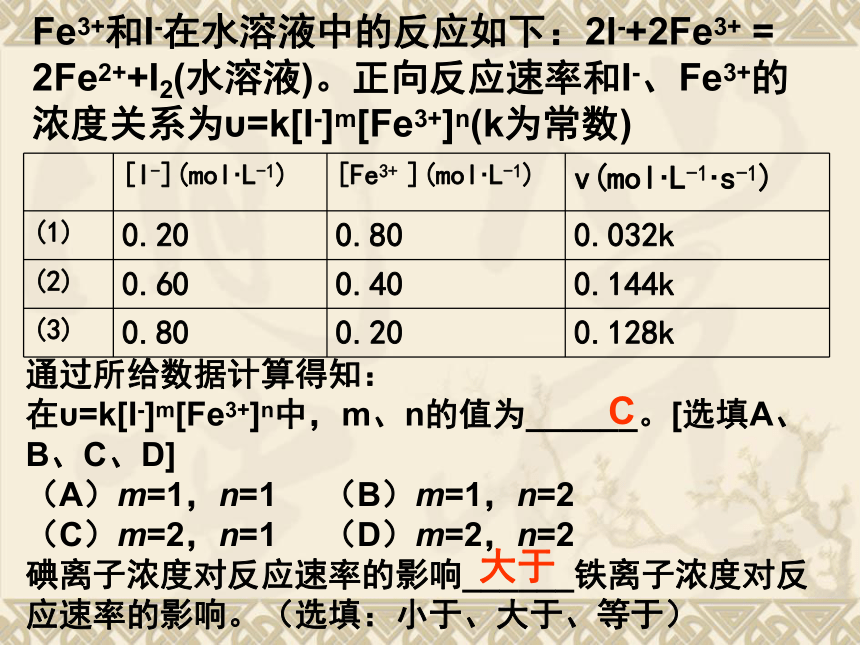
课件22张PPT。Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ = 2Fe2++I2(水溶液)。正向反应速率和I-、Fe3+的浓度关系为υ=k[I-]m[Fe3+]n(k为常数)通过所给数据计算得知:
在υ=k[I-]m[Fe3+]n中,m、n的值为______。[选填A、B、C、D]
(A)m=1,n=1 (B)m=1,n=2
(C)m=2,n=1 (D)m=2,n=2
碘离子浓度对反应速率的影响______铁离子浓度对反应速率的影响。(选填:小于、大于、等于)C大于新课标人教版化学选修4 第二章 化学反应速率和化学平衡第二节 影响化学反应速率的因素思考题1 一辆汽车行驶速率的决定因素是什么?影响因素是什么?
决定因素是:汽车的性能(如功率等)
影响因素:
⑴天气
⑵路况
⑶燃料质量
⑷司机的驾驶水平和经验
思考题2化学反应是物质运动的一种形式,那么决定这种运动形式运动速率的因素是什么?影响因素是什么?
决定因素:参加化学反应的物质的性质
影响因素:
⑴浓度;⑵温度;⑶压强
⑷催化剂; ⑸其他因素
化学反应速率与分子间的有效碰撞频率有关。想一想,我们以前学过的、用过的和日常生活中改变速率的方法有哪些?
我们知道的改变反应速率的措施有∶加热、搅拌、增大反应物的浓度、使用催化剂、汽车加大油门、炉膛安装鼓风机、把煤块粉碎后使用、用冰箱保存食物、糕点盒装小包除氧剂等等。
影响速率的因素∶一、内因:
物质本身的结构和性质是化学反应速率大小的决定因素,反应类型不同有不同的化学反应速率,反应类型相同但反应物不同,化学反应速率也不同。
参加反应的物质的性质和反应的历程,是决定化学反应速率的主要因素。例:F2、Cl2、Br2、I2与H2的反应。 例:Mg、Al、Cu与稀硫酸的作用。Al与稀硫酸、浓硫酸的作用。二、外因(反应物的浓度、温度、体系的压强、催化剂、溶剂、光辐射、放射线辐射、超声波、电弧、强磁场、高速研磨、颗粒大小等等)
化学反应的过程是反应物分子中的原子
重新组合,生成生成物分子的过程;也是
反应物分子中化学键的断裂、生成物分子
形成的先决条件。 如化学键的形成的过程∶旧键的断裂、新键的形成都是通过反应物分子(或离子)的相互碰撞来实现的,如果反应物分子(或离子)的相互不接触、不碰撞,就不可能发生化学反应;因此,反应物分子(或离子)的碰撞是发生的。例如在101k Pa和500OC时, 0.001mol/L的 HI气体, 每升气体中,分子碰撞达每秒3.5x1028 次之多。又如2,在常温下常 压下, H2和O2混合可以长时间共存而不发生明显反应,可见反应物分子(或离子)的每次碰撞不一定都能发生化学反应。
我们把能够发生化学反应的碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫活化分子。用有效碰撞理论解释影响化学反应速率的因素(1)浓度对反应速率的影响
增大反应物浓度→单位体积内活化分子数增多→单位时间内有效碰撞次数多→反应速率增大。相反,反应速率减慢。注意:适宜有液体和气体参加的反应 (2)压强对反应速率的影响
对于气体反应,当其它条件不变时,增大压强相当于增大反应物的浓度,反应速率加快;减小压强相当于减少反应物的浓度,反应速率减慢。 (只适宜有气体参加或生成的反应,如果只有固体或液体参加的反应,压强的变化对于反应速率可以忽略不计。)
对于有气体参加的反应,当其他条件不变时,改变压强,对化学反应速率产生影响的根本原因是引起浓度的改变。所以讨论压强对反应速率的影响时,应区分引起压强改变的原因,这种改变对反应体系的浓度产生何种影响,由此判断出反应速率有何影响。
对于气体反应体系,有以下几种情况: ①恒温时:
增大压强→体积缩小→浓度增大→单位体积内活化分子数增多→有效碰撞次数增多→反应速率加快;②恒容时: a.充入气体反应物→总压增大→浓度增大→单位体积内活化分子数增多→有效碰撞次数增多→速率加快;b.充入“惰气”→总压增大。但分压不变,即各物质浓度不变,单位体积内活化分子数不变→有效碰撞次数不变,反应速率不变。③恒压时:
充入“惰气”→体积增大→各反应物浓度减小→单位体积内活化分子数减小→有效碰撞次数减小→反应速率减慢。(3)温度对化学反应速率的影响
在浓度一定时,升高温度,反应物分子的能量增加,使原来一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中的活化分子数,使有效碰撞次数增多,因而使反应速率增大。当然,由于升高温度,会使 分子的运动加快,单位时间里反应物分子间的碰撞次数增加,反应也会相应加快,但这不是主要原因。注:温度对反应速率影响的规律,对吸热反应、放热反应都适用;一般来说,温度每升高100C,反应速率增大到原来的2~4倍。 (4)催化剂对化学反应速率的影响 催化剂能够降低反应所需要的活化能,这样使更多的反应物分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占百分数,从而提高了有效碰撞的频率,成千上万倍地增大化学反应速率。如以下反应,加入二氧化锰加速过氧化氢的分解速度。 MnO2 2H2O====2H2O+O2↑外界条件对化学反应速率影响的原因单位体积内分子数增加
(活化分子百分数不变),
活化分子数相应增加
反应物分子能量增加,
活化分子百分数增加
降低反应所需的能量,
使活化分子百分数增加单位体积
内活化分
子数增加
有效碰撞
次数增多
反应速率
加快。
1 、试将外界条件对反应速率的影响结果
填入下表中: 课堂练习2、对于在一个密闭容器中进行的可逆反应:
C(s)+ O2 = CO2 (s)
下列说法中错误的是( )
A、将碳块粉碎成粉末可以加快化学反应速率
B、增大氧气的量可以加快化学反应速率
C、增加碳的量可以加快化学反应速率
c3、对于反应∶N2+O2 2NO,在密闭容器中进行,下列条件能加快反应速率的是 ( )
A、缩小体积使压强增大
B、体积不变充入氮气使压强增大
C、体积不变充入惰性气体
D、使总压强不变,充入惰性气体A、B4、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的( )
A、NaOH溶液
B、水;
C、 Na2CO3溶液
D、 NaCl溶液B、D5、把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,
X和盐酸缓慢地进行反应,其中反应最快的是
A.10℃20mL 3mol/L的X溶液 B.20℃30mL 2mol/L的X溶液
C.20℃10mL 4mol/L的X溶液 D.10℃10mL 2mol/L的X溶液解析:在化学反应中,当其它条件不变时,浓度越大,反应速率越快;温度越高,反应速率越快。在本题中要综合考虑浓度和温度的影响。先比较浓度的大小,这里的浓度应该是混合以后的浓度,由于混合后各烧杯中盐酸的浓度相等,因此只要比较X的浓度,X浓度越大,反应速率越快。因为反应后溶液的体积均为50mL,所以X的物质的量最大,浓度就最大。通过观察可知,混合后A、B选项中X的浓度相等,且最大,但B中温度更高,因此B的反应速率最快。B
在υ=k[I-]m[Fe3+]n中,m、n的值为______。[选填A、B、C、D]
(A)m=1,n=1 (B)m=1,n=2
(C)m=2,n=1 (D)m=2,n=2
碘离子浓度对反应速率的影响______铁离子浓度对反应速率的影响。(选填:小于、大于、等于)C大于新课标人教版化学选修4 第二章 化学反应速率和化学平衡第二节 影响化学反应速率的因素思考题1 一辆汽车行驶速率的决定因素是什么?影响因素是什么?
决定因素是:汽车的性能(如功率等)
影响因素:
⑴天气
⑵路况
⑶燃料质量
⑷司机的驾驶水平和经验
思考题2化学反应是物质运动的一种形式,那么决定这种运动形式运动速率的因素是什么?影响因素是什么?
决定因素:参加化学反应的物质的性质
影响因素:
⑴浓度;⑵温度;⑶压强
⑷催化剂; ⑸其他因素
化学反应速率与分子间的有效碰撞频率有关。想一想,我们以前学过的、用过的和日常生活中改变速率的方法有哪些?
我们知道的改变反应速率的措施有∶加热、搅拌、增大反应物的浓度、使用催化剂、汽车加大油门、炉膛安装鼓风机、把煤块粉碎后使用、用冰箱保存食物、糕点盒装小包除氧剂等等。
影响速率的因素∶一、内因:
物质本身的结构和性质是化学反应速率大小的决定因素,反应类型不同有不同的化学反应速率,反应类型相同但反应物不同,化学反应速率也不同。
参加反应的物质的性质和反应的历程,是决定化学反应速率的主要因素。例:F2、Cl2、Br2、I2与H2的反应。 例:Mg、Al、Cu与稀硫酸的作用。Al与稀硫酸、浓硫酸的作用。二、外因(反应物的浓度、温度、体系的压强、催化剂、溶剂、光辐射、放射线辐射、超声波、电弧、强磁场、高速研磨、颗粒大小等等)
化学反应的过程是反应物分子中的原子
重新组合,生成生成物分子的过程;也是
反应物分子中化学键的断裂、生成物分子
形成的先决条件。 如化学键的形成的过程∶旧键的断裂、新键的形成都是通过反应物分子(或离子)的相互碰撞来实现的,如果反应物分子(或离子)的相互不接触、不碰撞,就不可能发生化学反应;因此,反应物分子(或离子)的碰撞是发生的。例如在101k Pa和500OC时, 0.001mol/L的 HI气体, 每升气体中,分子碰撞达每秒3.5x1028 次之多。又如2,在常温下常 压下, H2和O2混合可以长时间共存而不发生明显反应,可见反应物分子(或离子)的每次碰撞不一定都能发生化学反应。
我们把能够发生化学反应的碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫活化分子。用有效碰撞理论解释影响化学反应速率的因素(1)浓度对反应速率的影响
增大反应物浓度→单位体积内活化分子数增多→单位时间内有效碰撞次数多→反应速率增大。相反,反应速率减慢。注意:适宜有液体和气体参加的反应 (2)压强对反应速率的影响
对于气体反应,当其它条件不变时,增大压强相当于增大反应物的浓度,反应速率加快;减小压强相当于减少反应物的浓度,反应速率减慢。 (只适宜有气体参加或生成的反应,如果只有固体或液体参加的反应,压强的变化对于反应速率可以忽略不计。)
对于有气体参加的反应,当其他条件不变时,改变压强,对化学反应速率产生影响的根本原因是引起浓度的改变。所以讨论压强对反应速率的影响时,应区分引起压强改变的原因,这种改变对反应体系的浓度产生何种影响,由此判断出反应速率有何影响。
对于气体反应体系,有以下几种情况: ①恒温时:
增大压强→体积缩小→浓度增大→单位体积内活化分子数增多→有效碰撞次数增多→反应速率加快;②恒容时: a.充入气体反应物→总压增大→浓度增大→单位体积内活化分子数增多→有效碰撞次数增多→速率加快;b.充入“惰气”→总压增大。但分压不变,即各物质浓度不变,单位体积内活化分子数不变→有效碰撞次数不变,反应速率不变。③恒压时:
充入“惰气”→体积增大→各反应物浓度减小→单位体积内活化分子数减小→有效碰撞次数减小→反应速率减慢。(3)温度对化学反应速率的影响
在浓度一定时,升高温度,反应物分子的能量增加,使原来一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中的活化分子数,使有效碰撞次数增多,因而使反应速率增大。当然,由于升高温度,会使 分子的运动加快,单位时间里反应物分子间的碰撞次数增加,反应也会相应加快,但这不是主要原因。注:温度对反应速率影响的规律,对吸热反应、放热反应都适用;一般来说,温度每升高100C,反应速率增大到原来的2~4倍。 (4)催化剂对化学反应速率的影响 催化剂能够降低反应所需要的活化能,这样使更多的反应物分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占百分数,从而提高了有效碰撞的频率,成千上万倍地增大化学反应速率。如以下反应,加入二氧化锰加速过氧化氢的分解速度。 MnO2 2H2O====2H2O+O2↑外界条件对化学反应速率影响的原因单位体积内分子数增加
(活化分子百分数不变),
活化分子数相应增加
反应物分子能量增加,
活化分子百分数增加
降低反应所需的能量,
使活化分子百分数增加单位体积
内活化分
子数增加
有效碰撞
次数增多
反应速率
加快。
1 、试将外界条件对反应速率的影响结果
填入下表中: 课堂练习2、对于在一个密闭容器中进行的可逆反应:
C(s)+ O2 = CO2 (s)
下列说法中错误的是( )
A、将碳块粉碎成粉末可以加快化学反应速率
B、增大氧气的量可以加快化学反应速率
C、增加碳的量可以加快化学反应速率
c3、对于反应∶N2+O2 2NO,在密闭容器中进行,下列条件能加快反应速率的是 ( )
A、缩小体积使压强增大
B、体积不变充入氮气使压强增大
C、体积不变充入惰性气体
D、使总压强不变,充入惰性气体A、B4、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的( )
A、NaOH溶液
B、水;
C、 Na2CO3溶液
D、 NaCl溶液B、D5、把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,
X和盐酸缓慢地进行反应,其中反应最快的是
A.10℃20mL 3mol/L的X溶液 B.20℃30mL 2mol/L的X溶液
C.20℃10mL 4mol/L的X溶液 D.10℃10mL 2mol/L的X溶液解析:在化学反应中,当其它条件不变时,浓度越大,反应速率越快;温度越高,反应速率越快。在本题中要综合考虑浓度和温度的影响。先比较浓度的大小,这里的浓度应该是混合以后的浓度,由于混合后各烧杯中盐酸的浓度相等,因此只要比较X的浓度,X浓度越大,反应速率越快。因为反应后溶液的体积均为50mL,所以X的物质的量最大,浓度就最大。通过观察可知,混合后A、B选项中X的浓度相等,且最大,但B中温度更高,因此B的反应速率最快。B
