化学能转化为电能 -原电池
图片预览




文档简介
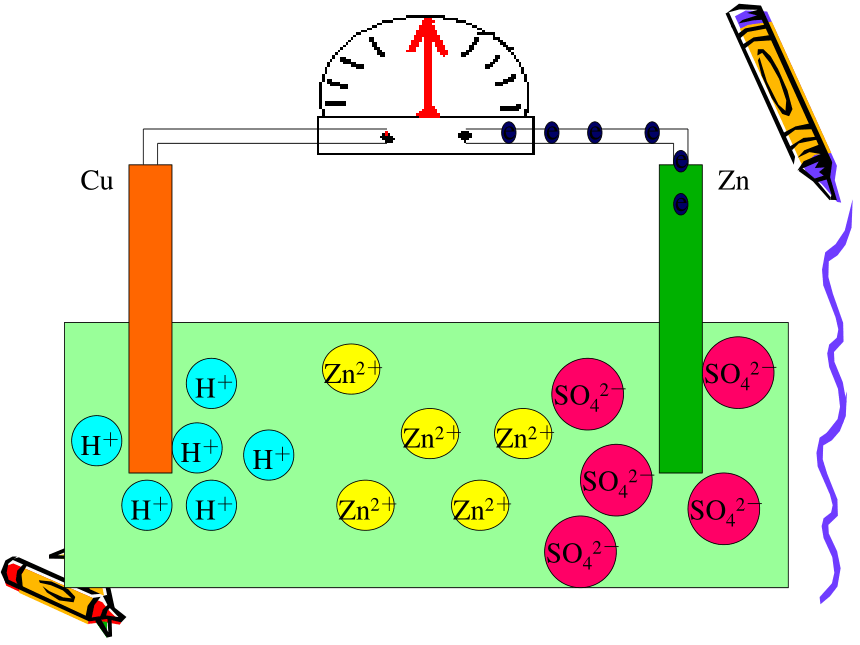
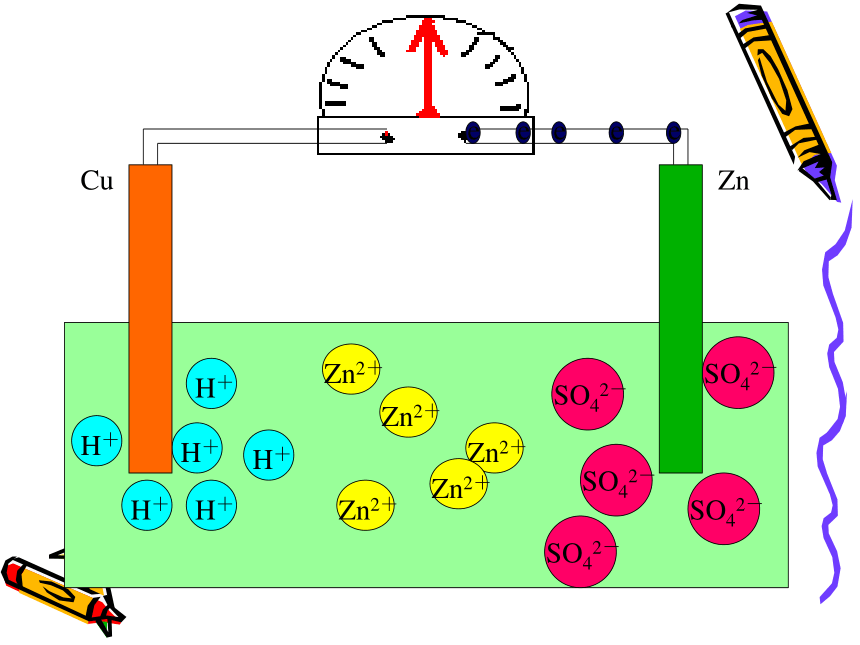
课件43张PPT。原电池 把锌片和铜片放到稀硫酸溶液中会有什么现象?(两金属不接触) 问 题 一现象:锌片上有气体生成
铜片上没变化 化学方程式:Zn+H2SO4= ZnSO4 +H2↑ 如果将铜片和锌片(不接触)用导线连接起来又会有什么现象?方程式怎么写? 动画模拟演示(微观)
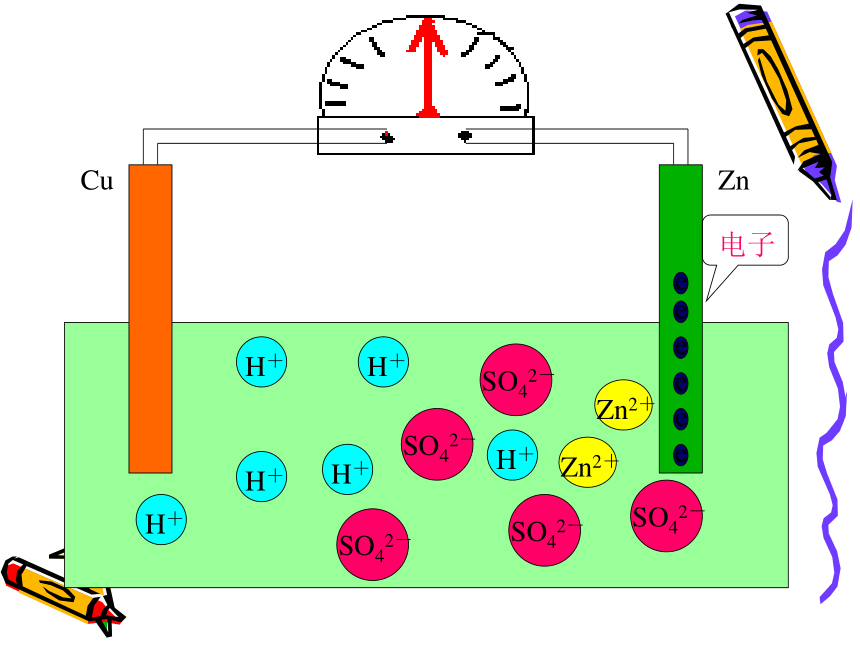
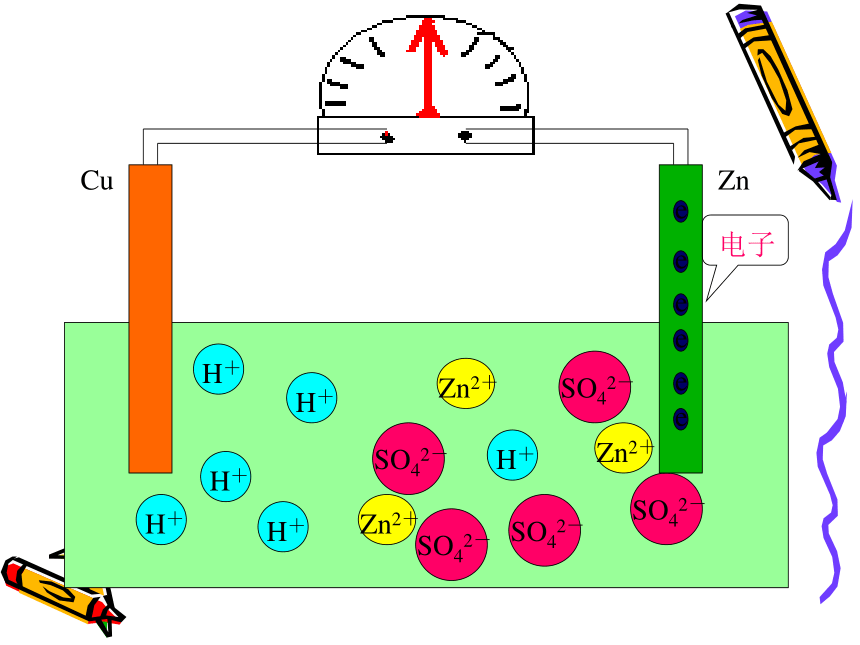
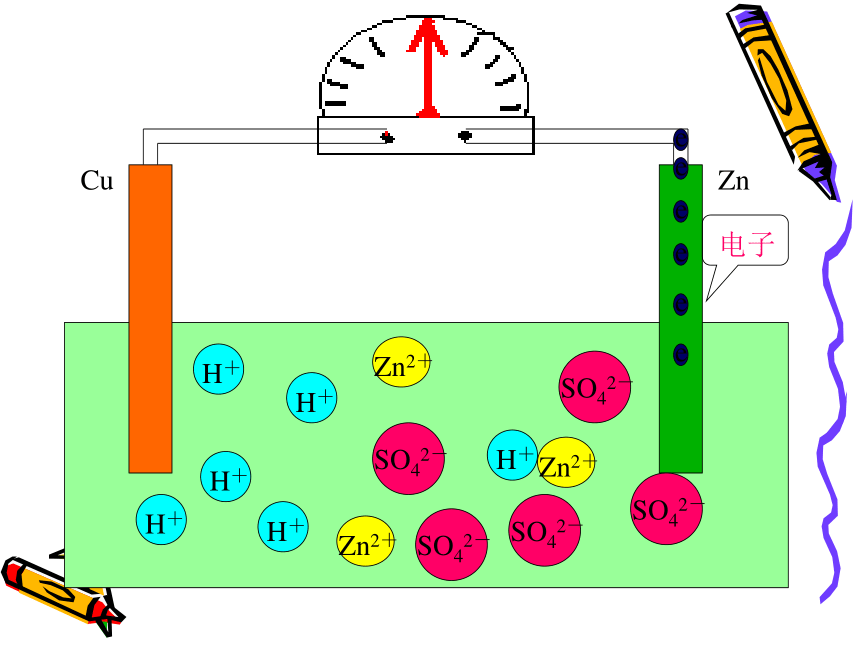
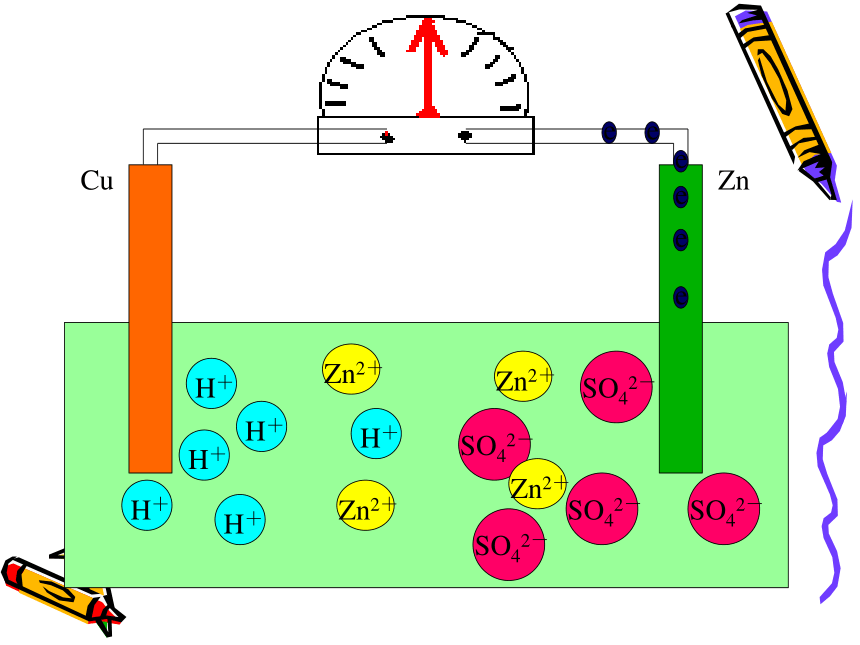
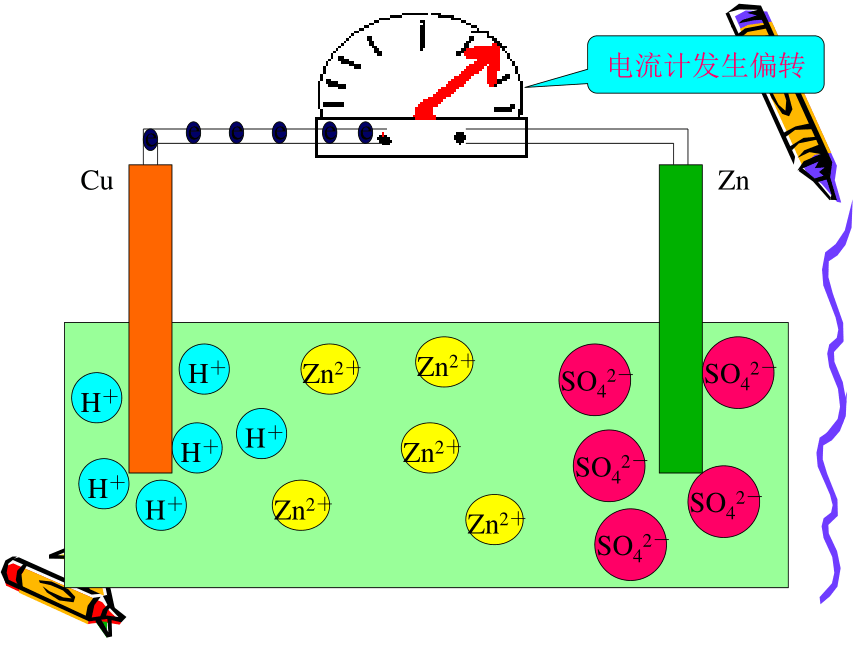
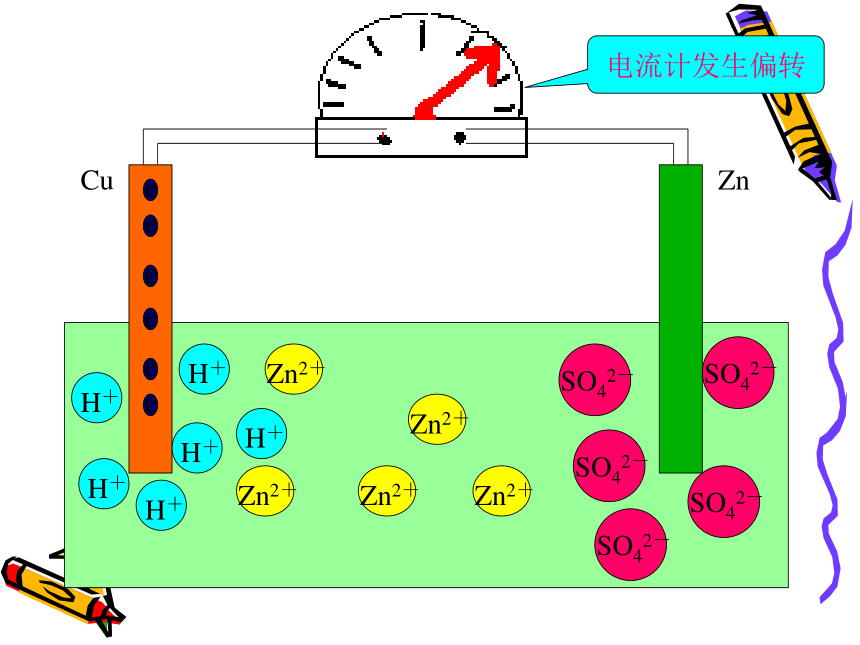
注意观察问 题 二CuZnCuZnCuZnCuZnCuZnCuZnCuZn电流计发生偏转CuZn电流计发生偏转CuZn电流计发生偏转CuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZn现象:㈠锌片上不再放出气体
但是锌片不断溶解
㈡铜片上有气体放出
㈢电流计指针发生偏转
电极反应式:锌片(负极):Zn-2e -=Zn2+ (氧化反应)
铜片(正极):2H++2e-=H2 ↑ (还原反应)可观察到电流计发生偏转
说明:
此装置是一个将化学能转换成电能的装置。
我们把这种化学能转变为电能的装置叫 原电池2、原电池的两极确定失去电子的一极叫负极,用 - 表示。
得到电子的一极叫正极,用 + 表示。3、原电池两极的化学反应表示方法,
又叫电极反应。负极:(Zn ) Zn - 2e- = Zn2+ (氧化反应)
正极:(Cu ) 2H++ 2e- = H2↑ (还原反应)总反应式:综合正极和负极电极反应式而得:
Zn+ 2H+ = Zn2+ + H2↑ 原 电 池1、定义:把化学能转化为电能的装置。4、原电池的形成条件1、活动性不同的金属(其中一种可以为
非金属,即作导体用)作电极。2、两电极插入电解质溶液中。3、形成闭合回路。(两电极外线用导线
连接,可以接用电器。)构成前提:两个电极中至少有一个可以和电解质溶液自发地发生氧化还原反应. [探究实验一]
[对比实验1] 先将铜片浸入盛有硫酸铜溶液
的烧杯中,观察现象;
[对比实验2] 将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片直接接触,然后浸入盛有硫酸铜溶液的烧杯中。[对比实验2]现 象: 铜片表面明显有铜析出,但电流计指
示无电流通过。 问题与思考
1、上述实验装置构成了原电池吗?
2、如果没有发生氧化还原反应,铜片表面为
什么明显有红色的铜析出,并且锌片逐渐
溶解?
3、如果实验装置就是原电池,为什么电流计
的指针又不动? [探究实验二]
将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,然后同时浸入盛有硫酸铜溶液的烧杯中。现象: 铜片表面明显有铜析出,电流计指示有电流通过。结论: 可以肯定[探究实验一]中的装置构成了原电池,其中锌为原电池的负极,铜为正极。负极: Zn - 2e- = Zn2+ (氧化反应)
正极: Cu2+ + 2e- = Cu (还原反应)电极反应为:总电池反应为:Zn + Cu2+ = Zn2+ + Cu [探究实验三]
将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,然后分别浸入盛有硫酸锌和硫酸铜溶液的烧杯中,观察现象。 为什么
?? [探究实验四]
将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,然后分别浸入盛有硫酸锌和硫酸铜溶液的烧杯中,中间用一盐桥连接,观察现象。请写出电极反应:负极: Zn - 2e- = Zn2+ (氧化反应)
正极: Cu2+ + 2e- = Cu (还原反应)总电池反应方程式为:Zn + Cu2+ = Zn2+ + Cu [探究实验五]
将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,然后分别浸入盛有硫酸锌和稀硫酸溶液(与硫酸铜溶液的浓度相同)的烧杯中,中间用一盐桥连接,观察并比较产生电流强度的大小。
练习⒈判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO4 ⑦⑥(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu⑧⑨(×)(∨)负极:正极:总反应:Fe-2e- =Fe2+2H++2e-=H2↑Fe+2H+= Fe2++H2↑或 Fe+H2SO4=FeSO4+H2↑2.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是3。试将下列两个氧化还原反应分别设计成两个原电池⑴Zn + 2AgNO3=Zn(NO3)2+2Ag⑵2Fe3++Fe=3Fe2+( D )( Zn∣AgNO3∣C )( Fe∣Fe2(SO4)3∣C )A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;请利用:Cu+2AgNO3 = Cu(NO3)2+2Ag 的反应原理,设计一个能产生电流的原电池装置,并写出两个电极上的电极反应。 课 堂 小 结
1、进一步了解原电池的工作原理;
2、能够写出电极反应式和电池反
应方程式。再 见
铜片上没变化 化学方程式:Zn+H2SO4= ZnSO4 +H2↑ 如果将铜片和锌片(不接触)用导线连接起来又会有什么现象?方程式怎么写? 动画模拟演示(微观)
注意观察问 题 二CuZnCuZnCuZnCuZnCuZnCuZnCuZn电流计发生偏转CuZn电流计发生偏转CuZn电流计发生偏转CuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZnCuZn现象:㈠锌片上不再放出气体
但是锌片不断溶解
㈡铜片上有气体放出
㈢电流计指针发生偏转
电极反应式:锌片(负极):Zn-2e -=Zn2+ (氧化反应)
铜片(正极):2H++2e-=H2 ↑ (还原反应)可观察到电流计发生偏转
说明:
此装置是一个将化学能转换成电能的装置。
我们把这种化学能转变为电能的装置叫 原电池2、原电池的两极确定失去电子的一极叫负极,用 - 表示。
得到电子的一极叫正极,用 + 表示。3、原电池两极的化学反应表示方法,
又叫电极反应。负极:(Zn ) Zn - 2e- = Zn2+ (氧化反应)
正极:(Cu ) 2H++ 2e- = H2↑ (还原反应)总反应式:综合正极和负极电极反应式而得:
Zn+ 2H+ = Zn2+ + H2↑ 原 电 池1、定义:把化学能转化为电能的装置。4、原电池的形成条件1、活动性不同的金属(其中一种可以为
非金属,即作导体用)作电极。2、两电极插入电解质溶液中。3、形成闭合回路。(两电极外线用导线
连接,可以接用电器。)构成前提:两个电极中至少有一个可以和电解质溶液自发地发生氧化还原反应. [探究实验一]
[对比实验1] 先将铜片浸入盛有硫酸铜溶液
的烧杯中,观察现象;
[对比实验2] 将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片直接接触,然后浸入盛有硫酸铜溶液的烧杯中。[对比实验2]现 象: 铜片表面明显有铜析出,但电流计指
示无电流通过。 问题与思考
1、上述实验装置构成了原电池吗?
2、如果没有发生氧化还原反应,铜片表面为
什么明显有红色的铜析出,并且锌片逐渐
溶解?
3、如果实验装置就是原电池,为什么电流计
的指针又不动? [探究实验二]
将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,然后同时浸入盛有硫酸铜溶液的烧杯中。现象: 铜片表面明显有铜析出,电流计指示有电流通过。结论: 可以肯定[探究实验一]中的装置构成了原电池,其中锌为原电池的负极,铜为正极。负极: Zn - 2e- = Zn2+ (氧化反应)
正极: Cu2+ + 2e- = Cu (还原反应)电极反应为:总电池反应为:Zn + Cu2+ = Zn2+ + Cu [探究实验三]
将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,然后分别浸入盛有硫酸锌和硫酸铜溶液的烧杯中,观察现象。 为什么
?? [探究实验四]
将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,然后分别浸入盛有硫酸锌和硫酸铜溶液的烧杯中,中间用一盐桥连接,观察现象。请写出电极反应:负极: Zn - 2e- = Zn2+ (氧化反应)
正极: Cu2+ + 2e- = Cu (还原反应)总电池反应方程式为:Zn + Cu2+ = Zn2+ + Cu [探究实验五]
将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,然后分别浸入盛有硫酸锌和稀硫酸溶液(与硫酸铜溶液的浓度相同)的烧杯中,中间用一盐桥连接,观察并比较产生电流强度的大小。
练习⒈判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO4 ⑦⑥(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu⑧⑨(×)(∨)负极:正极:总反应:Fe-2e- =Fe2+2H++2e-=H2↑Fe+2H+= Fe2++H2↑或 Fe+H2SO4=FeSO4+H2↑2.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是3。试将下列两个氧化还原反应分别设计成两个原电池⑴Zn + 2AgNO3=Zn(NO3)2+2Ag⑵2Fe3++Fe=3Fe2+( D )( Zn∣AgNO3∣C )( Fe∣Fe2(SO4)3∣C )A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;请利用:Cu+2AgNO3 = Cu(NO3)2+2Ag 的反应原理,设计一个能产生电流的原电池装置,并写出两个电极上的电极反应。 课 堂 小 结
1、进一步了解原电池的工作原理;
2、能够写出电极反应式和电池反
应方程式。再 见
