摩尔质量
图片预览







文档简介
课件21张PPT。摩尔质量复习:什么是物质的量?
什么是摩尔?
什么是阿伏加德罗常数?
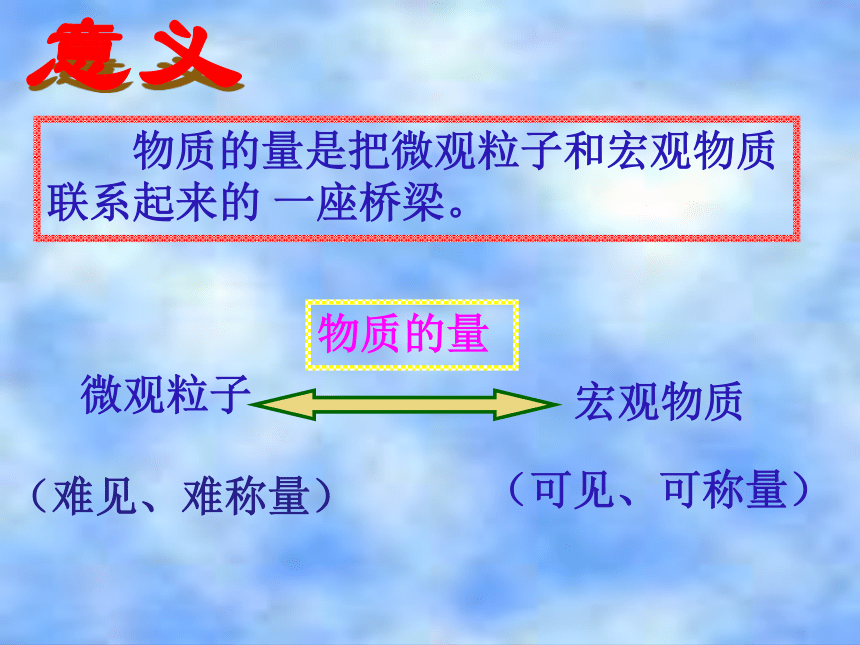
你是如何理解这三个概念的?意义 物质的量是把微观粒子和宏观物质联系起来的 一座桥梁。(难见、难称量)微观粒子宏观物质(可见、可称量)物质的量微粒数
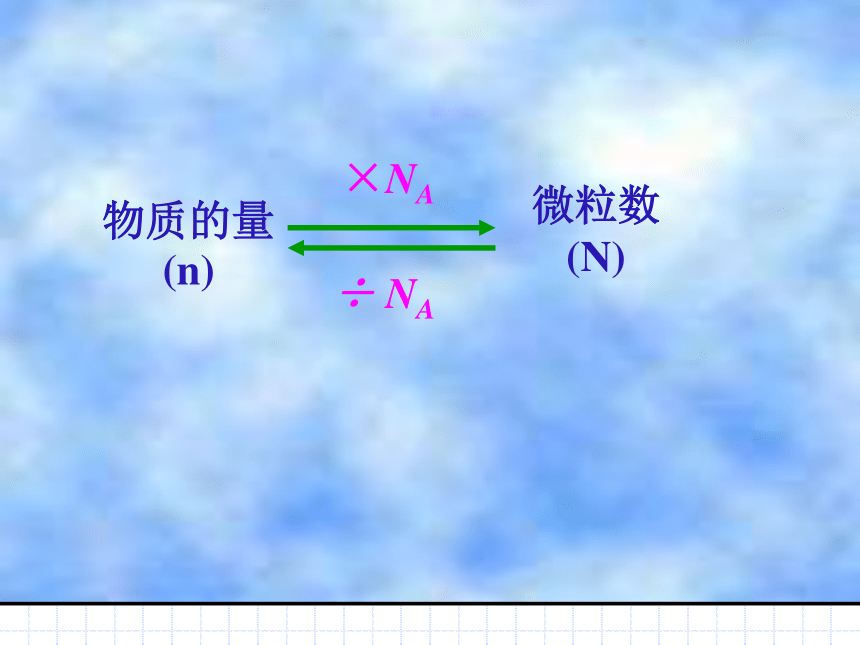
(N) ×NA ÷ NA物质的量(n) 在0.5molO2中含有的氧分子数目是多少?解:O2的分子数为N = n × NA = 3.01 × 1023 答:O2的分子数为3.01 × 1023个.[例题一]=0.5 mol× 6.02 ×1023mol-1在0.5molO2中含有的氧原子数目是多少?解:O2的氧原子数为N = n ×2 × NA =0.5 mol×2× 6.02 ×1023mol-1
= 6.02 × 1023 答:O2的氧原子数为6.02 × 1023个。[例题二]在0.5molO2中含有的电子数目是多少?
解:O2的电子数为N = n ×16 × NA = 4.816 × 1024 答:0.5molO2的电子数为4.816 × 1024个。[例题三]=0.5 mol×16× 6.02 ×1023mol-1【课堂练习】
1. 下列数量的各物质中,含原子个数最多的是( ) A.1mol HCl B.3.01 x 1023 个碘分子 C.12g 12C D.0.5mol CH4
2. 与0.3 mol H2O 含有相同氢原子数的是( )
A. 0.3 mol HNO3 B. 3.612 X 10 23个 HNO3分子 C. 0.2 mol H3PO4 D. 0.1mol NH3课堂练习1、某硫酸钠溶液中含3.01×1022个Na+,则该溶液中SO42-的物质的量是( ) 0.025mol2、0.5molNH3中所含的原子数为( )1.204 × 1024所含的质子数为( )3.01 × 1024课堂练习3、已知amolClO2分子中含有b个e-(电子)则阿伏加德罗常数可表示为( )b/33amol-1【思考】1molC-12的质量是多少?1mol其他物质的质量又是多少呢? 1mol任何物质都约含有6.02X1023个粒子,那么这1mol物质的质量到底有多大?NANANA125698NANANA182317分析以上计算结果可得出什么规律?(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。二、摩尔质量1、1mol物质的质量:
1mol任何微粒或物质的质量在以克为单位时,数值上等于该微粒的相对原子质量或相对分子质量。课堂练习:1、填空:
(1)1molCu质量是 克
(2)1molO2质量是 克
(3) 1molCO2质量是 克
(4) 1molCl-质量是 克
(5) 1molNa+质量是 克
(6) 1molNaCl质量是 克64324435.52358.52、摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。
(2)符号:M
(3)单位:g/mol(或kg/mol)
(4)数值: (当单位为 g/mol )等于物质或粒子的式量(5)物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系: 两个变式:
m=n?M(6)物质的量、摩尔质量、物质的质量;阿伏加得罗常数、 6.02X1023等之间的区别。课堂练习:(1)O2的摩尔质量是多少?
(2)H2SO4的摩尔质量是多少?
(3)100molH2O的质量是多少克?
(4)0.1molOH-的质量是多少克?
(5)34gNH3的物质的量是多少?32g.mol-198g.mol-11800g1.7g2mol小结:物质的量的意义:是联系宏观和微观的纽带或桥梁。表达式:
什么是摩尔?
什么是阿伏加德罗常数?
你是如何理解这三个概念的?意义 物质的量是把微观粒子和宏观物质联系起来的 一座桥梁。(难见、难称量)微观粒子宏观物质(可见、可称量)物质的量微粒数
(N) ×NA ÷ NA物质的量(n) 在0.5molO2中含有的氧分子数目是多少?解:O2的分子数为N = n × NA = 3.01 × 1023 答:O2的分子数为3.01 × 1023个.[例题一]=0.5 mol× 6.02 ×1023mol-1在0.5molO2中含有的氧原子数目是多少?解:O2的氧原子数为N = n ×2 × NA =0.5 mol×2× 6.02 ×1023mol-1
= 6.02 × 1023 答:O2的氧原子数为6.02 × 1023个。[例题二]在0.5molO2中含有的电子数目是多少?
解:O2的电子数为N = n ×16 × NA = 4.816 × 1024 答:0.5molO2的电子数为4.816 × 1024个。[例题三]=0.5 mol×16× 6.02 ×1023mol-1【课堂练习】
1. 下列数量的各物质中,含原子个数最多的是( ) A.1mol HCl B.3.01 x 1023 个碘分子 C.12g 12C D.0.5mol CH4
2. 与0.3 mol H2O 含有相同氢原子数的是( )
A. 0.3 mol HNO3 B. 3.612 X 10 23个 HNO3分子 C. 0.2 mol H3PO4 D. 0.1mol NH3课堂练习1、某硫酸钠溶液中含3.01×1022个Na+,则该溶液中SO42-的物质的量是( ) 0.025mol2、0.5molNH3中所含的原子数为( )1.204 × 1024所含的质子数为( )3.01 × 1024课堂练习3、已知amolClO2分子中含有b个e-(电子)则阿伏加德罗常数可表示为( )b/33amol-1【思考】1molC-12的质量是多少?1mol其他物质的质量又是多少呢? 1mol任何物质都约含有6.02X1023个粒子,那么这1mol物质的质量到底有多大?NANANA125698NANANA182317分析以上计算结果可得出什么规律?(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。二、摩尔质量1、1mol物质的质量:
1mol任何微粒或物质的质量在以克为单位时,数值上等于该微粒的相对原子质量或相对分子质量。课堂练习:1、填空:
(1)1molCu质量是 克
(2)1molO2质量是 克
(3) 1molCO2质量是 克
(4) 1molCl-质量是 克
(5) 1molNa+质量是 克
(6) 1molNaCl质量是 克64324435.52358.52、摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。
(2)符号:M
(3)单位:g/mol(或kg/mol)
(4)数值: (当单位为 g/mol )等于物质或粒子的式量(5)物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系: 两个变式:
m=n?M(6)物质的量、摩尔质量、物质的质量;阿伏加得罗常数、 6.02X1023等之间的区别。课堂练习:(1)O2的摩尔质量是多少?
(2)H2SO4的摩尔质量是多少?
(3)100molH2O的质量是多少克?
(4)0.1molOH-的质量是多少克?
(5)34gNH3的物质的量是多少?32g.mol-198g.mol-11800g1.7g2mol小结:物质的量的意义:是联系宏观和微观的纽带或桥梁。表达式:
