气体摩尔体积
图片预览








文档简介
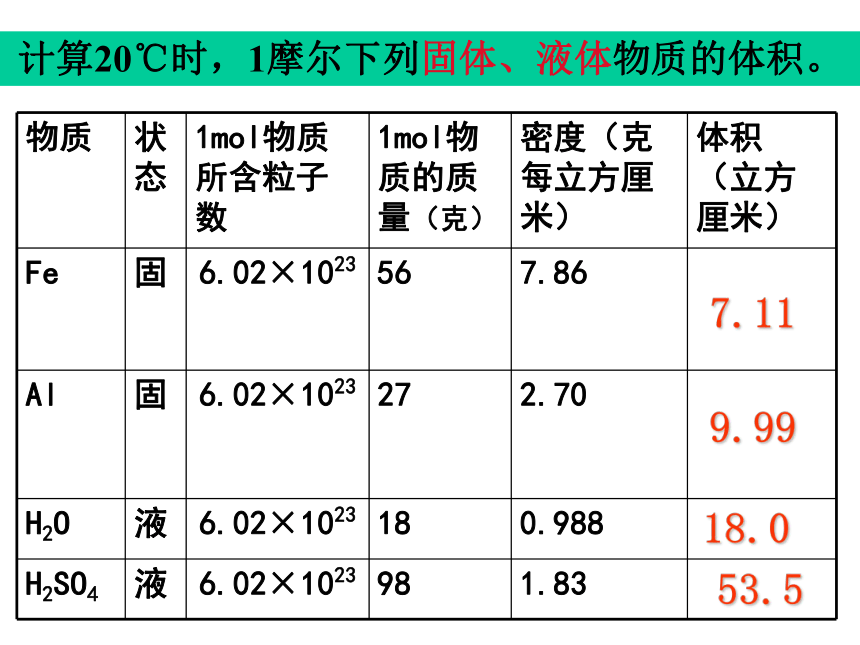
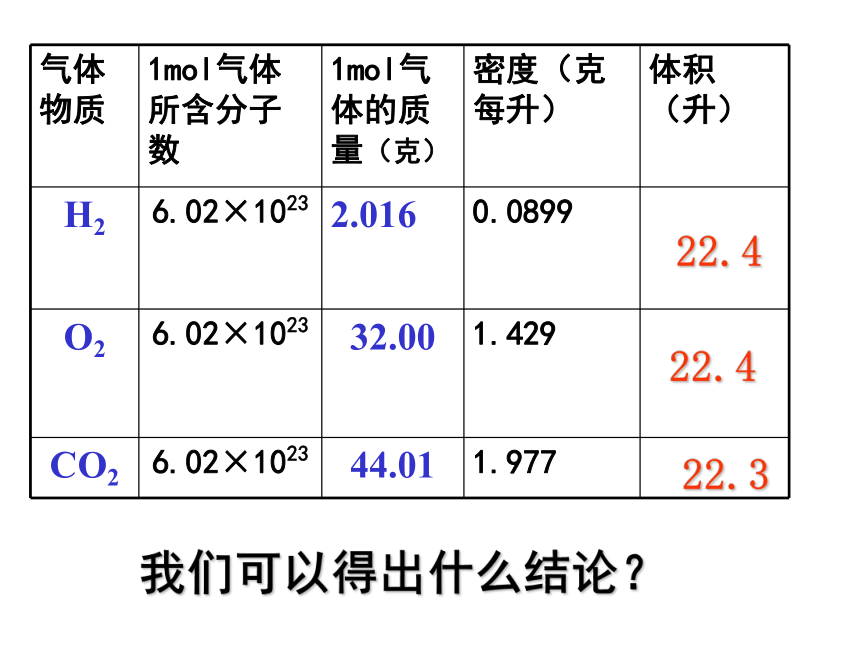
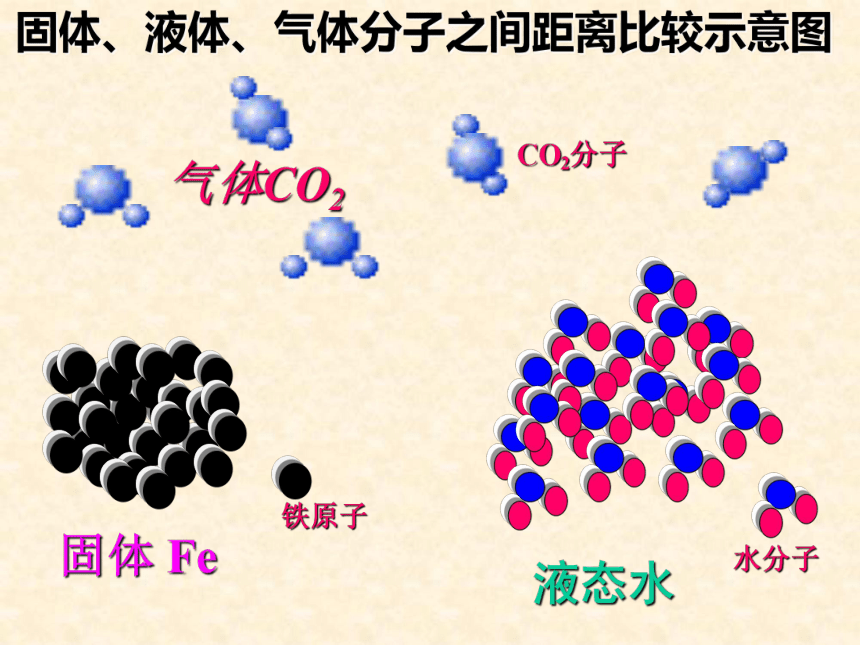
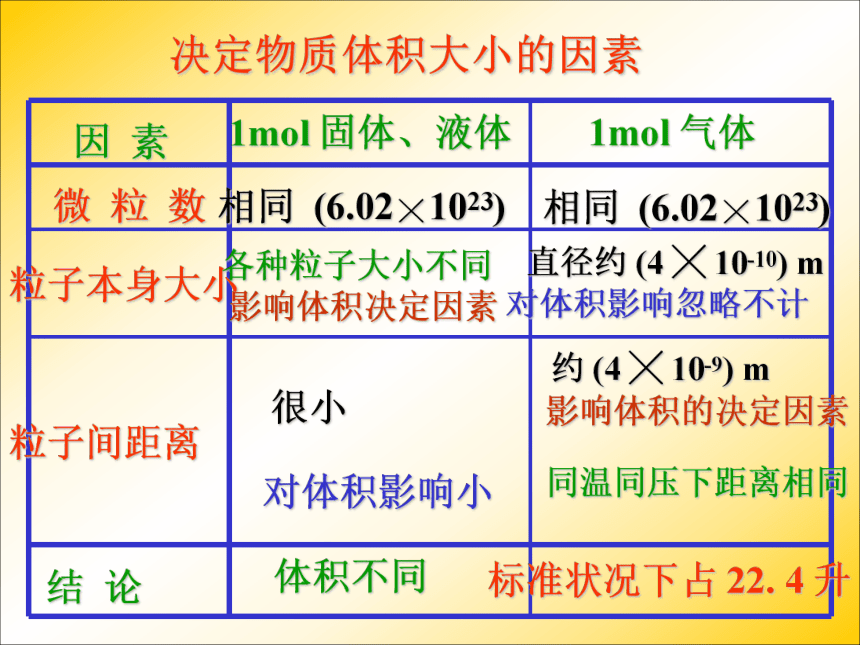
课件36张PPT。气体摩尔体积温故而知新1、n= ?2、什么是摩尔质量?3、0.25mol CO2与多少克水所含的分子数相等? 只要物质的量相同,组成物质的粒子数一定相同,那么物质所具有的体积会相同吗?思考计算20℃时,1摩尔下列固体、液体物质的体积。7.1153.518.09.99[结论]不相同相同条件下,1摩尔不同固体或液体物质的体积相同吗 ? [讨论] 对于1mol不同的固体和液体物质,为什么它们的体积各不相同呢?决定物质体积大小的因素有哪些呢?物质体积大小是宏观表现出来的,我们可以从微观角度去寻找原因?①粒子的数目②粒子的大小③粒子间的间隔 固体、液体物质粒子间的间隔很小,在粒子数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。决定物质体积大小的因素有三个:结论 相同条件(标准状况)下,1摩尔气体的体积是否相同呢?填写下列表格。(标准状况:温度为0℃,压强为101KPa)思考22.422.422.3我们可以得出什么结论? 请思考: 为什么1mol固体和液体体积不同,而1mol任何气体的体积却相同?在标准状况下,1mol任何气体所占的体积都约是22.4L。固体 Fe液态水铁原子水分子气体CO2CO2分子固体、液体、气体分子之间距离比较示意图因 素1mol 固体、液体1mol 气体微 粒 数粒子本身大小粒子间距离结 论 相同 (6.02 ╳ 1023)影响体积决定因素影响体积的决定因素对体积影响忽略不计对体积影响小各种粒子大小不同直径约 (4 ╳ 10-10) m约 (4 ╳ 10-9) m很小同温同压下距离相同体积不同标准状况下占 22. 4 升决定物质体积大小的因素 相同 (6.02 ╳ 1023)气体摩尔体积定义:单位物质的量的气体所占的体积叫做气体摩尔体积。用 Vm 表示。 单位: 升 / 摩 符号: L/mol 或 L. mol -1 在标准状况下,任何气体的摩尔体积都约为 22. 4 L. mol -1 气体摩尔体积适用条件:标准状况注
意物质的量:1mol研究对象:任何气体,可以是
纯净气体,也可以是混和气体。22.4升/摩尔是一个近似值。1. 下列说法是否正确 ?为什么?
(1)标准状况下任何气体的体积都约是 22.4 L
(2)1 摩尔二氧化碳占有的体积约为 22.4 L
(3) 1 摩尔水在标准状况下的体积约为 22.4 L
说法错误。因未指明气体物质的量。 说法错误。因未指明气体所处的状况。说法错误。 因水在标准状况下不是气体。
(4)1 摩尔二氧化硫在20 oC 时的体积比 22.4 L 大
(5)1 摩尔氯化氢在(3.03 ╳ 105)Pa 时的体积比 22.4 L 小 说法错误。 因忽略了压强的影响。 说法错误。 因忽略了温度的影响。 填空(1)标准状况下,0.5mol H2 占有的体积是 L。 11.2(2)标准状况下,2 mol O2 占有的体积是 L。 44.8(3)标准状况下,4.48L CO2 的物质的量是 mol。 0.2(4)标准状况下,33.6L H2 的物质的量是 mol。 1.5物质的量(摩)= 标准状况下气体体积(升)气体摩尔体积(升/摩)符号表示: n = V/Vm 阿伏加德罗定律 在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。适用对象:任何气体注
意适用条件:同温、同压、同体积 结论:分子数目相同,即气体物质的量相同。是阿伏加德罗定律的一个特例。标准状况下气体摩尔体积22. 4 L. mol -1 P V= n R T克拉伯龙方程气体压强气体体积气体物质的量气体常数(开尔文)绝对温度阿伏加德罗定律的推论:(1) 同温同压下,气体体积、分子数、 物质的量成正比关系。 (2) 同温同压下,气体密度和摩尔质量成正比关系。 在 H2 + Cl2 = 2 HCl 反应中,各物质
的系数表示什么意义?表示三种物质的分子数之比为 1:1:2表示三种物质的物质的量之比为 1:1:2表示三种物质(气体)的体积比为 1:1:2小结提升气体摩尔体积定义:单位物质的量的气体所占的体积叫做气体摩尔体积。用 Vm 表示。 单位: 升 / 摩 符号: L/mol 或 L. mol -1 在标准状况下,任何气体的摩尔体积都约为 22. 4 L. mol -1 同温同压同体积任何气体所含分子数相同。 推论1:同温同压下,气体体积比等于分子数比,等于物质的量比。 推论2:同温同压下,气体密度比等于摩尔质量比。阿伏加德罗定律的推论:知 识 归 纳 物质的量微粒数 NANAMM质量
气体体积 (标准状况)VmM 摩尔质量NA 阿伏加德罗常数Vm 气体摩尔体积d 气体密度 下列说法是否正确 ?为什么?
(1)1L N2 和 1L O2 在同温同压下所含分子数相同。
(2) 1g N2 和 1g O2所含分子数相同。
(3) 1mol N2 和 1mol O2 所占体积相同。
(4) 在常温常压下,28g N2 和 1mol O2 所含分子数相同。
(5) 1mol N2 和 1mol O2 在标准状况下混合,体积约为44.8L。说法正确。同温同压同体积气体所含分子数相同 说法错误。两种气体物质的量不同。说法错误。 未指明气体所处状态。 说法正确。 物质的量相同的物质所含微粒数相同。 说法正确。 混合后气体的物质的量为 2mol。 练习: [练习 ] 两个体积相同的容器,一个盛有一氧化氮,
另一个盛有氮气和氧气。在同温同压下两容器内的气体一定具
有相同的是 ( )
(A)原子总数 (B)质子总数
(C)分子总数 (D)质量分析: 同温同压下,同体积的两种气体所含分子总数相同。AC N2 和 O2 都是双原子分子,只要其总物质的量不变,
无论 N2 和 O2 的物质的量各是多少,总原子数都不变。
NO 也是双原子分子,故由两容器中分子总数相同可推知
A正确。[例 1] 5. 5克氨在标准状况时体积是多少?解: 氨的式量是17,氨的摩尔质量是 17g/mol 。n (NH3) = 5. 5g17g/mol= 0. 32 mol答:5. 5氨在标准状况时的体积是7. 2LV(NH3) =22. 4L/mol ╳ 0. 32mol = 7. 2L [练习 1] 标准状况下,5. 6LCO2中含有多少摩尔
CO2分子?约含有多少个CO2分子? 它的质量是多少?
1个 CO2 的质量是多少克?解: CO2的式量是44,CO2的摩尔质量是 44g/mol 。n (CO2) = 5. 6 L22. 4L/mol= 0. 25 mol答:(略)N (CO2) =0. 25mol ╳6.02 ╳ 1023 /mol =1.51 ╳1023m (CO2) = 0. 25 mol ╳ 44g/mol = 11 g1个CO2 分子的质量 = 44g/(6.02 ╳ 1023)= 7.31 ╳10-23g [例 2] 在实验室里使稀盐酸跟锌起反应,在标准状
况时生成 3. 36L氢气,计算需要多少摩的 HCl 和 Zn?解:1mol1mol : x = 22. 4L : 3. 36L 设需要Zn的物质的量为x , 需要HCl的物质的量为 y Zn + 2HCl = ZnCl2 + H22mol22. 4Lxx = 0. 15mol答:需0.15 mol Zn 和 0.30 mol HCly3. 36L2mol : y = 22. 4L : 3. 36L y = 0. 30mol [练习 2] 用 0.1mol Zn 与足量稀硫酸反应,生成的氢气在
标准状下的体积是多少?产生的氢气最多能还原CuO多少克?解:1mol1mol : 0.1mol = 22. 4L : x 设生成的 H2 在标准状况下的体积为 x , 被还原的 CuO质量为 y Zn + H2SO4 = ZnSO4 + H2 22. 4L80g0. 1molx = 2. 24L答:产生 H2 2.24L,最多能还原 CuO 8g。xy1mol : 0.1mol = 80g : y y = 8g H2 + CuO = H2O + Cu气体摩尔质量 = 气体质量气体物质的量 = 气体质量气体体积 / 气体摩尔体积对在标准状况的气体来说= 气体密度 ╳ 气体摩尔体积 [例 3] 在标准状况时, 0. 2 L的容器里所含一氧化
碳的质量为 0. 25g , 计算一氧化碳的式量。解:= 28g /mol思路:一氧化碳摩尔质量的数值等于它的式量。= 0.25g0.2L22. 4 L/mol 答:一氧化碳的的式量为 28。 一氧化碳的摩尔质量 [ 练习 4 ] 在标准状况时, 2. 24 L NOx 气体的质量为 4.6g , 求气体的化学式。解:= 46g /mol= 4. 6g2.24L22. 4 L/mol 答:气体的化学式为 NO2 。 M ( NOx )NOx 的分子量为 4614 + 16x = 46 x = 2 *[练习5] 已知空气中氮气和氧气的体积比为4:1;求空气的平均相对分子质量。气体摩尔质量 = 气体总质量气体总物质的量解: =M1n1+ M2n2n总=M1.n1%+ M2.n2%=M1.V1%+ M2.V2%=28g ╳ 4/5+ 32g ╳ 1/5= 28.8 g.mol-1答:空气的平均相对分子质量为28.8。
意物质的量:1mol研究对象:任何气体,可以是
纯净气体,也可以是混和气体。22.4升/摩尔是一个近似值。1. 下列说法是否正确 ?为什么?
(1)标准状况下任何气体的体积都约是 22.4 L
(2)1 摩尔二氧化碳占有的体积约为 22.4 L
(3) 1 摩尔水在标准状况下的体积约为 22.4 L
说法错误。因未指明气体物质的量。 说法错误。因未指明气体所处的状况。说法错误。 因水在标准状况下不是气体。
(4)1 摩尔二氧化硫在20 oC 时的体积比 22.4 L 大
(5)1 摩尔氯化氢在(3.03 ╳ 105)Pa 时的体积比 22.4 L 小 说法错误。 因忽略了压强的影响。 说法错误。 因忽略了温度的影响。 填空(1)标准状况下,0.5mol H2 占有的体积是 L。 11.2(2)标准状况下,2 mol O2 占有的体积是 L。 44.8(3)标准状况下,4.48L CO2 的物质的量是 mol。 0.2(4)标准状况下,33.6L H2 的物质的量是 mol。 1.5物质的量(摩)= 标准状况下气体体积(升)气体摩尔体积(升/摩)符号表示: n = V/Vm 阿伏加德罗定律 在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。适用对象:任何气体注
意适用条件:同温、同压、同体积 结论:分子数目相同,即气体物质的量相同。是阿伏加德罗定律的一个特例。标准状况下气体摩尔体积22. 4 L. mol -1 P V= n R T克拉伯龙方程气体压强气体体积气体物质的量气体常数(开尔文)绝对温度阿伏加德罗定律的推论:(1) 同温同压下,气体体积、分子数、 物质的量成正比关系。 (2) 同温同压下,气体密度和摩尔质量成正比关系。 在 H2 + Cl2 = 2 HCl 反应中,各物质
的系数表示什么意义?表示三种物质的分子数之比为 1:1:2表示三种物质的物质的量之比为 1:1:2表示三种物质(气体)的体积比为 1:1:2小结提升气体摩尔体积定义:单位物质的量的气体所占的体积叫做气体摩尔体积。用 Vm 表示。 单位: 升 / 摩 符号: L/mol 或 L. mol -1 在标准状况下,任何气体的摩尔体积都约为 22. 4 L. mol -1 同温同压同体积任何气体所含分子数相同。 推论1:同温同压下,气体体积比等于分子数比,等于物质的量比。 推论2:同温同压下,气体密度比等于摩尔质量比。阿伏加德罗定律的推论:知 识 归 纳 物质的量微粒数 NANAMM质量
气体体积 (标准状况)VmM 摩尔质量NA 阿伏加德罗常数Vm 气体摩尔体积d 气体密度 下列说法是否正确 ?为什么?
(1)1L N2 和 1L O2 在同温同压下所含分子数相同。
(2) 1g N2 和 1g O2所含分子数相同。
(3) 1mol N2 和 1mol O2 所占体积相同。
(4) 在常温常压下,28g N2 和 1mol O2 所含分子数相同。
(5) 1mol N2 和 1mol O2 在标准状况下混合,体积约为44.8L。说法正确。同温同压同体积气体所含分子数相同 说法错误。两种气体物质的量不同。说法错误。 未指明气体所处状态。 说法正确。 物质的量相同的物质所含微粒数相同。 说法正确。 混合后气体的物质的量为 2mol。 练习: [练习 ] 两个体积相同的容器,一个盛有一氧化氮,
另一个盛有氮气和氧气。在同温同压下两容器内的气体一定具
有相同的是 ( )
(A)原子总数 (B)质子总数
(C)分子总数 (D)质量分析: 同温同压下,同体积的两种气体所含分子总数相同。AC N2 和 O2 都是双原子分子,只要其总物质的量不变,
无论 N2 和 O2 的物质的量各是多少,总原子数都不变。
NO 也是双原子分子,故由两容器中分子总数相同可推知
A正确。[例 1] 5. 5克氨在标准状况时体积是多少?解: 氨的式量是17,氨的摩尔质量是 17g/mol 。n (NH3) = 5. 5g17g/mol= 0. 32 mol答:5. 5氨在标准状况时的体积是7. 2LV(NH3) =22. 4L/mol ╳ 0. 32mol = 7. 2L [练习 1] 标准状况下,5. 6LCO2中含有多少摩尔
CO2分子?约含有多少个CO2分子? 它的质量是多少?
1个 CO2 的质量是多少克?解: CO2的式量是44,CO2的摩尔质量是 44g/mol 。n (CO2) = 5. 6 L22. 4L/mol= 0. 25 mol答:(略)N (CO2) =0. 25mol ╳6.02 ╳ 1023 /mol =1.51 ╳1023m (CO2) = 0. 25 mol ╳ 44g/mol = 11 g1个CO2 分子的质量 = 44g/(6.02 ╳ 1023)= 7.31 ╳10-23g [例 2] 在实验室里使稀盐酸跟锌起反应,在标准状
况时生成 3. 36L氢气,计算需要多少摩的 HCl 和 Zn?解:1mol1mol : x = 22. 4L : 3. 36L 设需要Zn的物质的量为x , 需要HCl的物质的量为 y Zn + 2HCl = ZnCl2 + H22mol22. 4Lxx = 0. 15mol答:需0.15 mol Zn 和 0.30 mol HCly3. 36L2mol : y = 22. 4L : 3. 36L y = 0. 30mol [练习 2] 用 0.1mol Zn 与足量稀硫酸反应,生成的氢气在
标准状下的体积是多少?产生的氢气最多能还原CuO多少克?解:1mol1mol : 0.1mol = 22. 4L : x 设生成的 H2 在标准状况下的体积为 x , 被还原的 CuO质量为 y Zn + H2SO4 = ZnSO4 + H2 22. 4L80g0. 1molx = 2. 24L答:产生 H2 2.24L,最多能还原 CuO 8g。xy1mol : 0.1mol = 80g : y y = 8g H2 + CuO = H2O + Cu气体摩尔质量 = 气体质量气体物质的量 = 气体质量气体体积 / 气体摩尔体积对在标准状况的气体来说= 气体密度 ╳ 气体摩尔体积 [例 3] 在标准状况时, 0. 2 L的容器里所含一氧化
碳的质量为 0. 25g , 计算一氧化碳的式量。解:= 28g /mol思路:一氧化碳摩尔质量的数值等于它的式量。= 0.25g0.2L22. 4 L/mol 答:一氧化碳的的式量为 28。 一氧化碳的摩尔质量 [ 练习 4 ] 在标准状况时, 2. 24 L NOx 气体的质量为 4.6g , 求气体的化学式。解:= 46g /mol= 4. 6g2.24L22. 4 L/mol 答:气体的化学式为 NO2 。 M ( NOx )NOx 的分子量为 4614 + 16x = 46 x = 2 *[练习5] 已知空气中氮气和氧气的体积比为4:1;求空气的平均相对分子质量。气体摩尔质量 = 气体总质量气体总物质的量解: =M1n1+ M2n2n总=M1.n1%+ M2.n2%=M1.V1%+ M2.V2%=28g ╳ 4/5+ 32g ╳ 1/5= 28.8 g.mol-1答:空气的平均相对分子质量为28.8。
