物质的分散系
图片预览








文档简介
课件27张PPT。物质的分散系
胶体、电解质和非电解质
思考:1.将5g的食盐溶于100ml水中,
将得到什么?
2.将5g泥土盐溶于100ml水中,
将得到什么?
3.将5g植物油盐溶于100ml水中,
将得到什么?
请同学们分 析 :这三个过程的共同点是什么 呢?根据此方法,阅读教材P13,请归纳分散系的概念,什么是分散系?1.分散系:把一种(或多种)物质分散在另一种(或
多种)物质中所形成的混合物。
▲分散质:能分散到另一种物质中去的物质。▲分散剂:被分散到其中的物质。
一.物质的分散系思 考:同学们日常生活中碰到的分散系
有哪些呢?它们是否属于同种分散系呢?糖水、酒精的水溶液、泥浆水、牛奶、 雾等.不属于
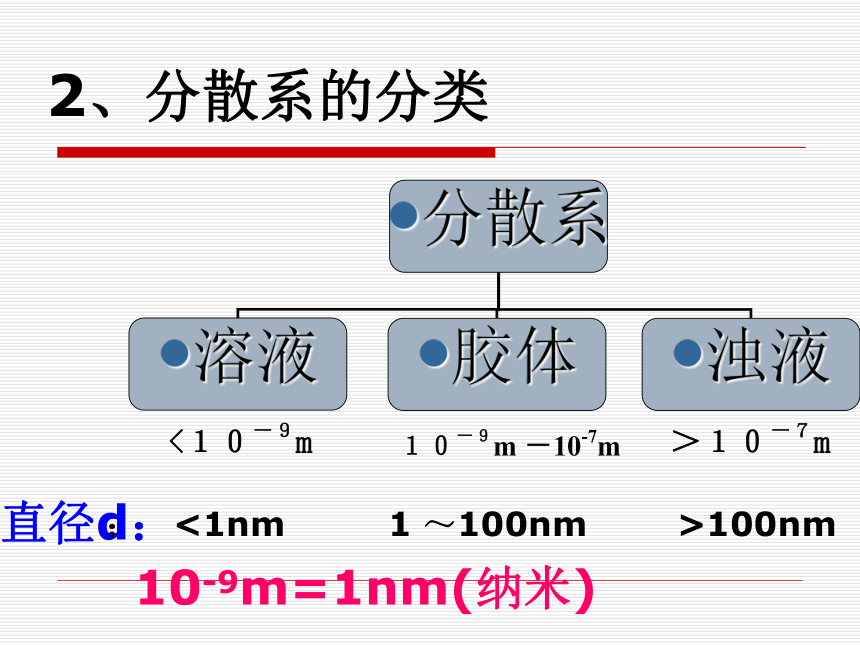
2、分散系的分类<10-9m10-9m -10-7m>10-7m直径d:
: <1nm 1 ~100nm >100nm10-9m=1nm(纳米)3.胶体的性质与应用演示P14页【实验1】和【实验 2】根据实验现象思考:
1.如何用简便的方法鉴别胶体和溶液?
2.氢氧化铁胶体常用来净水,为什么?胶体与溶液的区别:CuSO4溶液 Fe(OH)3胶体丁达尔效应:光束通过胶体时出现一条明亮的光路的
现象。(可用来鉴别溶液和胶体)
◆为什么浊液及溶液没有丁达尔效应?
溶液里溶质粒子太小,散射很微弱,观察不到丁达尔效应浊液分散质粒子直径太大,反射而不散射1 、粒子直径大于入射光波长很多倍时,发生光的反 射
2 、粒子直径接近入射光的波长时,发生光的散射.浊液分散系粒子直径>100nm胶体分散系1nm<粒子直径<100nm溶液分散系粒子直径<1nm思考:为什么胶体有丁达尔效应溶液没有? 氢氧化铁胶体净水的原因:胶体能够使水中的悬浮的固体颗粒凝聚而沉降下来,具有凝聚作用,因此,氢氧化铁胶体可以用来净水。
日常生活中我们常用来净水的是KAl(SO4)2·12H2O(十二水硫酸铝钾),俗称明矾,溶于水可形成Al(OH)3胶体, Al(OH)3具有很好的凝聚作用,是一种良好的净水剂。所有可溶性铝盐都可以作净水剂。胶体、溶液、浊液三种分散系的比较
稳定,均 一较稳定,均一不稳定,不均一否是否 电解质和非电解质在五只小烧杯中分别加入NaCl溶液、NaOH溶液、
稀盐酸、酒精溶液和蔗糖溶液,组装好仪器,接通电 源。结论:
1.NaCl固体、酒精溶液、蔗糖溶液不导电
2.NaCl溶液、稀H2SO4、NaOH 溶液能导电
?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?干燥的氯化钠晶体中没有能够自由移动的粒子?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?氯化钠溶于水后,产生了自由移动的Na+和Cl-?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢? 在氯化钠溶液中接通直流电源后, Na+向阴极移动,Cl-向阳极移动,带电粒子的定向移动就形成了电流,因此氯化钠的水溶液能够导电。1.定义:
电解质—— 在水溶液里或熔融状 态下 能导电的化合物叫做电解质。非电解质 ——在水溶液里和熔融状态下均
不能导电的化合物叫做非电解质。2.电离:电解质在水溶液里或熔融状态下
产生自由移动的离子的过程。电解质和非电解质练习1:⑴硫酸 ⑵蔗糖 ⑶氨 ⑷HNO3
⑸NH3·H2O ⑹锌粒 ⑺NH4Cl ⑻乙醇
⑼石墨 ⑽Ca(OH)2 ⑾H3PO4 ⑿Na2O
判断上述物质中属于非电解质的是_________。
属于电解质的是______。
2、 3、 81 、4 、 5 、7、 10 、11、 12讨论:1:判断一个物质是否是电解质的依据是什么?2:判断SO2、Cl2、NH3、盐酸是否是电解质?3:电解质在水溶液中和熔融状态下都能导电?4:氧化钠溶于水能导电,所以它是电解质。5:固体氯化钠不导电,所以它不是电解质?3.电解质和非电解质的理解◆电解质和非电解质都是指化合物,单质和溶液不是.
◆电解质必须是化合物本身能电离出离子而导.电.如:CO2,SO2溶于水能导电,但它们不是电解质,而是非电解质.
◆某些难溶于水的盐也是电解质.如:BaSO4 AgCl
◆酸,碱,盐,水是电解质,蔗糖,酒精,葡萄糖等是非电解质电离方程式书写的方法:4、检验“=”两边是否守恒(质量、电荷)1、写出化学式2、阳离子,阴离子——离子所带的电荷与相应的化合价相同3、阴、阳离子前面配上系数——阴、阳离子所带的电荷总数相等NaCl=Na++Cl-H2SO4=2H++SO42-NaOH=Na++OH-▲盐:电离时产生的金属阳离子和酸根阴离子的化合物◆比较酸碱盐的电离方程式,比较酸碱盐电离的特点。▲酸:电离时产生的阳离子全部是H+▲碱:电离时产生的阴离子全部是OH-思考:酸碱盐溶液中存在自由移动的离子,那么溶液是否呈电性?溶液呈中性,因为任何溶液中阴离子所带的负电荷总数与阳离子所带的正电荷总数相等作业:
P16 6、9
胶体、电解质和非电解质
思考:1.将5g的食盐溶于100ml水中,
将得到什么?
2.将5g泥土盐溶于100ml水中,
将得到什么?
3.将5g植物油盐溶于100ml水中,
将得到什么?
请同学们分 析 :这三个过程的共同点是什么 呢?根据此方法,阅读教材P13,请归纳分散系的概念,什么是分散系?1.分散系:把一种(或多种)物质分散在另一种(或
多种)物质中所形成的混合物。
▲分散质:能分散到另一种物质中去的物质。▲分散剂:被分散到其中的物质。
一.物质的分散系思 考:同学们日常生活中碰到的分散系
有哪些呢?它们是否属于同种分散系呢?糖水、酒精的水溶液、泥浆水、牛奶、 雾等.不属于
2、分散系的分类<10-9m10-9m -10-7m>10-7m直径d:
: <1nm 1 ~100nm >100nm10-9m=1nm(纳米)3.胶体的性质与应用演示P14页【实验1】和【实验 2】根据实验现象思考:
1.如何用简便的方法鉴别胶体和溶液?
2.氢氧化铁胶体常用来净水,为什么?胶体与溶液的区别:CuSO4溶液 Fe(OH)3胶体丁达尔效应:光束通过胶体时出现一条明亮的光路的
现象。(可用来鉴别溶液和胶体)
◆为什么浊液及溶液没有丁达尔效应?
溶液里溶质粒子太小,散射很微弱,观察不到丁达尔效应浊液分散质粒子直径太大,反射而不散射1 、粒子直径大于入射光波长很多倍时,发生光的反 射
2 、粒子直径接近入射光的波长时,发生光的散射.浊液分散系粒子直径>100nm胶体分散系1nm<粒子直径<100nm溶液分散系粒子直径<1nm思考:为什么胶体有丁达尔效应溶液没有? 氢氧化铁胶体净水的原因:胶体能够使水中的悬浮的固体颗粒凝聚而沉降下来,具有凝聚作用,因此,氢氧化铁胶体可以用来净水。
日常生活中我们常用来净水的是KAl(SO4)2·12H2O(十二水硫酸铝钾),俗称明矾,溶于水可形成Al(OH)3胶体, Al(OH)3具有很好的凝聚作用,是一种良好的净水剂。所有可溶性铝盐都可以作净水剂。胶体、溶液、浊液三种分散系的比较
稳定,均 一较稳定,均一不稳定,不均一否是否 电解质和非电解质在五只小烧杯中分别加入NaCl溶液、NaOH溶液、
稀盐酸、酒精溶液和蔗糖溶液,组装好仪器,接通电 源。结论:
1.NaCl固体、酒精溶液、蔗糖溶液不导电
2.NaCl溶液、稀H2SO4、NaOH 溶液能导电
?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?干燥的氯化钠晶体中没有能够自由移动的粒子?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?氯化钠溶于水后,产生了自由移动的Na+和Cl-?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢? 在氯化钠溶液中接通直流电源后, Na+向阴极移动,Cl-向阳极移动,带电粒子的定向移动就形成了电流,因此氯化钠的水溶液能够导电。1.定义:
电解质—— 在水溶液里或熔融状 态下 能导电的化合物叫做电解质。非电解质 ——在水溶液里和熔融状态下均
不能导电的化合物叫做非电解质。2.电离:电解质在水溶液里或熔融状态下
产生自由移动的离子的过程。电解质和非电解质练习1:⑴硫酸 ⑵蔗糖 ⑶氨 ⑷HNO3
⑸NH3·H2O ⑹锌粒 ⑺NH4Cl ⑻乙醇
⑼石墨 ⑽Ca(OH)2 ⑾H3PO4 ⑿Na2O
判断上述物质中属于非电解质的是_________。
属于电解质的是______。
2、 3、 81 、4 、 5 、7、 10 、11、 12讨论:1:判断一个物质是否是电解质的依据是什么?2:判断SO2、Cl2、NH3、盐酸是否是电解质?3:电解质在水溶液中和熔融状态下都能导电?4:氧化钠溶于水能导电,所以它是电解质。5:固体氯化钠不导电,所以它不是电解质?3.电解质和非电解质的理解◆电解质和非电解质都是指化合物,单质和溶液不是.
◆电解质必须是化合物本身能电离出离子而导.电.如:CO2,SO2溶于水能导电,但它们不是电解质,而是非电解质.
◆某些难溶于水的盐也是电解质.如:BaSO4 AgCl
◆酸,碱,盐,水是电解质,蔗糖,酒精,葡萄糖等是非电解质电离方程式书写的方法:4、检验“=”两边是否守恒(质量、电荷)1、写出化学式2、阳离子,阴离子——离子所带的电荷与相应的化合价相同3、阴、阳离子前面配上系数——阴、阳离子所带的电荷总数相等NaCl=Na++Cl-H2SO4=2H++SO42-NaOH=Na++OH-▲盐:电离时产生的金属阳离子和酸根阴离子的化合物◆比较酸碱盐的电离方程式,比较酸碱盐电离的特点。▲酸:电离时产生的阳离子全部是H+▲碱:电离时产生的阴离子全部是OH-思考:酸碱盐溶液中存在自由移动的离子,那么溶液是否呈电性?溶液呈中性,因为任何溶液中阴离子所带的负电荷总数与阳离子所带的正电荷总数相等作业:
P16 6、9
