溶液的配制
图片预览






文档简介
课件17张PPT。溶液的配制与分析思考要精确配置一定物质的量浓度的溶液,应该将所需质量的固体溶于水中形成所需体积溶液还是溶于该体积的水? 配置一定物质的量浓度的溶液时,需要
准确控制溶液的最终体积!
用哪种仪器?Χ(不准确)容量瓶容量瓶构造:细颈、梨形、平底的玻璃瓶 2. 特点:①容量瓶上标有温度和容积
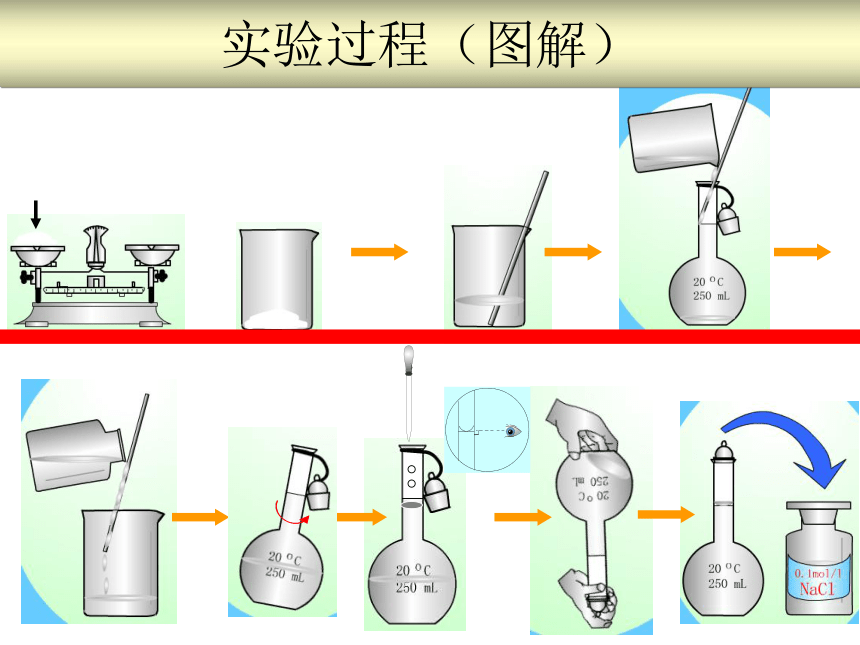
②容量瓶瓶颈上有一道刻度线 3.使用:当溶液的凹液面与刻度线相切时,容量瓶中溶液的体积即为容量瓶上所标识的体积。4.注意事项:①使用前要检查是否漏水②溶解不能在容量瓶中进行③溶液恢复至室温后才能转移入容量瓶④转移溶液时要用玻棒进行引流配置100mL 0.100mol.L-1Na2CO3溶液 实验过程
(1)计算
(2)称量(准确)
(3)溶解(冷却至室温)
(4)转移(洗涤-转移-摇匀)
(5)定容(凹液面与刻度线相切)
实验过程(图解)容量瓶上标有
(1)温度(2)浓度(3)容量
(4)压强(5)刻度线(6)酸式碱式
A (1)(3)(5)
B (3)(5)(6)
C (1)(2)(4)
D (2)(4)(6)【反馈练习】配置0.1mol/L的盐酸500mL,最适宜的一组仪器是()
A 托盘天平 烧杯 容量瓶 玻璃棒
B 烧杯 量筒 玻璃棒 胶头滴管
C 烧杯 容量瓶 玻璃棒 胶头滴管
D 烧杯 容量瓶 量筒 玻璃棒 胶头滴管【反馈练习】讨论定容时俯视或仰视刻度线,对溶液的浓度有何影响? 俯视仰视俯视或仰视刻度线对溶液浓度的影响 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 还有哪些因素会造成误差?误差分析???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯少量冷却玻璃棒250【反馈练习】③用少量蒸馏水冲洗 次,将冲洗液移入_______ 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2-3偏低1-2厘米胶头滴管低重新配制摇匀容量瓶试剂瓶
准确控制溶液的最终体积!
用哪种仪器?Χ(不准确)容量瓶容量瓶构造:细颈、梨形、平底的玻璃瓶 2. 特点:①容量瓶上标有温度和容积
②容量瓶瓶颈上有一道刻度线 3.使用:当溶液的凹液面与刻度线相切时,容量瓶中溶液的体积即为容量瓶上所标识的体积。4.注意事项:①使用前要检查是否漏水②溶解不能在容量瓶中进行③溶液恢复至室温后才能转移入容量瓶④转移溶液时要用玻棒进行引流配置100mL 0.100mol.L-1Na2CO3溶液 实验过程
(1)计算
(2)称量(准确)
(3)溶解(冷却至室温)
(4)转移(洗涤-转移-摇匀)
(5)定容(凹液面与刻度线相切)
实验过程(图解)容量瓶上标有
(1)温度(2)浓度(3)容量
(4)压强(5)刻度线(6)酸式碱式
A (1)(3)(5)
B (3)(5)(6)
C (1)(2)(4)
D (2)(4)(6)【反馈练习】配置0.1mol/L的盐酸500mL,最适宜的一组仪器是()
A 托盘天平 烧杯 容量瓶 玻璃棒
B 烧杯 量筒 玻璃棒 胶头滴管
C 烧杯 容量瓶 玻璃棒 胶头滴管
D 烧杯 容量瓶 量筒 玻璃棒 胶头滴管【反馈练习】讨论定容时俯视或仰视刻度线,对溶液的浓度有何影响? 俯视仰视俯视或仰视刻度线对溶液浓度的影响 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 还有哪些因素会造成误差?误差分析???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯少量冷却玻璃棒250【反馈练习】③用少量蒸馏水冲洗 次,将冲洗液移入_______ 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2-3偏低1-2厘米胶头滴管低重新配制摇匀容量瓶试剂瓶
