专题1 微观结构与物质的多样性复习
图片预览






文档简介
课件21张PPT。专题1 微观结构与物质的多样性复习原子核外电子排布规律分析P3表1-1,各稀有气体元素原子的最外层最多能容纳的电子数是多少?次外层呢?(1)各电子层最多容纳的电子数为2n2个。
(2)最外层电子数不超过8个(K层为最外
层不超过2个),次外层不超过18个(3)核外电子优先占有能量较低的轨道,
只有当能量较低的轨道排满后,再
排能量比较高的轨道。一最低、一最多、两不超 元素的性质随着原子序数的递增
而呈现周期性的变化规律。 元素周期律是元素原子的核外电子排布随着元素
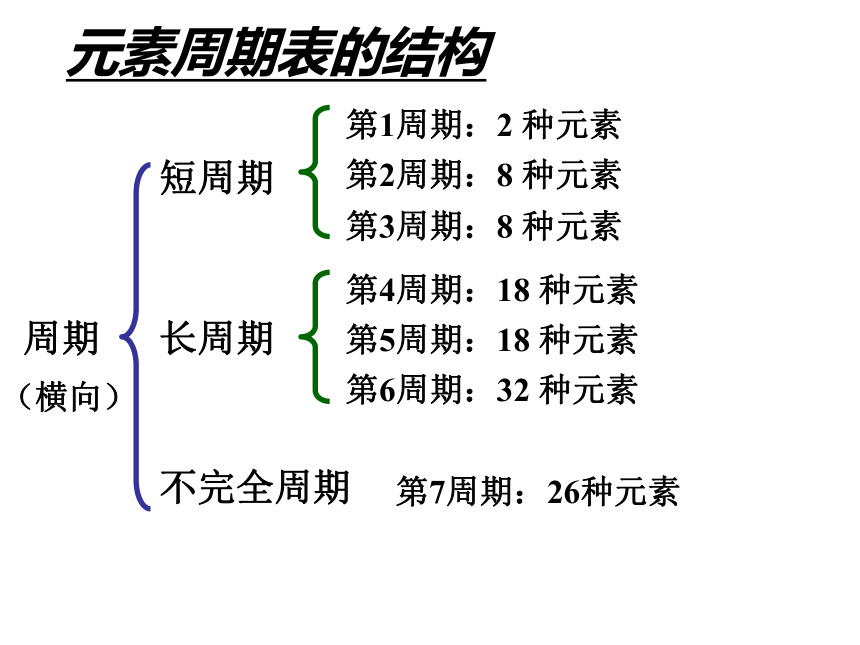
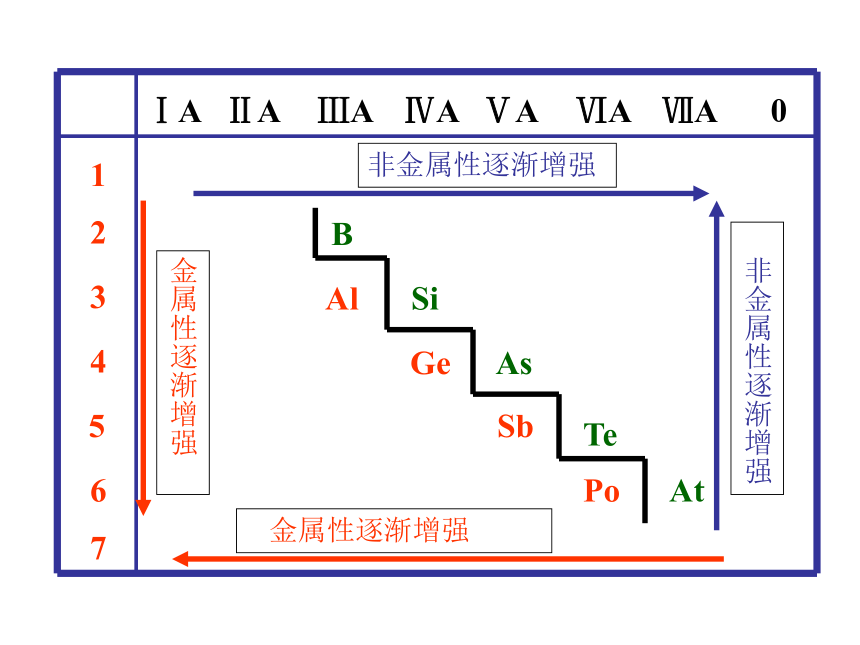
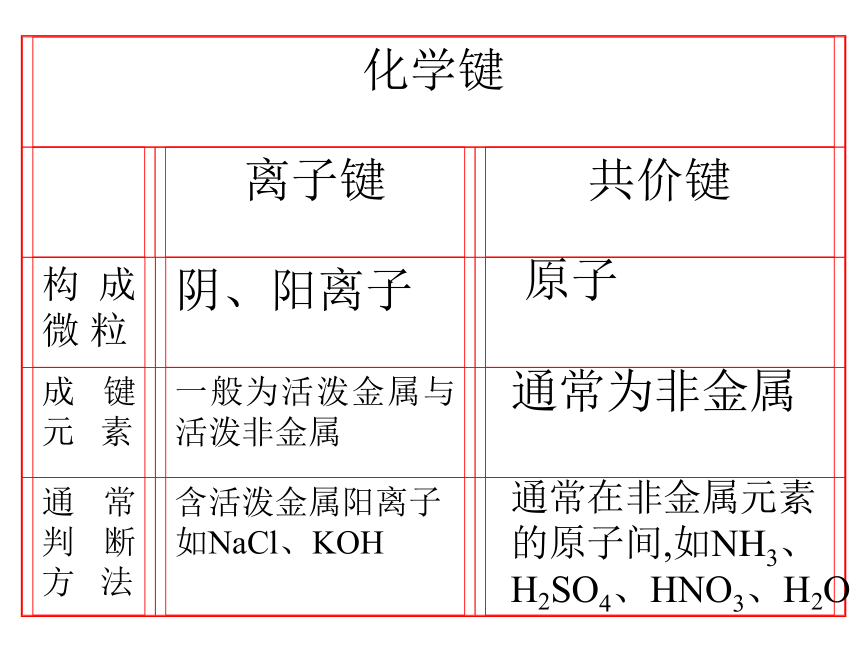
核电荷数的递增而呈现周期性的变化的必然结果。元素周期律——元 素 周 期 律19世纪中叶门捷列夫发现了元素周期律元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素(横向)元素周期表的结构 族主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素(纵向) 零族:共七个主族:长短周期共同组成ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族:仅由长周期组成三个纵行,位于Ⅶ B 与ⅠB中间 元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数) 逐渐减弱 逐渐增强 逐渐减弱 逐渐增强 金属性非金属性 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强元素周期律及元素周期表的应用 ⑴ 根据位置,推测结构,预测性质 ⑵ 研究合成有特定性质的新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。原子通常为非金属通常在非金属元素
的原子间,如NH3、
H2SO4、HNO3、H2O 相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较天然最硬物质最软矿物之一很高很高导电不导电装饰品
切割玻璃、大理石
钻探机钻头铅笔芯 H.B
电极、坩埚臭氧与氧气的性质对比无色无味气体特殊臭味淡蓝色气体不易溶于水比O2易溶于水强氧化性、不稳定性、漂白、杀菌消毒呼吸、燃烧等脱色剂、消毒剂主要是由于氧原子的个数和氧原子排列方式的不同引起的
阴阳离子
原子分子金属阳离子
和自由电子离子键共价键分子间
作用力金属键较硬很硬较小较高高较低一般较大部分小【例1】科学家最近合成出了第112号元素,其原子的质量数为277,这是迄今已知元素中最重的原子。关于该元素的叙述正确的是 A、其原子核内中子数和质子数都是112 B、其原子核内中子数为165,核外电子数为112 C、其原子质量是12C原子质量的277倍 D、其原子质量与12C原子质量之比为277∶12 【例2】一些科学家预言,存在稳定的超重元素,如:中子数为184的原子,它位于元素周期表第七周期,第ⅣA族。由此,下列说法正确的是 ( ) A、第七周期有50种元素 B、该原子的质子数是184 C、该元素的相对原子质量是298 D、该原子核外有114个电子 【例3】铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第六周期。Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag = Tl+ + 2Ag+ 下列推断正确的是: ( ) A、Tl+的最外电子层有1个电子 B、Tl3+的氧化性比Al3+弱 C、Tl能形成+3价和+1价的化合物 D、Tl+的还原性比Ag强 【例4】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 ( ) A、原子半径A>B>D>C B、原子序数d>c>b>a C、离子半径C>D>B>A D、单质的还原性A>B>D>C 【例5】有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是 A、HF B、H3O+ C、NaH D、H2O2 【例6】A、B、C、D四种短周期元素,原子半径依次减小,A与C的核电荷数之比为 3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是( ) A、X、Y、Z的稳定性逐渐减弱 B、A、B、C、D只能形成5种单质 C、X、Y、Z三种化合物的熔沸点逐渐升高 D、自然界中存在多种由A、B、C、D四种元素组成的化合物 【例7】甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙阴离子发生氧化还原反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说明甲比乙的非金属性强的是 。
(2)最外层电子数不超过8个(K层为最外
层不超过2个),次外层不超过18个(3)核外电子优先占有能量较低的轨道,
只有当能量较低的轨道排满后,再
排能量比较高的轨道。一最低、一最多、两不超 元素的性质随着原子序数的递增
而呈现周期性的变化规律。 元素周期律是元素原子的核外电子排布随着元素
核电荷数的递增而呈现周期性的变化的必然结果。元素周期律——元 素 周 期 律19世纪中叶门捷列夫发现了元素周期律元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素(横向)元素周期表的结构 族主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素(纵向) 零族:共七个主族:长短周期共同组成ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族:仅由长周期组成三个纵行,位于Ⅶ B 与ⅠB中间 元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数) 逐渐减弱 逐渐增强 逐渐减弱 逐渐增强 金属性非金属性 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强元素周期律及元素周期表的应用 ⑴ 根据位置,推测结构,预测性质 ⑵ 研究合成有特定性质的新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。原子通常为非金属通常在非金属元素
的原子间,如NH3、
H2SO4、HNO3、H2O 相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较天然最硬物质最软矿物之一很高很高导电不导电装饰品
切割玻璃、大理石
钻探机钻头铅笔芯 H.B
电极、坩埚臭氧与氧气的性质对比无色无味气体特殊臭味淡蓝色气体不易溶于水比O2易溶于水强氧化性、不稳定性、漂白、杀菌消毒呼吸、燃烧等脱色剂、消毒剂主要是由于氧原子的个数和氧原子排列方式的不同引起的
阴阳离子
原子分子金属阳离子
和自由电子离子键共价键分子间
作用力金属键较硬很硬较小较高高较低一般较大部分小【例1】科学家最近合成出了第112号元素,其原子的质量数为277,这是迄今已知元素中最重的原子。关于该元素的叙述正确的是 A、其原子核内中子数和质子数都是112 B、其原子核内中子数为165,核外电子数为112 C、其原子质量是12C原子质量的277倍 D、其原子质量与12C原子质量之比为277∶12 【例2】一些科学家预言,存在稳定的超重元素,如:中子数为184的原子,它位于元素周期表第七周期,第ⅣA族。由此,下列说法正确的是 ( ) A、第七周期有50种元素 B、该原子的质子数是184 C、该元素的相对原子质量是298 D、该原子核外有114个电子 【例3】铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第六周期。Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag = Tl+ + 2Ag+ 下列推断正确的是: ( ) A、Tl+的最外电子层有1个电子 B、Tl3+的氧化性比Al3+弱 C、Tl能形成+3价和+1价的化合物 D、Tl+的还原性比Ag强 【例4】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 ( ) A、原子半径A>B>D>C B、原子序数d>c>b>a C、离子半径C>D>B>A D、单质的还原性A>B>D>C 【例5】有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是 A、HF B、H3O+ C、NaH D、H2O2 【例6】A、B、C、D四种短周期元素,原子半径依次减小,A与C的核电荷数之比为 3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是( ) A、X、Y、Z的稳定性逐渐减弱 B、A、B、C、D只能形成5种单质 C、X、Y、Z三种化合物的熔沸点逐渐升高 D、自然界中存在多种由A、B、C、D四种元素组成的化合物 【例7】甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙阴离子发生氧化还原反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说明甲比乙的非金属性强的是 。
