化学平衡
图片预览


文档简介
洪泽中学高二化学备课组 主备人:胡家余
【课 题】二、化学平衡状态
【教学目标】1、明确化学平衡的研究对象
2、可逆反应的再认识
3、可逆反应的速率表示问题
4、化学平衡的标志(正向思维——逆向思维)
【教学重点】化学平衡的概念
【教学难点】化学平衡状态的判断
【教学过程】
知识链接:在19世纪后期,人们发现炼铁高炉所排出的高炉气中含有相当量的CO,有的工程师认为,这是由于CO和铁矿石的接触时间不够长造成的,于是在英国耗费了大量资金建成了一个高大的炼铁,以增加CO和铁矿石的接触时间。可是后来发现,用这个高炉炼铁所排出的高炉气中的CO的含量并没有减少。这种从道理上看是可行的方案为什么不能达到目的?
【引入】经过上一节课的学习,我们知道一个化学反应的反应速率是可以通过改变外部条件来增大或减慢的。显然,对于所发生的化学反应来说,我们不仅期望速率的快慢,还会关注化学反应的进行程度。若按反应程度而论,化学反应可以分成“完全反应、可逆反应”两类。如果是“完全反应”的化学反应,我们只需按化学方程式的计量数关系进行用量作用,就可以获得最佳的转化率和产率。但如果是“可逆反应”,我们必须考虑反应物的最大转化情况,因此本节课我们将学习这一类反应——可逆反应的转化情况,称为“化学平衡”。
板书:一、可逆反应与不可逆反应
阅读:27页“资料“
讲述溶解平衡
1、写出我们已经学习过的可逆反应
(1)Cl2与水的反应 (2)H2S的生成与分解 (3)SO3的生成与分解
2、可逆反应的特点
(1)定义:同条件下,反应向生成物方向(正向)进行的同时,也在往反方向(逆向)进行(方程式中用可逆符号来体现)。
(2)可逆反应一发生,任何物质(反应物、生成物)的量均大于0。
例如:在某密闭容器中进行的可逆反应:X2(g)+Y2(g)2Z(g),已知起始时X2、Y2、Z各物质浓度分别为0.1mol/L、0.3 mol/L、0.2 mol/L,反应在一定条件下进行到某程度时,下列各物质的浓度不可能的是( )
A.c(Z)=0.3 mol/L B.c(Y2)=0.35 mol/L
C.c(Y2)=0.2 mol/L D.c(Z)=0.4 mol/L
3、某一可逆反应的速率表示情况
由于可逆反应有两个方向,在表示可逆反应的速率时,必然要明确到底是体现哪一方向,因此规定:往正向反应时用v(正),往逆向时用v(逆)表示。
又因为表示一个反应的速率时,需用具体物质的速率来表示,且用各物质表示时还涉及到计量数的比例关系,所以可逆反应的速率表示将比较麻烦。
我们利用下例来加以认识:对合成NH3的反应,N2(g)+3H2(g)2NH3(g)。某时刻的速率表示是:
V(正)可以是:N2的消耗、H2的消耗、NH3的生成(而且有速率比等于计量数比)
V(逆)可以是:N2的生成、H2的生成、NH3的消耗(而且有速率比等于计量数比)
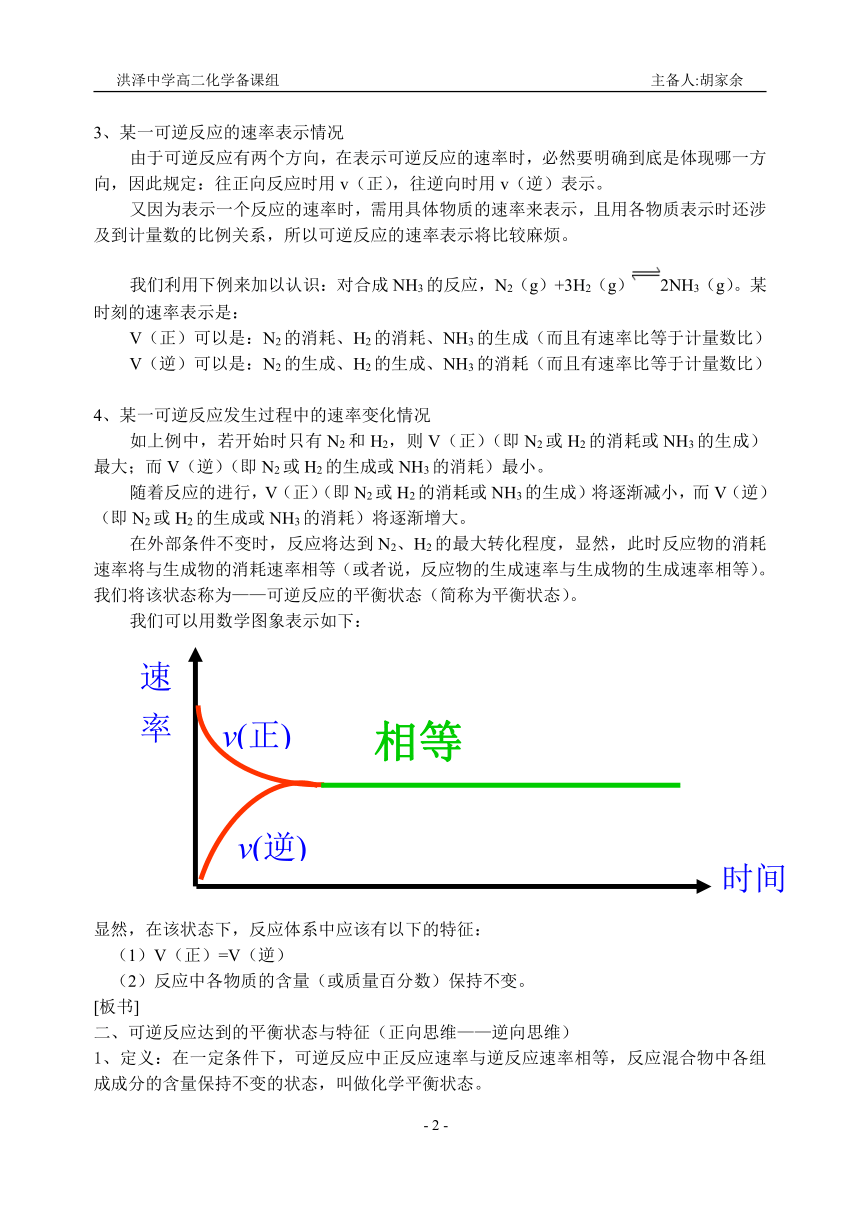
4、某一可逆反应发生过程中的速率变化情况
如上例中,若开始时只有N2和H2,则V(正)(即N2或H2的消耗或NH3的生成)最大;而V(逆)(即N2或H2的生成或NH3的消耗)最小。
随着反应的进行,V(正)(即N2或H2的消耗或NH3的生成)将逐渐减小,而V(逆)(即N2或H2的生成或NH3的消耗)将逐渐增大。
在外部条件不变时,反应将达到N2、H2的最大转化程度,显然,此时反应物的消耗速率将与生成物的消耗速率相等(或者说,反应物的生成速率与生成物的生成速率相等)。我们将该状态称为——可逆反应的平衡状态(简称为平衡状态)。
我们可以用数学图象表示如下:
显然,在该状态下,反应体系中应该有以下的特征:
(1)V(正)=V(逆)
(2)反应中各物质的含量(或质量百分数)保持不变。
[板书]
二、可逆反应达到的平衡状态与特征(正向思维——逆向思维)
1、定义:在一定条件下,可逆反应中正反应速率与逆反应速率相等,反应混合物中各组成成分的含量保持不变的状态,叫做化学平衡状态。
动:化学平衡是一种动态平衡v(正)=v(逆)。 定:条件不变时,各组分浓度保持不变。 变:条件改变时,化学平衡发生移动。
2、本质特征:
(1)V(正)=V(逆)
(2)反应中各物质的含量(或质量百分数)保持不变。
3、其他特征
密度?、压强?、质量?、平均分子量?、总物质的量?等分析
例题:在一定温度下,某体积不变的密闭容器中进行下列可逆反应:N2+3H22NH3,请判断下列各情况能说明该反应已经达到化学平衡状态的是( )
A、反应物浓度等于生成物浓度
B、容器中N2、H2、NH3浓度之比为1:3:2
C、v(N2正)= v(H2正)
D、V(N2正):V(NH3正)=1:2
E、V(N2正):V(H2逆)=3:1
F、V(H2正):V(NH3逆)=2:3
G、单位时间内生成1mol的N2时,同时生成3 mol的H2
H、反应混合体系的压强不随时间的变化而变化
I、容器内气体的密度不再变化
老师小结:
板书设计:
巩固练习:见附页
化学平衡练习:
1.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:
A(固)+2B(气) C(气)+D(气)已达平衡的是( )
(A)混合气体的压强 (B)混合气体的密度
(C)B的物质的量浓度 (D)气体总物质的量
2.达到化学平衡的条件是( )
(A)逆反应停止进行 (B)反应物与生成物的浓度相等
(C)正反应与逆反应停止进行 (D)正反应和逆反应的速率相等。
3.一定条件下,AL密闭容器中加入1molN2和3molH2发生N2+3H2 2NH3的反应,下列叙述中能说明该反应已达到化学平衡状态的是( )
A.c(N2) ︰c(H2) ︰c(NH3) =1︰3︰2
B.3v(H2) = v(N2)
C.单位时间内有1个N≡N键断裂的同时,有6个N—H键断裂
D.单位时间内有0.3molH2消耗的同时,生成0.2molNH3
4.在一定温度下,可逆反应:A2(气)+B2(气)2AB(气),达到平衡的标志是( )
(A)容器的总压强不随时间而变化
(B)单位时间内有nmolA2生成的同时有nmolB2生成
(C)单位时间内有nmolB2发生反应的同时有nmolAB分解
(D)单位时间内生成nmolA2同时就有2nmolAB生成
5.在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是( )
(A)C的生成速率 与C的分解速率相等
(B)单位时间生成n mol A,同时生成3n mol B
(C)A、B、C的浓度不再变化
(D)A、B、C的分子数比为1:3:2
6.下列反应在密闭容器中进行,aA(g)+bB(g)mC(g)+nD(g),表示其已达到平衡状态的叙述中正确的是( )
(A)平衡时的压强与反应起始的压强之比为m+n/a+b
(B)用物质A表示的反应速度与物质C表示的反应速度之比为a/m
(C)物质B的浓度不随时间而改变
(D)单位时间内x mol B参加反应同时有x mol B生成
7.在一定条件下,可逆反应2A B+3C在下列4种状态中,处于平衡状态的是
(A) 正反应速度 vA=2mol/(L·min)逆反应速度vB=2 mol/(L·min)
(B) 正反应速度 vA=2mol/(L·min)逆反应速度vC=2 mol/(L·min)
(C) 正反应速度 vA=1mol/(L·min)逆反应速度vB=1.5 mol/(L·min)
(D) 正反应速度 vA=1mol/(L·min)逆反应速度vC=1.5mol/(L·min)
8.在一定温度下反应A2(气)+B2(气) 2AB(气)达到平衡的标志是( )
(A)单位时间内生成nmolA2的同时,生成nmolB2
(B)单位时间内生成2nmolAB的同时,生成nmolB2
(C)单位时间内生成了nmolB2的同时,减少了nmolA2
(D)单位时间生成nmolA2,同时生成nmolAB
(E)单位时间内消耗了nmolA2,同时消耗了2nmolAB
9.在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应: A(s)+2B(g)C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L。
下列叙述不正确的是( )
A.在5min内该反应用C的浓度变化表示的反应速率为0.02mol/(L·min)
B.5min时,容器内D的浓度为0.2mol/L
C.当容器内压强保持恒定时,该可逆反应达到平衡状态
D.5min时容器内气体总的物质的量为3mol
10.在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的是( )
( A )A(气)+B(气)C(气) ( B )A(气)+2B(气)3C(气)
( C )A(气)+B(气)C(气)+D(气) ( D )以上都达到平衡
11.能够充分说明在恒温下的密闭容器中反应:2SO2+O22SO3,已经达到平衡的标志是( )
(A)容器中SO2、O2、SO3共存
(B)容器中SO2和SO3的浓度相同
(C)容器中SO2、O2、SO3的物质的量为2:1:2
(D)容器中压强不随时间的变化而改变
12.在2NO2 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
(A)N2O4和NO2的分子数比为1:2
(B)N2O4和NO2的浓度相等
(C)平衡体系的颜色一定不再改变
(D)单位时间有1 mol N2O4变为NO2的同时,有2 mol NO2变为N2O4
13.在一定温度下,容器内某一反应中M、N的物
质的量随反应时间变化的曲线如图,下列表述中正确
的是 ( )
A.反应的化学方程式为.2MN
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
参考答案:1、BC 2、D 3、C 4、D 5、AC 6、CD
7、D 8、BCE 9、D 10、A 11、D 12、CD 13、D
v(正)
相等
时间
速率
v(逆)
- 5 -
【课 题】二、化学平衡状态
【教学目标】1、明确化学平衡的研究对象
2、可逆反应的再认识
3、可逆反应的速率表示问题
4、化学平衡的标志(正向思维——逆向思维)
【教学重点】化学平衡的概念
【教学难点】化学平衡状态的判断
【教学过程】
知识链接:在19世纪后期,人们发现炼铁高炉所排出的高炉气中含有相当量的CO,有的工程师认为,这是由于CO和铁矿石的接触时间不够长造成的,于是在英国耗费了大量资金建成了一个高大的炼铁,以增加CO和铁矿石的接触时间。可是后来发现,用这个高炉炼铁所排出的高炉气中的CO的含量并没有减少。这种从道理上看是可行的方案为什么不能达到目的?
【引入】经过上一节课的学习,我们知道一个化学反应的反应速率是可以通过改变外部条件来增大或减慢的。显然,对于所发生的化学反应来说,我们不仅期望速率的快慢,还会关注化学反应的进行程度。若按反应程度而论,化学反应可以分成“完全反应、可逆反应”两类。如果是“完全反应”的化学反应,我们只需按化学方程式的计量数关系进行用量作用,就可以获得最佳的转化率和产率。但如果是“可逆反应”,我们必须考虑反应物的最大转化情况,因此本节课我们将学习这一类反应——可逆反应的转化情况,称为“化学平衡”。
板书:一、可逆反应与不可逆反应
阅读:27页“资料“
讲述溶解平衡
1、写出我们已经学习过的可逆反应
(1)Cl2与水的反应 (2)H2S的生成与分解 (3)SO3的生成与分解
2、可逆反应的特点
(1)定义:同条件下,反应向生成物方向(正向)进行的同时,也在往反方向(逆向)进行(方程式中用可逆符号来体现)。
(2)可逆反应一发生,任何物质(反应物、生成物)的量均大于0。
例如:在某密闭容器中进行的可逆反应:X2(g)+Y2(g)2Z(g),已知起始时X2、Y2、Z各物质浓度分别为0.1mol/L、0.3 mol/L、0.2 mol/L,反应在一定条件下进行到某程度时,下列各物质的浓度不可能的是( )
A.c(Z)=0.3 mol/L B.c(Y2)=0.35 mol/L
C.c(Y2)=0.2 mol/L D.c(Z)=0.4 mol/L
3、某一可逆反应的速率表示情况
由于可逆反应有两个方向,在表示可逆反应的速率时,必然要明确到底是体现哪一方向,因此规定:往正向反应时用v(正),往逆向时用v(逆)表示。
又因为表示一个反应的速率时,需用具体物质的速率来表示,且用各物质表示时还涉及到计量数的比例关系,所以可逆反应的速率表示将比较麻烦。
我们利用下例来加以认识:对合成NH3的反应,N2(g)+3H2(g)2NH3(g)。某时刻的速率表示是:
V(正)可以是:N2的消耗、H2的消耗、NH3的生成(而且有速率比等于计量数比)
V(逆)可以是:N2的生成、H2的生成、NH3的消耗(而且有速率比等于计量数比)
4、某一可逆反应发生过程中的速率变化情况
如上例中,若开始时只有N2和H2,则V(正)(即N2或H2的消耗或NH3的生成)最大;而V(逆)(即N2或H2的生成或NH3的消耗)最小。
随着反应的进行,V(正)(即N2或H2的消耗或NH3的生成)将逐渐减小,而V(逆)(即N2或H2的生成或NH3的消耗)将逐渐增大。
在外部条件不变时,反应将达到N2、H2的最大转化程度,显然,此时反应物的消耗速率将与生成物的消耗速率相等(或者说,反应物的生成速率与生成物的生成速率相等)。我们将该状态称为——可逆反应的平衡状态(简称为平衡状态)。
我们可以用数学图象表示如下:
显然,在该状态下,反应体系中应该有以下的特征:
(1)V(正)=V(逆)
(2)反应中各物质的含量(或质量百分数)保持不变。
[板书]
二、可逆反应达到的平衡状态与特征(正向思维——逆向思维)
1、定义:在一定条件下,可逆反应中正反应速率与逆反应速率相等,反应混合物中各组成成分的含量保持不变的状态,叫做化学平衡状态。
动:化学平衡是一种动态平衡v(正)=v(逆)。 定:条件不变时,各组分浓度保持不变。 变:条件改变时,化学平衡发生移动。
2、本质特征:
(1)V(正)=V(逆)
(2)反应中各物质的含量(或质量百分数)保持不变。
3、其他特征
密度?、压强?、质量?、平均分子量?、总物质的量?等分析
例题:在一定温度下,某体积不变的密闭容器中进行下列可逆反应:N2+3H22NH3,请判断下列各情况能说明该反应已经达到化学平衡状态的是( )
A、反应物浓度等于生成物浓度
B、容器中N2、H2、NH3浓度之比为1:3:2
C、v(N2正)= v(H2正)
D、V(N2正):V(NH3正)=1:2
E、V(N2正):V(H2逆)=3:1
F、V(H2正):V(NH3逆)=2:3
G、单位时间内生成1mol的N2时,同时生成3 mol的H2
H、反应混合体系的压强不随时间的变化而变化
I、容器内气体的密度不再变化
老师小结:
板书设计:
巩固练习:见附页
化学平衡练习:
1.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:
A(固)+2B(气) C(气)+D(气)已达平衡的是( )
(A)混合气体的压强 (B)混合气体的密度
(C)B的物质的量浓度 (D)气体总物质的量
2.达到化学平衡的条件是( )
(A)逆反应停止进行 (B)反应物与生成物的浓度相等
(C)正反应与逆反应停止进行 (D)正反应和逆反应的速率相等。
3.一定条件下,AL密闭容器中加入1molN2和3molH2发生N2+3H2 2NH3的反应,下列叙述中能说明该反应已达到化学平衡状态的是( )
A.c(N2) ︰c(H2) ︰c(NH3) =1︰3︰2
B.3v(H2) = v(N2)
C.单位时间内有1个N≡N键断裂的同时,有6个N—H键断裂
D.单位时间内有0.3molH2消耗的同时,生成0.2molNH3
4.在一定温度下,可逆反应:A2(气)+B2(气)2AB(气),达到平衡的标志是( )
(A)容器的总压强不随时间而变化
(B)单位时间内有nmolA2生成的同时有nmolB2生成
(C)单位时间内有nmolB2发生反应的同时有nmolAB分解
(D)单位时间内生成nmolA2同时就有2nmolAB生成
5.在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是( )
(A)C的生成速率 与C的分解速率相等
(B)单位时间生成n mol A,同时生成3n mol B
(C)A、B、C的浓度不再变化
(D)A、B、C的分子数比为1:3:2
6.下列反应在密闭容器中进行,aA(g)+bB(g)mC(g)+nD(g),表示其已达到平衡状态的叙述中正确的是( )
(A)平衡时的压强与反应起始的压强之比为m+n/a+b
(B)用物质A表示的反应速度与物质C表示的反应速度之比为a/m
(C)物质B的浓度不随时间而改变
(D)单位时间内x mol B参加反应同时有x mol B生成
7.在一定条件下,可逆反应2A B+3C在下列4种状态中,处于平衡状态的是
(A) 正反应速度 vA=2mol/(L·min)逆反应速度vB=2 mol/(L·min)
(B) 正反应速度 vA=2mol/(L·min)逆反应速度vC=2 mol/(L·min)
(C) 正反应速度 vA=1mol/(L·min)逆反应速度vB=1.5 mol/(L·min)
(D) 正反应速度 vA=1mol/(L·min)逆反应速度vC=1.5mol/(L·min)
8.在一定温度下反应A2(气)+B2(气) 2AB(气)达到平衡的标志是( )
(A)单位时间内生成nmolA2的同时,生成nmolB2
(B)单位时间内生成2nmolAB的同时,生成nmolB2
(C)单位时间内生成了nmolB2的同时,减少了nmolA2
(D)单位时间生成nmolA2,同时生成nmolAB
(E)单位时间内消耗了nmolA2,同时消耗了2nmolAB
9.在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应: A(s)+2B(g)C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L。
下列叙述不正确的是( )
A.在5min内该反应用C的浓度变化表示的反应速率为0.02mol/(L·min)
B.5min时,容器内D的浓度为0.2mol/L
C.当容器内压强保持恒定时,该可逆反应达到平衡状态
D.5min时容器内气体总的物质的量为3mol
10.在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的是( )
( A )A(气)+B(气)C(气) ( B )A(气)+2B(气)3C(气)
( C )A(气)+B(气)C(气)+D(气) ( D )以上都达到平衡
11.能够充分说明在恒温下的密闭容器中反应:2SO2+O22SO3,已经达到平衡的标志是( )
(A)容器中SO2、O2、SO3共存
(B)容器中SO2和SO3的浓度相同
(C)容器中SO2、O2、SO3的物质的量为2:1:2
(D)容器中压强不随时间的变化而改变
12.在2NO2 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
(A)N2O4和NO2的分子数比为1:2
(B)N2O4和NO2的浓度相等
(C)平衡体系的颜色一定不再改变
(D)单位时间有1 mol N2O4变为NO2的同时,有2 mol NO2变为N2O4
13.在一定温度下,容器内某一反应中M、N的物
质的量随反应时间变化的曲线如图,下列表述中正确
的是 ( )
A.反应的化学方程式为.2MN
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
参考答案:1、BC 2、D 3、C 4、D 5、AC 6、CD
7、D 8、BCE 9、D 10、A 11、D 12、CD 13、D
v(正)
相等
时间
速率
v(逆)
- 5 -
