氯气的性质(第二课时)
图片预览






文档简介
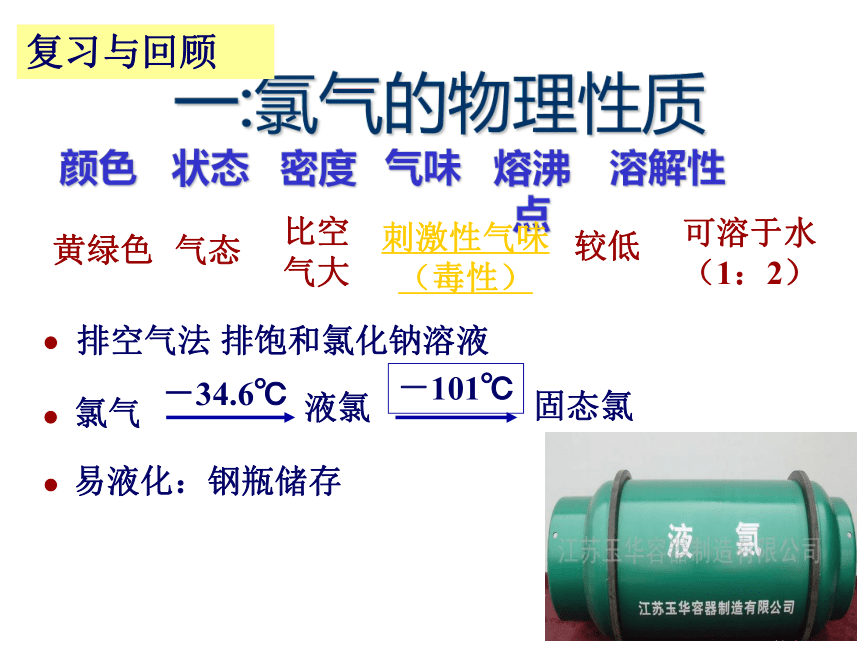
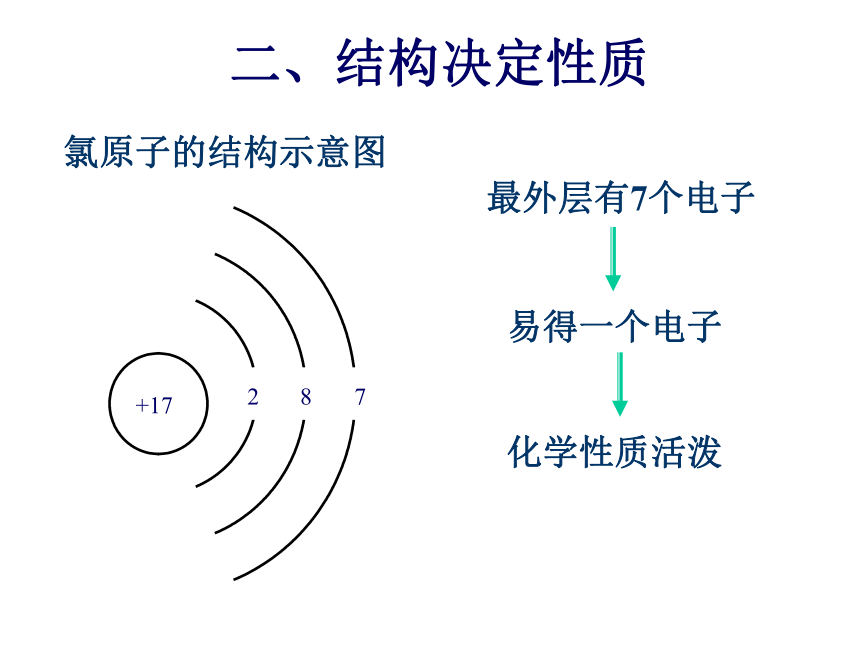
课件29张PPT。Cl2氯气一:氯气的物理性质易液化:钢瓶储存排空气法 排饱和氯化钠溶液复习与回顾氯原子的结构示意图二、结构决定性质氯气的化学性质预测:氯原子最外层有7个电子,在反应中容易得到一个电子达到稳定状态,表现出强的氧化性,所以氯气是一种化学性质很活泼的非金属单质。这也决定了氯在自然界只能以化合态存在。氯气的性质为什么如此的活泼?2、氯气的化学性质(1)与金属的反应:二、氯气的性质2Na+Cl2==2NaCl(产生白烟) 注意:不生成 FeCl2与变价金属反应,均生成金属的
高价态化合物小结:氯气是一种化学性质很活泼的非金属单质, 能与多种金属和非金属直接化合。(2)与非金属的反应:HCl溶于水后得到盐酸。
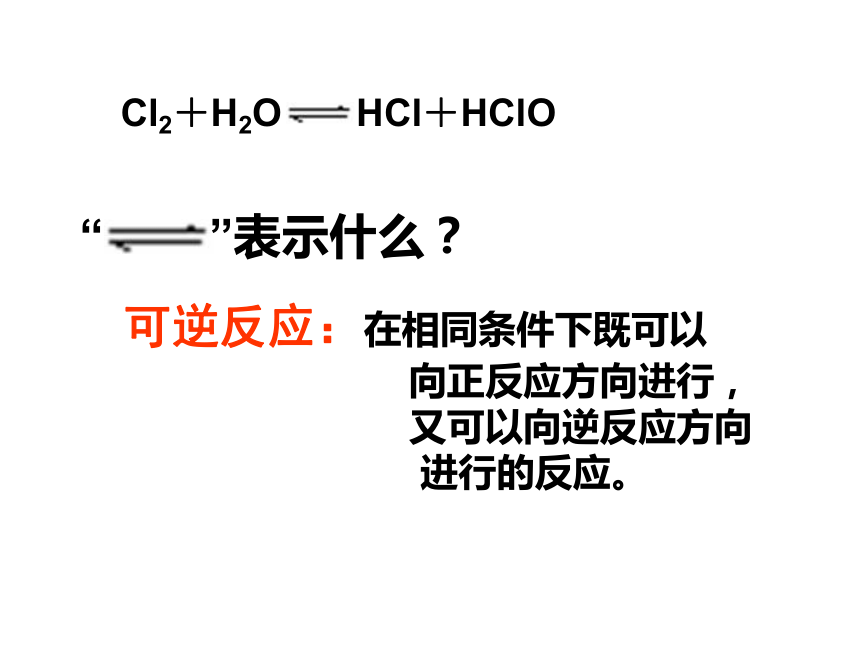
工业上常用此方法制取盐酸3、氯水的成分与性质探究二、氯气的性质 氯化钠能溶于水,氯化氢极易溶于水,二氧化碳也可以溶于水,氯气能溶于水(1︰2),但是他们在水中溶解的情况一样吗?①氯气溶解于水后是否与水发生反应?②氯水中溶质的微粒以什么形式存在?3、氯水的成分与性质探究现象:干燥的有色布条不褪色,而湿润的有色布条褪色。实验一可逆反应:在相同条件下既可以
向正反应方向进行,
又可以向逆反应方向
进行的反应。(1)新制氯水中含有哪些微粒?(2)如何证明这些微粒的存在? 观察新制氯水的颜色。
分别用玻璃棒蘸取新制氯水和稀盐酸,滴在pH试纸上,将pH试纸放置片刻,比较放置前后试纸的变化。实验二实验现象:新制氯水显黄绿色。
滴上氯水的试纸开始显红色,后来又变为白 色;滴上盐酸的试纸始终显红色。结论:氯水既有酸性又有漂白性。
盐酸显酸性,没有漂白性3、氯水的成分与性质探究新制氯水中的微粒分子离子Cl2H2O HClOH+(1)新制氯水中含有哪些微粒?(2)如何证明这些微粒的存在?(氯水呈黄绿色)(氯水有酸性)(氯水有漂白性)3、氯水的成分与性质探究实验现象:产生白色沉淀结论:氯水中含有Cl― 在洁净的试管中加入2 mL新制氯水,再向试管中加入几滴硝酸银溶液和几滴稀硝酸,观察现象。实验33、氯水的成分与性质探究问题:新制氯水与液氯的有何区别?混合物纯净物Cl2、HClO、H2O、 Cl―、H+ 、ClO―等Cl2黄绿色溶液,能导电,具有氯气的性质、酸性、漂白性黄绿色液体,不导电,具有氯气的性质常温常压下可存在,不宜久置,必须随用随制常温常压下不能存在棕色瓶盛装,放在阴凉处特制耐压钢瓶中问题: 新制氯水与久置氯水的有何区别?久置氯水因次氯酸分解而变成稀盐酸问题: 新制氯水与久置氯水的有何区别?新制氯水中
含有微粒:久置氯水中
含有微粒:Cl2 、H2O 、HClO
H+ 、 Cl ― 、ClO ― H2O 、Cl ― 、 H+ 等实际为稀盐酸问题:根据氯水的成分与性质,请同学们思考:氯气与碱溶液如NaOH溶液能否反应?如能反应,则生成的产物又是什么?4、氯气与碱溶液的反应2NaOH+Cl2==NaCl+NaClO+H2O次氯酸钠工业上和实验室中常用NaOH溶液吸收氯气尾气工业上以氯气和石灰乳为原料制造漂白粉2Ca(OH)2+2Cl2==CaCl2+Ca(ClO)2+2H2O次氯酸钙漂白粉的主要成分为Ca(ClO)2和CaCl24、氯气与碱溶液的反应2Ca(OH)2+2Cl2==CaCl2+Ca(ClO)2+2H2O漂白粉的杀菌消毒原理:Ca(ClO)2+CO2+H2O ==CaCO3+2HClO在空气中问题:漂白粉放置久了为什么容易失效?漂白粉的主要成分为Ca(ClO)2和CaCl2漂白粉的有效成分为Ca(ClO)2次氯酸是强酸还是弱酸?氯气氯气的常见用途:药物冶金氯化物染料漂白剂聚氯乙烯氯化钠自来水用氯消毒游泳池盐酸盐酸——氯化氢的水溶液漂白粉漂粉精含氯制品重要的有机溶剂——氯仿聚氯乙烯薄膜盐酸小檗碱片 药品农药 下列关于氯气的描述中,正确的是( )
A、Cl2以液态形式存在时可称作氯水或液氯
B、红热的铜丝在氯气中燃烧,生成蓝色固体CuCl2
C、有氯气参加的化学反应必须在溶液中进行
D、钠在氯气中燃烧生成白色固体NaClD问题讨论如右图,a处通入Cl2,当打开
b阀时,c处的干燥红布条没有
明显变化,当关闭b阀时,c处
的干燥红布条逐渐褪色,则d瓶
中装的溶液可能是( )
A、NaOH溶液
B、浓H2SO4
C、食盐水
D、 Ca(OH)2溶液C问题讨论如上图,a处通入Cl2,当关闭
b阀时,c处的干燥红布条没有
明显变化,当打开b阀时,c处
的干燥红布条逐渐褪色,则d瓶
中装的溶液可能是( )ABD
向正反应方向进行,
又可以向逆反应方向
进行的反应。(1)新制氯水中含有哪些微粒?(2)如何证明这些微粒的存在? 观察新制氯水的颜色。
分别用玻璃棒蘸取新制氯水和稀盐酸,滴在pH试纸上,将pH试纸放置片刻,比较放置前后试纸的变化。实验二实验现象:新制氯水显黄绿色。
滴上氯水的试纸开始显红色,后来又变为白 色;滴上盐酸的试纸始终显红色。结论:氯水既有酸性又有漂白性。
盐酸显酸性,没有漂白性3、氯水的成分与性质探究新制氯水中的微粒分子离子Cl2H2O HClOH+(1)新制氯水中含有哪些微粒?(2)如何证明这些微粒的存在?(氯水呈黄绿色)(氯水有酸性)(氯水有漂白性)3、氯水的成分与性质探究实验现象:产生白色沉淀结论:氯水中含有Cl― 在洁净的试管中加入2 mL新制氯水,再向试管中加入几滴硝酸银溶液和几滴稀硝酸,观察现象。实验33、氯水的成分与性质探究问题:新制氯水与液氯的有何区别?混合物纯净物Cl2、HClO、H2O、 Cl―、H+ 、ClO―等Cl2黄绿色溶液,能导电,具有氯气的性质、酸性、漂白性黄绿色液体,不导电,具有氯气的性质常温常压下可存在,不宜久置,必须随用随制常温常压下不能存在棕色瓶盛装,放在阴凉处特制耐压钢瓶中问题: 新制氯水与久置氯水的有何区别?久置氯水因次氯酸分解而变成稀盐酸问题: 新制氯水与久置氯水的有何区别?新制氯水中
含有微粒:久置氯水中
含有微粒:Cl2 、H2O 、HClO
H+ 、 Cl ― 、ClO ― H2O 、Cl ― 、 H+ 等实际为稀盐酸问题:根据氯水的成分与性质,请同学们思考:氯气与碱溶液如NaOH溶液能否反应?如能反应,则生成的产物又是什么?4、氯气与碱溶液的反应2NaOH+Cl2==NaCl+NaClO+H2O次氯酸钠工业上和实验室中常用NaOH溶液吸收氯气尾气工业上以氯气和石灰乳为原料制造漂白粉2Ca(OH)2+2Cl2==CaCl2+Ca(ClO)2+2H2O次氯酸钙漂白粉的主要成分为Ca(ClO)2和CaCl24、氯气与碱溶液的反应2Ca(OH)2+2Cl2==CaCl2+Ca(ClO)2+2H2O漂白粉的杀菌消毒原理:Ca(ClO)2+CO2+H2O ==CaCO3+2HClO在空气中问题:漂白粉放置久了为什么容易失效?漂白粉的主要成分为Ca(ClO)2和CaCl2漂白粉的有效成分为Ca(ClO)2次氯酸是强酸还是弱酸?氯气氯气的常见用途:药物冶金氯化物染料漂白剂聚氯乙烯氯化钠自来水用氯消毒游泳池盐酸盐酸——氯化氢的水溶液漂白粉漂粉精含氯制品重要的有机溶剂——氯仿聚氯乙烯薄膜盐酸小檗碱片 药品农药 下列关于氯气的描述中,正确的是( )
A、Cl2以液态形式存在时可称作氯水或液氯
B、红热的铜丝在氯气中燃烧,生成蓝色固体CuCl2
C、有氯气参加的化学反应必须在溶液中进行
D、钠在氯气中燃烧生成白色固体NaClD问题讨论如右图,a处通入Cl2,当打开
b阀时,c处的干燥红布条没有
明显变化,当关闭b阀时,c处
的干燥红布条逐渐褪色,则d瓶
中装的溶液可能是( )
A、NaOH溶液
B、浓H2SO4
C、食盐水
D、 Ca(OH)2溶液C问题讨论如上图,a处通入Cl2,当关闭
b阀时,c处的干燥红布条没有
明显变化,当打开b阀时,c处
的干燥红布条逐渐褪色,则d瓶
中装的溶液可能是( )ABD
