溶液的配制及分析-物质的量浓度1
图片预览







文档简介
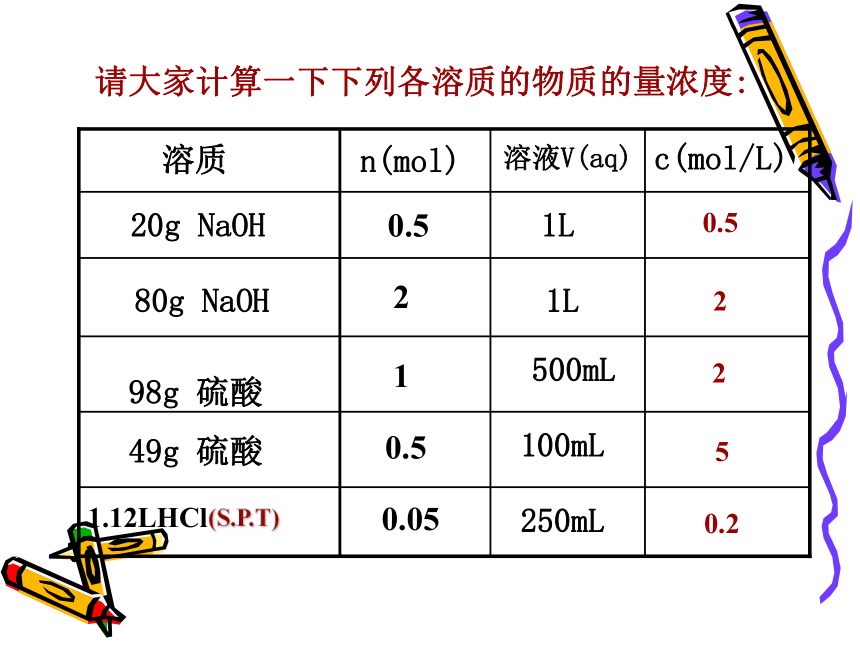
课件23张PPT。溶液的配制及分析物质的量浓度化学:必修1专题一第二单元 研究物质的实验方法一、溶质的质量分数优点:1.配制容易。2.知道溶液的质量就可以算出溶质的质量。缺点:1.称量液体的质量不如量体积方便。2.发生反应的各物质间的质量关系要比它们的物质的量关系要复杂得多。质量分数(ω):溶质B的质量和溶液的质量之比溶液浓度二、物质的量浓度1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。用cB表示。3、公式:2、单位:常用 mol/L(mol·L-1)有时用mol/m3(mol·m-3)nB=cB·V或500mL请大家计算一下下列各溶质的物质的量浓度:溶质溶液V(aq)n(mol)c(mol/L)20g NaOH80g NaOH
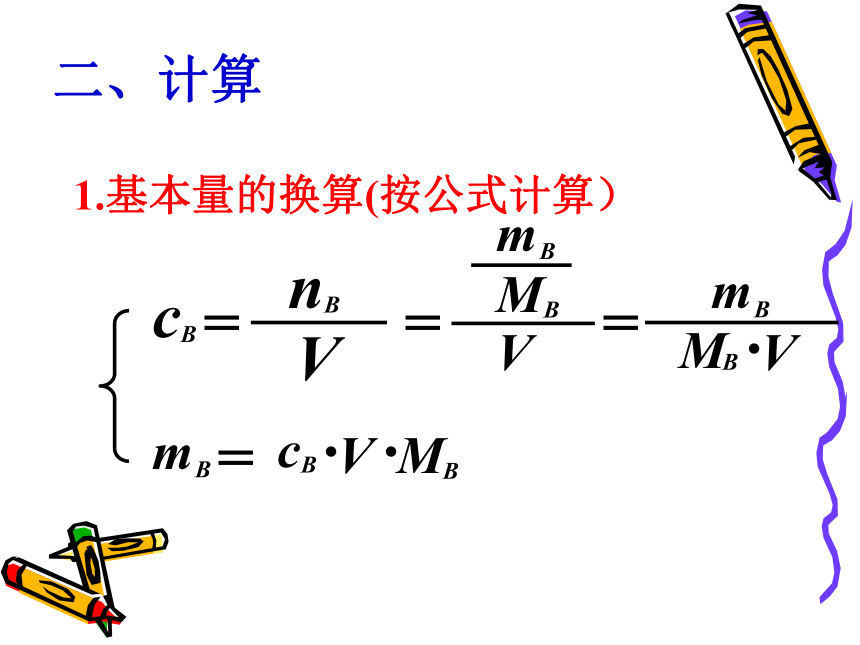
98g 硫酸49g 硫酸1.12LHCl1L1L100mL250mL(S.P.T)0.52250.20.5210.50.05讨 论 …1、将342g蔗糖(C12H22O11)溶解在1L水中,所得的溶液中溶质的物质的量浓度是否为1mol/L?结论:溶液体积不等于溶剂体积。溶质溶于溶剂后,体积会发生变化。(否)2、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001结论:溶液是均一的,对于一定物质的量浓度的溶液,不论取用它的体积多少,溶液中溶质的物质的量浓度是不变的。但是在不同体积的溶液中,溶质的物质的量不同。二、计算1.基本量的换算(按公式计算)例1、将5.3gNa2CO3配成250mL溶液,求溶液的物质的量浓度。
解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 5.3g/106g?mol-1 = 0.05molc (Na2CO3) = n (Na2CO3) /V[Na2CO3(aq)] = 0.05mol/0.25L= 0.2mol/L
答:溶液的Na2CO3的物质的量浓度为0.2mol/L。(106)例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?
解:n(NaCl) = C(NaCl)·V[NaCl(aq)]
= 1.6mol/L×0.25L = 0.4mol
m(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g
答:需要NaCl的质量为23.4g。
2.在物质的量浓度溶液中溶质微粒数目的计算
只要溶液体积相同,物质的量浓度相同,所含溶质的物质的量必然相同,所含溶质的分子数也必然相同,但不能说所含微粒数也相同。 1、2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。22.408×10241.204×10242、0.5 mol /L的下列溶液500mL中含NO3-数目最多的是:( ) ;NO3- 物质的量浓度最大的是:( )
A.硝酸钾 B.硝酸钡 C.硝酸镁 D.硝酸铝
DD3.溶液中溶质的质量分数与物质的量浓度的换算
溶质
摩尔质量(g/mol)溶液
密度(g/mL)换算方法:1、分别根据物质的量浓度和质量分数
的公式进行求算2、换算时注意体积单位:1L=1000mL设一法设V=1L=1000mL例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 4.有关溶液稀释和浓缩的计算
结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 习题思路:稀溶液前后溶质的物质的量相等
有关溶液稀释和浓缩的计算1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L
2。20%的蔗糖(C12H22O11)溶液342克稀释到1升,其物质的量浓度将是多少?
解:342g×20%÷342g/mol=1L×C(蔗)
3。配制500mL1 mol/L的H2SO4溶液,需要密度为1.836g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5L×1mol/L=V×1.836g/mL×98%÷98g/mol返回5.有关两种不同浓度溶液混合的计算
C3V3 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)
6.有关溶液反应的计算
见课本P24例题3习题习题不同浓度溶液混合的计算2 mol/L的盐酸溶液200L和4 mol/L的盐酸溶液100L混合,求:混合后溶液中盐酸的物质的量浓度。假定混合后液体体积不变。
C混×(0.2+0.1)=2×0.2+4×0.1
返回有关溶液反应的计算 中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
解: 2NaOH————H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L
小结:一、物质的量浓度
二、有关物质的量浓度的计算1.基本量的换算
2.在物质的量浓度溶液中溶质微粒数目的计算
3.溶液中溶质的质量分数与物质的量浓度的换算
4.有关溶液稀释和浓缩的计算
5.有关两种不同浓度溶液混合的计算
6.有关溶液反应的计算前 后
n1 = n2(按公式计算)按化学式组成设一法÷MM ××NANA ÷× V
(溶液体积)×Vm÷Vm 总结:m、V、N、n、cB之间的关系:÷V
(溶液体积)作业:P26:T5、T6
98g 硫酸49g 硫酸1.12LHCl1L1L100mL250mL(S.P.T)0.52250.20.5210.50.05讨 论 …1、将342g蔗糖(C12H22O11)溶解在1L水中,所得的溶液中溶质的物质的量浓度是否为1mol/L?结论:溶液体积不等于溶剂体积。溶质溶于溶剂后,体积会发生变化。(否)2、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001结论:溶液是均一的,对于一定物质的量浓度的溶液,不论取用它的体积多少,溶液中溶质的物质的量浓度是不变的。但是在不同体积的溶液中,溶质的物质的量不同。二、计算1.基本量的换算(按公式计算)例1、将5.3gNa2CO3配成250mL溶液,求溶液的物质的量浓度。
解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 5.3g/106g?mol-1 = 0.05molc (Na2CO3) = n (Na2CO3) /V[Na2CO3(aq)] = 0.05mol/0.25L= 0.2mol/L
答:溶液的Na2CO3的物质的量浓度为0.2mol/L。(106)例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?
解:n(NaCl) = C(NaCl)·V[NaCl(aq)]
= 1.6mol/L×0.25L = 0.4mol
m(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g
答:需要NaCl的质量为23.4g。
2.在物质的量浓度溶液中溶质微粒数目的计算
只要溶液体积相同,物质的量浓度相同,所含溶质的物质的量必然相同,所含溶质的分子数也必然相同,但不能说所含微粒数也相同。 1、2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。22.408×10241.204×10242、0.5 mol /L的下列溶液500mL中含NO3-数目最多的是:( ) ;NO3- 物质的量浓度最大的是:( )
A.硝酸钾 B.硝酸钡 C.硝酸镁 D.硝酸铝
DD3.溶液中溶质的质量分数与物质的量浓度的换算
溶质
摩尔质量(g/mol)溶液
密度(g/mL)换算方法:1、分别根据物质的量浓度和质量分数
的公式进行求算2、换算时注意体积单位:1L=1000mL设一法设V=1L=1000mL例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 4.有关溶液稀释和浓缩的计算
结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 习题思路:稀溶液前后溶质的物质的量相等
有关溶液稀释和浓缩的计算1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L
2。20%的蔗糖(C12H22O11)溶液342克稀释到1升,其物质的量浓度将是多少?
解:342g×20%÷342g/mol=1L×C(蔗)
3。配制500mL1 mol/L的H2SO4溶液,需要密度为1.836g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5L×1mol/L=V×1.836g/mL×98%÷98g/mol返回5.有关两种不同浓度溶液混合的计算
C3V3 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)
6.有关溶液反应的计算
见课本P24例题3习题习题不同浓度溶液混合的计算2 mol/L的盐酸溶液200L和4 mol/L的盐酸溶液100L混合,求:混合后溶液中盐酸的物质的量浓度。假定混合后液体体积不变。
C混×(0.2+0.1)=2×0.2+4×0.1
返回有关溶液反应的计算 中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
解: 2NaOH————H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L
小结:一、物质的量浓度
二、有关物质的量浓度的计算1.基本量的换算
2.在物质的量浓度溶液中溶质微粒数目的计算
3.溶液中溶质的质量分数与物质的量浓度的换算
4.有关溶液稀释和浓缩的计算
5.有关两种不同浓度溶液混合的计算
6.有关溶液反应的计算前 后
n1 = n2(按公式计算)按化学式组成设一法÷MM ××NANA ÷× V
(溶液体积)×Vm÷Vm 总结:m、V、N、n、cB之间的关系:÷V
(溶液体积)作业:P26:T5、T6
