从铝土矿中提取铝
图片预览






文档简介
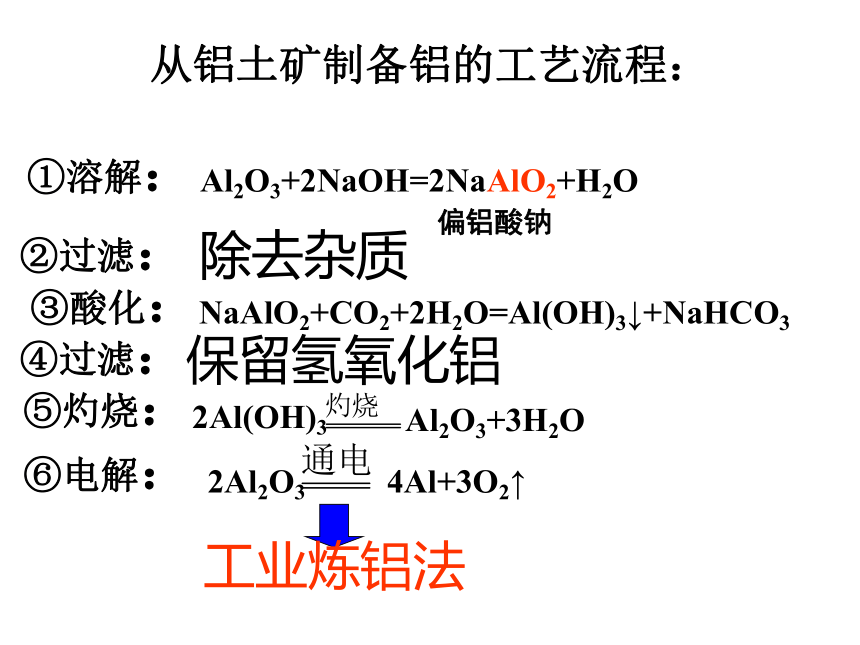
课件17张PPT。专题3从矿物到基础材料第一单元从铝土矿到铝合金从铝土矿中提取铝地壳中金属元素的含量:Al>Fe>Ca>Na除去杂质从铝土矿制备铝的工艺流程:①溶解:②过滤:③酸化:④过滤:⑤灼烧:⑥电解:Al2O3+2NaOH=2NaAlO2+H2O偏铝酸钠NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3保留氢氧化铝2Al(OH)3Al2O3+3H2O2Al2O3 4Al+3O2↑工业炼铝法铝合金的特点1、密度小
2、强度高
3、塑性好
4、制造工艺简单
5、成本低
6、抗腐蚀力强铝的性质 取一段铝片,观察其表面的颜色。将铝片部分浸入4mol·L-1氢氧化钠溶液中,静置一段时间后取出,观察颜色变化。上述实验现象说明了什么问题?观察与思考:探究实验一: 将两段用砂纸打磨过的铝条分别放入两支洁净的试管中,再向试管中分别加入浓硝酸、浓硫酸各3mL,对比观察实验现象。实验现象:无现象实验结论:不反应钝 化探究实验二: 将两段用砂纸打磨过的铝条分别放入两支洁净的试管中,再向试管中分别加入6mol·L-1盐酸、 6mol·L-1氢氧化钠溶液各3mL,对比观察实验现象。实验现象:铝条溶解,产生气泡实验结论:1.和你所熟悉的其他金属相比,铝的性质有何不同?不要错过下面这些对你极具挑战的问题 : 铝能与碱溶液作用放出氢气;铝放入浓硫酸、浓硝酸中均未发生明显变化。2.分析上述反应中铝化合价的变化,标明铝得 失电子的情况。铝和氢氧化钠溶液反应的实质第一步:第二步:2Al+6H2O= 2Al(OH)3+3H2↑Al(OH)3+NaOH=NaAlO2+2H2O★总方程式: 2Al+2NaOH+6H2O=2NaAlO2+ 4H2O +3H2↑铝热反应工业上常用铝粉来还原一些金属氧化物铝热剂:铝粉和某些金属氧化物(Fe2O3、FeO、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。习题练习1、从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是: ( )
A.铝土矿溶于NaOH溶液中
B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体
D.电解熔融的氧化铝
DP书67页2、铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1:1 B.2:1 C.3:1 D1:3习题练习CP书68页3、用铝热法从下列氧化物中还原出物质的
量相同的金属所消耗的铝最少的是( )
A、Fe3O4??? B、MnO2??? C、V2O5??? D、Cr2O3
A习题练习4、铝和铍的性质十分相似,下列关于铍的性质推断不正确的是( )
A.铍能与盐酸或氢氧化钠反应??????????????
B.氢氧化铍可溶于水 C.氧化铍能与盐酸或氢氧化钠反应??
D.氧化铍的化学式为Be2O3
B、D习题练习课后作业:课本P68-7、8
2、强度高
3、塑性好
4、制造工艺简单
5、成本低
6、抗腐蚀力强铝的性质 取一段铝片,观察其表面的颜色。将铝片部分浸入4mol·L-1氢氧化钠溶液中,静置一段时间后取出,观察颜色变化。上述实验现象说明了什么问题?观察与思考:探究实验一: 将两段用砂纸打磨过的铝条分别放入两支洁净的试管中,再向试管中分别加入浓硝酸、浓硫酸各3mL,对比观察实验现象。实验现象:无现象实验结论:不反应钝 化探究实验二: 将两段用砂纸打磨过的铝条分别放入两支洁净的试管中,再向试管中分别加入6mol·L-1盐酸、 6mol·L-1氢氧化钠溶液各3mL,对比观察实验现象。实验现象:铝条溶解,产生气泡实验结论:1.和你所熟悉的其他金属相比,铝的性质有何不同?不要错过下面这些对你极具挑战的问题 : 铝能与碱溶液作用放出氢气;铝放入浓硫酸、浓硝酸中均未发生明显变化。2.分析上述反应中铝化合价的变化,标明铝得 失电子的情况。铝和氢氧化钠溶液反应的实质第一步:第二步:2Al+6H2O= 2Al(OH)3+3H2↑Al(OH)3+NaOH=NaAlO2+2H2O★总方程式: 2Al+2NaOH+6H2O=2NaAlO2+ 4H2O +3H2↑铝热反应工业上常用铝粉来还原一些金属氧化物铝热剂:铝粉和某些金属氧化物(Fe2O3、FeO、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。习题练习1、从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是: ( )
A.铝土矿溶于NaOH溶液中
B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体
D.电解熔融的氧化铝
DP书67页2、铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1:1 B.2:1 C.3:1 D1:3习题练习CP书68页3、用铝热法从下列氧化物中还原出物质的
量相同的金属所消耗的铝最少的是( )
A、Fe3O4??? B、MnO2??? C、V2O5??? D、Cr2O3
A习题练习4、铝和铍的性质十分相似,下列关于铍的性质推断不正确的是( )
A.铍能与盐酸或氢氧化钠反应??????????????
B.氢氧化铍可溶于水 C.氧化铍能与盐酸或氢氧化钠反应??
D.氧化铍的化学式为Be2O3
B、D习题练习课后作业:课本P68-7、8
