氧化还原反应
图片预览





文档简介
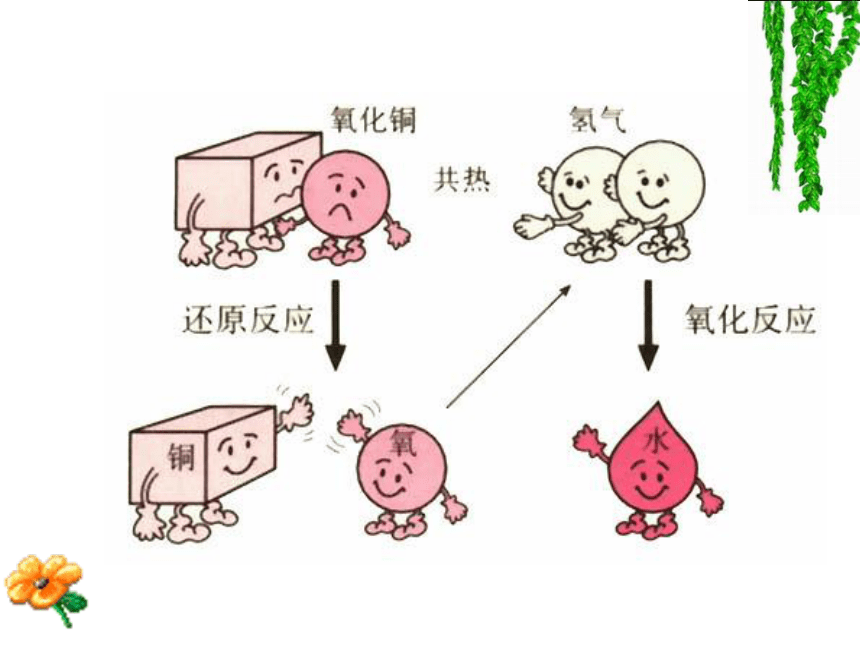
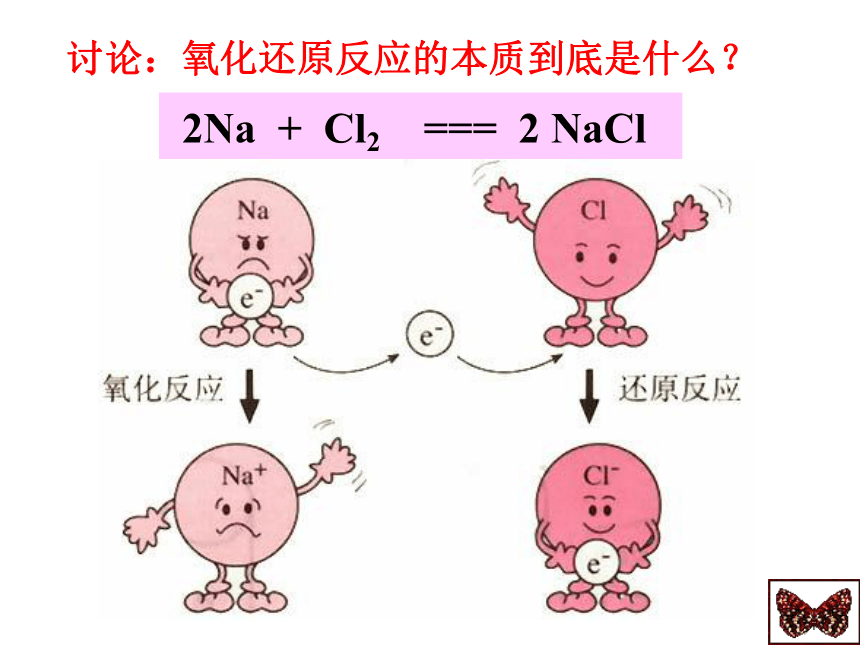
课件23张PPT。氧化还原反应用化合价升降的观点去判断下面的反 应,哪些是氧化还原反应?凡是有化合价升降的化学反应都是氧化还原反应讨论:氧化还原反应的本质到底是什么?结论:
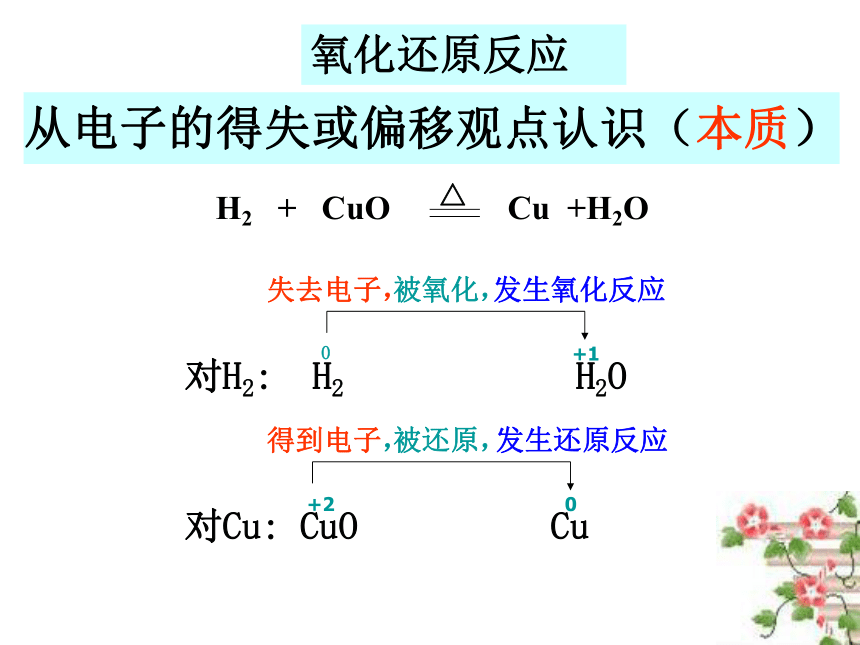
从NaCl的形成看化合价升降的根本原因是电子的得失。一、氧化还原反应H2 + Cl2 2HCl 结论:氧化还原反应实质是有电子的偏移。从电子的得失或偏移观点认识(本质)氧化还原反应氧化还原反应的实质:反应中电子的转移。
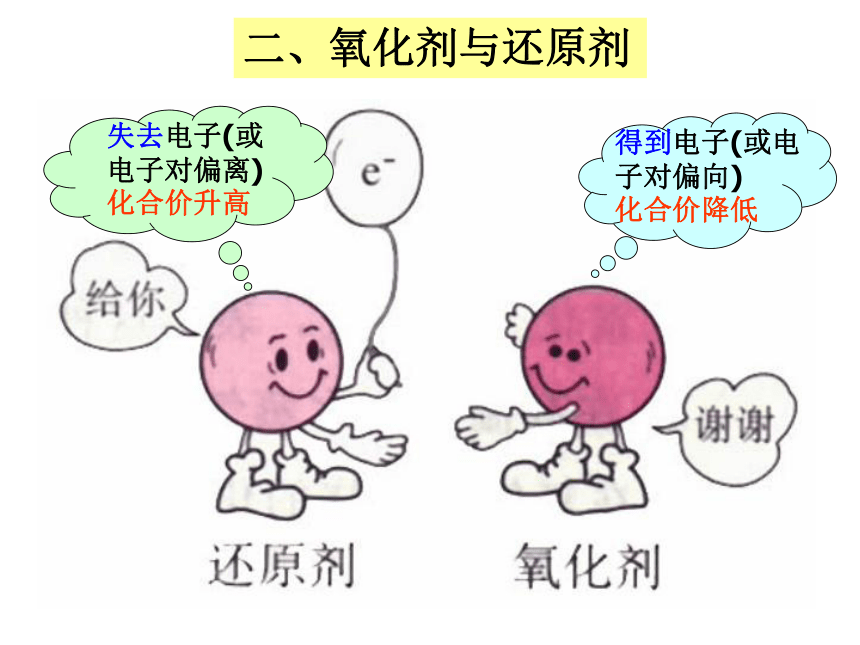
氧化还原反应的特征:元素化合价改变。定义:有电子转移(得失或偏移)的反应都是氧化还原反应。氧化还原反应的判断标准失去电子(或电子对偏离)
化合价升高得到电子(或电子对偏向)
化合价降低二、氧化剂与还原剂降、得、还——作氧化剂升、失、氧——作还原剂从元素化合价升降、电子得失角度分析:0+10-1得电子,化合价降低,被还原,发生还原反应 化合价升高,失电子,被氧化,发生氧化反应(1)双线桥法+4+2-10得2e-,被还原失2e-,被氧化步骤:①标价态②连双线③注得失化合价降低,化合价升高,二、氧化还原反应电子转移的表示方法MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O用双线桥分析氧化还原反应3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O0 +5 +2 +2化合价升高,失3×2e-,被氧化化合价降低,得2×3e-,被还原氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________HNO3 CuCu(NO3)2NO6e-(2)单线桥法注意:
1、箭头必须由失电子的物质指向得电子的物质,箭头两端对准得失电子的元素。
2、箭头的方向已表明了电子转移的方向,所以“桥”上无需再标得失,只须标明电子转移总数即可(例 ne-)Na + Cl2==NaCl0+10-12e-电子转移的表示方法1、双线桥法a.标化合价 b.划线桥 c.标变化标电子转移用a×be-的形式。
(单线桥只须标总数)步骤:2、单线桥法Cl2 + 2NaBr = 2NaCl+ Br22Na + 2H2O = 2NaOH + H2氧化还原反应的特征:化合价发生了变化氧化还原反应的本质:电子发生转移小结升、失、氧 ——作还原剂降、得、还 ——作氧化剂四、氧化性还原性强弱的比较氧化性: 氧化剂 > 氧化产物
还原性:还原剂 > 还原产物练习:氧化性:A2>C2> B2> D2还原性:D->B->C-> A-单质的还原性越强,对应的离子的氧化性越弱单质的氧化性越强,对应的离子的还原性越弱金属活动性顺序:还原性:K>Ca>Na>Mg>……氧化性:K+如:浓H2SO4 HNO3 FeCl3 KMnO4
最低价态:只具有还原性
如: KI H2S Zn HCl
中间价态:既具有氧化性又有还原性
如: FeCl2 S SO2 Cl2 CO 六、氧化还原反应类型4、其它3、部分氧化还原反应
从NaCl的形成看化合价升降的根本原因是电子的得失。一、氧化还原反应H2 + Cl2 2HCl 结论:氧化还原反应实质是有电子的偏移。从电子的得失或偏移观点认识(本质)氧化还原反应氧化还原反应的实质:反应中电子的转移。
氧化还原反应的特征:元素化合价改变。定义:有电子转移(得失或偏移)的反应都是氧化还原反应。氧化还原反应的判断标准失去电子(或电子对偏离)
化合价升高得到电子(或电子对偏向)
化合价降低二、氧化剂与还原剂降、得、还——作氧化剂升、失、氧——作还原剂从元素化合价升降、电子得失角度分析:0+10-1得电子,化合价降低,被还原,发生还原反应 化合价升高,失电子,被氧化,发生氧化反应(1)双线桥法+4+2-10得2e-,被还原失2e-,被氧化步骤:①标价态②连双线③注得失化合价降低,化合价升高,二、氧化还原反应电子转移的表示方法MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O用双线桥分析氧化还原反应3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O0 +5 +2 +2化合价升高,失3×2e-,被氧化化合价降低,得2×3e-,被还原氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________HNO3 CuCu(NO3)2NO6e-(2)单线桥法注意:
1、箭头必须由失电子的物质指向得电子的物质,箭头两端对准得失电子的元素。
2、箭头的方向已表明了电子转移的方向,所以“桥”上无需再标得失,只须标明电子转移总数即可(例 ne-)Na + Cl2==NaCl0+10-12e-电子转移的表示方法1、双线桥法a.标化合价 b.划线桥 c.标变化标电子转移用a×be-的形式。
(单线桥只须标总数)步骤:2、单线桥法Cl2 + 2NaBr = 2NaCl+ Br22Na + 2H2O = 2NaOH + H2氧化还原反应的特征:化合价发生了变化氧化还原反应的本质:电子发生转移小结升、失、氧 ——作还原剂降、得、还 ——作氧化剂四、氧化性还原性强弱的比较氧化性: 氧化剂 > 氧化产物
还原性:还原剂 > 还原产物练习:氧化性:A2>C2> B2> D2还原性:D->B->C-> A-单质的还原性越强,对应的离子的氧化性越弱单质的氧化性越强,对应的离子的还原性越弱金属活动性顺序:还原性:K>Ca>Na>Mg>……氧化性:K+
最低价态:只具有还原性
如: KI H2S Zn HCl
中间价态:既具有氧化性又有还原性
如: FeCl2 S SO2 Cl2 CO 六、氧化还原反应类型4、其它3、部分氧化还原反应
