质量守恒定律(课件)
图片预览











文档简介
课件46张PPT。§5-1 质量守恒定律努力就有希望成功铸就未来想一想什么是化学变化?化学变化最主要的特征是有新物质生成,可知反应前、后物质的种类发生了变化。化合反应
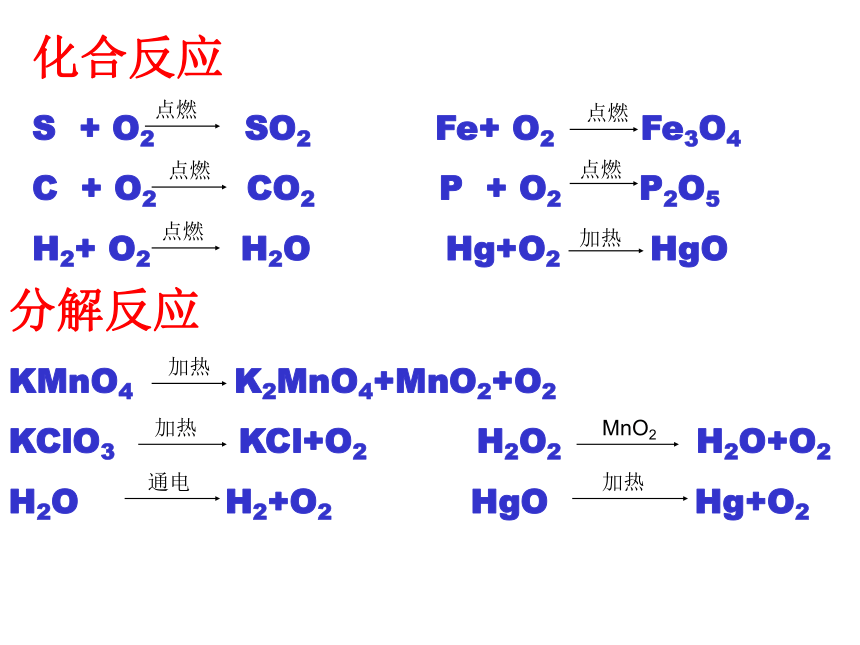
S + O2 SO2 Fe+ O2 Fe3O4
C + O2 CO2 P + O2 P2O5
H2+ O2 H2O Hg+O2 HgO 分解反应
KMnO4 K2MnO4+MnO2+O2
KClO3 KCl+O2 H2O2 H2O+O2
H2O H2+O2 HgO Hg+O2点燃点燃
点燃
点燃点燃加热加热加热通电MnO2加热提出问题: 当物质发生化学变化生成新物质时,反应物的质量与生成物的质量总和相比较,存在什么样的关系? 火柴燃烧只剩下灰烬;酒精燃烧连灰烬都没有留下;生锈的铁钉质量比未生锈时的质量大…… 早在17世纪,英国科学家波义耳就研究过化学反应前后物质质量的关系。他在敞口容器里煅烧一金属,结果发现反应后质量增加了,于是他认为化学反应中生成物的质量可能比反应物的质量增大。M生成物>M反应物 后来俄国科学家罗蒙诺索夫也做了煅烧金属的实验,所不同的是他在密闭的玻璃瓶中煅烧金属锡,冷却后不开启玻璃瓶就进行称量,结果发现尽管瓶中的金属经过煅烧已变成灰烬,但煅烧前后玻璃瓶与内容物总质量不变。 M生成物= M反应物作出假设:生成物的质量总和 反应物的质量总和等于大于小于化学反应前后 请注意观察以下实验中反应物、生成物的状态及其它变化现象,记录实验中观察到的质量变化情况让我们用实验和智慧来求证吧!实验:参加反应的磷和氧气的质量总和等于反应后生成的五氧化二磷的质量白磷燃烧产生大量白烟,放出热量
气球开始鼓起来,后来瘪下去 天平平衡1、 将几根铁钉与烧杯中的硫酸铜溶液一起放在托盘天平上,共同称量。
2、将铁钉放入硫酸铜溶液中(砝码不用取下),静置1-2分钟,注意实验现象并观察天平是否平衡。
实验二:铁和硫酸铜溶液反应前后质量的测定天平平衡、质量相等实验现象:铁钉表面产生红色物质,溶液颜色 逐渐变浅(由蓝色变为浅绿色)一、质量守恒定律(见书P91) 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律叫做质量守恒定律。适用范围:化学变化。 1、150克水加热蒸发后的水蒸气的质量仍为150克,问是否符合质量守恒定律。化学反应 2、磷在氧气中燃烧生成五氧化二磷,若是62克磷恰好与80克氧气反应能生成多少克五氧化二磷?
3、一同学实验测定24.5克氯酸钾完全分解后生成了14.9克氯化钾,他认为生成物的质量小于了反应物的质量,他的判断对吗?为什么? 各物质的质量总和4、根据质量守恒定律若生成44克二氧化碳需要多少克碳与32克氧气恰好完全反应?若现在有12克碳与50克氧气完全反应,问生成多少克二氧化碳?参加 理解和应用质量守恒定律时要注意以下几点:
1、质量守恒定律是一切化学反应必须遵守的一个定律,但物理变化不属于此定律;
2、质量守恒定律研究的仅是指“质量”,不能任意扩展到其它物理量;
3、守恒的数量是“总质量”,不是部分反应物和生成物的质量;
4、守恒的范围是“参加化学反应的各物质”,没有参加反应的物质,不能计算在内。实验三:盐酸与碳酸钠粉末反应前 后质量的测定 (1)将盛有盐酸的小试管放入装有
碳酸钠粉末的烧杯中 (2)称量烧杯及烧杯内物质的总质量 (3)将试管内的溶液倒入烧杯(试管仍留在烧杯中),
使二者反应,观察实验现象(4)称量烧杯及烧杯内物质的总质量 (5)比较反应前后物质总质量的变化碳酸钠粉末逐渐消失,有气泡产生天平指针向右偏,失去平衡
在敞口容器中:
盐酸(液)+碳酸钠(固)→氯化钠(固)+水(液)+二氧化碳(气)
M1 M2
>参加反应的Mg和O2的质量总和等于生成的MgO质量。仅仅只是我们没有称量一些气体物质。没有违反质量守恒定律。思考:氧化镁的质量为何增加了?是否符合质量守恒定律?上述反应的反应式怎样?在密闭容器中==在密闭容器中 凡是有气体参加或有气体生成的化学反应,均要在密闭容器中进行,杜绝反应系统内物质与环境物质之间的物质交换,否则反应后剩余物质质量会增大或减小。为了验证化学反应必然遵循质量守恒定律: 对于有气体参加或有气体生成
化学反应,必须在密闭容器中进行。 有下列事实:
①蜡烛燃烧后其质量减小了。
②铁制品生锈后质量增加了。
③湿衣服晾干后,其质量比湿的时候减少。
④石灰水放在敞口的容器中,其质量增加。
遵守质量守恒定律的是 。 ①②④练习 为什么物质在发生化学变化前后,各物质的质量总和相等呢?分 子原 子新物质新分子H2O2H2O二、质量守恒的原因:元素不变。(宏观)种类质量物质总质量本节课你有什么收获? 小结:
1、质量守恒定律:
参加化学反应的各物质的__________ 等于反应后生成的各物质的__________ 。
2、化学反应“质量守恒”的原因:
在化学反应前后_________ 没有改变、_______没有增减,___________没有改变。质量总和质量总和原子的种类原子数目原子的质量原子数目原子质量原子种类元素质量元素种类物质的种类分子的种类可能
改变分子数目1、铁丝在氧气中燃烧后,生成物质量比原来的铁丝大。用质量守恒定律解释现象练一练2、高锰酸钾完全分解后,称量剩余固体的质量,比高锰酸钾的质量小。因此这个反应不遵守质量
守恒定律。你认可这种说法吗?为什么? 根据质量守恒定律,化学反应前高锰酸钾的质量等于生成的锰酸钾、二氧化锰和氧气的质量总和,氧气扩散到空气中,所以剩余固体质量减小。不认可。3、不能用质量守恒定律解释的现象是 ( )
A、蜡烛燃烧后,越来越短、最终消失
B、潮湿的衣服在阳光下晒干
C、铁丝燃烧,其固体质量增加
D、高锰酸钾受热后,固体质量减少B 根据质量守恒定律确定某反应物或生成物的质量。
4、在A+B=C 的反应中,足量B与W克A完全反应后,生成12克C,则参加反应的B的质量是____________ 克。
5、在A+B=C+D的反应中,5克A跟一定量的B恰好完全反应,生成3克C和10克D,则B的质量是__________克。(12-W)8练一练40 (2). 6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有______克氧气参加了反应。16(1).试试看:6、用质量差确定某反应物或生成物的质量7、 酒精在空气中完全燃烧的生成物是CO2和H2O,推断出酒精中一定会有什么元素?可能会有什么元素?推断反应物或生成物的组成元素 一定有的元素:可能有的元素:C HO练一练推断出反应物或生成物的化学式8、A2+2B2=2C ,若用A和B表示C的化学式,可为_______________ 9、3Cu+8HNO3=3Cu(NO3)2+4H2O+2X,
X的化学式为________
10、3AB+C2B3=2C+3X
X的化学式为_____ AB2SO3AB2练一练3、书写化学方程式。二、质量守恒的原因:三、应用:1、推断物质的组成元素;2、推断物质的化学式; 一、质量守恒定律:忆一忆2、读法A.碳和氧气在点燃条件下反应生成二氧化碳。B.每12份质量的碳与32份质量的氧气在点燃条件下反应生成44份质量的二氧化碳。“水变含碳元素的高价的汽油、柴油,经济收入惊人,技术转让,请有识之士加盟。”同学们,假如你是老板,你是否会加盟呢?请谈一谈你的想法?廣而告之 蜡烛在空气中燃烧后,生成二氧化碳和水,试推断蜡烛中一定含有_____元素,可能含有___元素。应用在线(1)
推断物质的组成元素碳 氢氧 环保部门常用I2O5测定空气受CO污染的程度,发生反应的化学方程式为:I2O5 + 5CO =I2 + 5X,根据生成X的多少,可以判断CO的含量,则X的化学式为 。 CO2应用在线(2)
推断物质的化学式元素种类变了吗?元素质量变了吗?物质的总质量呢?化学反应前后物质种类呢?分子种类呢?动动脑不变改变 Bye Bye!
S + O2 SO2 Fe+ O2 Fe3O4
C + O2 CO2 P + O2 P2O5
H2+ O2 H2O Hg+O2 HgO 分解反应
KMnO4 K2MnO4+MnO2+O2
KClO3 KCl+O2 H2O2 H2O+O2
H2O H2+O2 HgO Hg+O2点燃点燃
点燃
点燃点燃加热加热加热通电MnO2加热提出问题: 当物质发生化学变化生成新物质时,反应物的质量与生成物的质量总和相比较,存在什么样的关系? 火柴燃烧只剩下灰烬;酒精燃烧连灰烬都没有留下;生锈的铁钉质量比未生锈时的质量大…… 早在17世纪,英国科学家波义耳就研究过化学反应前后物质质量的关系。他在敞口容器里煅烧一金属,结果发现反应后质量增加了,于是他认为化学反应中生成物的质量可能比反应物的质量增大。M生成物>M反应物 后来俄国科学家罗蒙诺索夫也做了煅烧金属的实验,所不同的是他在密闭的玻璃瓶中煅烧金属锡,冷却后不开启玻璃瓶就进行称量,结果发现尽管瓶中的金属经过煅烧已变成灰烬,但煅烧前后玻璃瓶与内容物总质量不变。 M生成物= M反应物作出假设:生成物的质量总和 反应物的质量总和等于大于小于化学反应前后 请注意观察以下实验中反应物、生成物的状态及其它变化现象,记录实验中观察到的质量变化情况让我们用实验和智慧来求证吧!实验:参加反应的磷和氧气的质量总和等于反应后生成的五氧化二磷的质量白磷燃烧产生大量白烟,放出热量
气球开始鼓起来,后来瘪下去 天平平衡1、 将几根铁钉与烧杯中的硫酸铜溶液一起放在托盘天平上,共同称量。
2、将铁钉放入硫酸铜溶液中(砝码不用取下),静置1-2分钟,注意实验现象并观察天平是否平衡。
实验二:铁和硫酸铜溶液反应前后质量的测定天平平衡、质量相等实验现象:铁钉表面产生红色物质,溶液颜色 逐渐变浅(由蓝色变为浅绿色)一、质量守恒定律(见书P91) 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律叫做质量守恒定律。适用范围:化学变化。 1、150克水加热蒸发后的水蒸气的质量仍为150克,问是否符合质量守恒定律。化学反应 2、磷在氧气中燃烧生成五氧化二磷,若是62克磷恰好与80克氧气反应能生成多少克五氧化二磷?
3、一同学实验测定24.5克氯酸钾完全分解后生成了14.9克氯化钾,他认为生成物的质量小于了反应物的质量,他的判断对吗?为什么? 各物质的质量总和4、根据质量守恒定律若生成44克二氧化碳需要多少克碳与32克氧气恰好完全反应?若现在有12克碳与50克氧气完全反应,问生成多少克二氧化碳?参加 理解和应用质量守恒定律时要注意以下几点:
1、质量守恒定律是一切化学反应必须遵守的一个定律,但物理变化不属于此定律;
2、质量守恒定律研究的仅是指“质量”,不能任意扩展到其它物理量;
3、守恒的数量是“总质量”,不是部分反应物和生成物的质量;
4、守恒的范围是“参加化学反应的各物质”,没有参加反应的物质,不能计算在内。实验三:盐酸与碳酸钠粉末反应前 后质量的测定 (1)将盛有盐酸的小试管放入装有
碳酸钠粉末的烧杯中 (2)称量烧杯及烧杯内物质的总质量 (3)将试管内的溶液倒入烧杯(试管仍留在烧杯中),
使二者反应,观察实验现象(4)称量烧杯及烧杯内物质的总质量 (5)比较反应前后物质总质量的变化碳酸钠粉末逐渐消失,有气泡产生天平指针向右偏,失去平衡
在敞口容器中:
盐酸(液)+碳酸钠(固)→氯化钠(固)+水(液)+二氧化碳(气)
M1 M2
>参加反应的Mg和O2的质量总和等于生成的MgO质量。仅仅只是我们没有称量一些气体物质。没有违反质量守恒定律。思考:氧化镁的质量为何增加了?是否符合质量守恒定律?上述反应的反应式怎样?在密闭容器中==在密闭容器中 凡是有气体参加或有气体生成的化学反应,均要在密闭容器中进行,杜绝反应系统内物质与环境物质之间的物质交换,否则反应后剩余物质质量会增大或减小。为了验证化学反应必然遵循质量守恒定律: 对于有气体参加或有气体生成
化学反应,必须在密闭容器中进行。 有下列事实:
①蜡烛燃烧后其质量减小了。
②铁制品生锈后质量增加了。
③湿衣服晾干后,其质量比湿的时候减少。
④石灰水放在敞口的容器中,其质量增加。
遵守质量守恒定律的是 。 ①②④练习 为什么物质在发生化学变化前后,各物质的质量总和相等呢?分 子原 子新物质新分子H2O2H2O二、质量守恒的原因:元素不变。(宏观)种类质量物质总质量本节课你有什么收获? 小结:
1、质量守恒定律:
参加化学反应的各物质的__________ 等于反应后生成的各物质的__________ 。
2、化学反应“质量守恒”的原因:
在化学反应前后_________ 没有改变、_______没有增减,___________没有改变。质量总和质量总和原子的种类原子数目原子的质量原子数目原子质量原子种类元素质量元素种类物质的种类分子的种类可能
改变分子数目1、铁丝在氧气中燃烧后,生成物质量比原来的铁丝大。用质量守恒定律解释现象练一练2、高锰酸钾完全分解后,称量剩余固体的质量,比高锰酸钾的质量小。因此这个反应不遵守质量
守恒定律。你认可这种说法吗?为什么? 根据质量守恒定律,化学反应前高锰酸钾的质量等于生成的锰酸钾、二氧化锰和氧气的质量总和,氧气扩散到空气中,所以剩余固体质量减小。不认可。3、不能用质量守恒定律解释的现象是 ( )
A、蜡烛燃烧后,越来越短、最终消失
B、潮湿的衣服在阳光下晒干
C、铁丝燃烧,其固体质量增加
D、高锰酸钾受热后,固体质量减少B 根据质量守恒定律确定某反应物或生成物的质量。
4、在A+B=C 的反应中,足量B与W克A完全反应后,生成12克C,则参加反应的B的质量是____________ 克。
5、在A+B=C+D的反应中,5克A跟一定量的B恰好完全反应,生成3克C和10克D,则B的质量是__________克。(12-W)8练一练40 (2). 6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有______克氧气参加了反应。16(1).试试看:6、用质量差确定某反应物或生成物的质量7、 酒精在空气中完全燃烧的生成物是CO2和H2O,推断出酒精中一定会有什么元素?可能会有什么元素?推断反应物或生成物的组成元素 一定有的元素:可能有的元素:C HO练一练推断出反应物或生成物的化学式8、A2+2B2=2C ,若用A和B表示C的化学式,可为_______________ 9、3Cu+8HNO3=3Cu(NO3)2+4H2O+2X,
X的化学式为________
10、3AB+C2B3=2C+3X
X的化学式为_____ AB2SO3AB2练一练3、书写化学方程式。二、质量守恒的原因:三、应用:1、推断物质的组成元素;2、推断物质的化学式; 一、质量守恒定律:忆一忆2、读法A.碳和氧气在点燃条件下反应生成二氧化碳。B.每12份质量的碳与32份质量的氧气在点燃条件下反应生成44份质量的二氧化碳。“水变含碳元素的高价的汽油、柴油,经济收入惊人,技术转让,请有识之士加盟。”同学们,假如你是老板,你是否会加盟呢?请谈一谈你的想法?廣而告之 蜡烛在空气中燃烧后,生成二氧化碳和水,试推断蜡烛中一定含有_____元素,可能含有___元素。应用在线(1)
推断物质的组成元素碳 氢氧 环保部门常用I2O5测定空气受CO污染的程度,发生反应的化学方程式为:I2O5 + 5CO =I2 + 5X,根据生成X的多少,可以判断CO的含量,则X的化学式为 。 CO2应用在线(2)
推断物质的化学式元素种类变了吗?元素质量变了吗?物质的总质量呢?化学反应前后物质种类呢?分子种类呢?动动脑不变改变 Bye Bye!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
