第三节第一课时氧化还原反应
图片预览

文档简介
第二章 第三节 氧化剂和还原剂第一课时学案 莱芜四中高一化学组
化学1(必修)第2章第三节“氧化剂和还原剂” 第一课时
制作:李斌才 2008.11
[学习目标]
(1)通过分析化学反应中元素化合价的变化,建立氧化还原反应的概念;
(2)通过实验事实和思考,初步理解氧化还原反应的本质是电子转移。
(3)通过“迁移·应用”、“交流·研讨”、“活动·探究”等活动,提高分析、联想、类比、迁移以及概括的能力。
(4)了解氧化—还原反应在工农业生产、日常生活中的应用,认识并理解化学这门学科对提高人类生活质量、促进社会发展的重要作用。
[学习重点]
(1)认识并建立氧化还原反应的概念。
(2)理解氧化还原反应的本质是电子转移。
[学习难点]能从化合价的变化,认识并建立氧化还原反应的概念。
[学习过程]
【温故知新】1.复习初中化学四种基本反应类型: , , , ;
2.回顾初中化学中常用的元素的化合价及 “氢气还原氧化铜”反应中氧化反应
和还原反应 的定义。
【自主学习】
一、氧化还原反应
1.从得失氧角度分析:
如:氢气还原氧化铜:
失去氧,发生了 (填“氧化”或“还原”)反应; 得到氧,发生了 (填“氧化”或“还原”)反应。也就是说,氧化反应和还原反应是 (填“先后”或“同时”)发生的。
[小结]氧化还原反应: 。
(练习)结合初中所学四大基本反应类型,分析以下反应属于哪一种?
2Cu+O2 =2CuO 2Na+Cl2=2NaCl
CaCO3高温CaO+CO2↑ 2KClO3 加热 2KCl+ O2
H2+CuO高温Cu+H2O Fe+Cu2+=Cu+Fe2+
NaCl+AgNO3 =AgCl+NaNO3
(分析)
【知识补充】氧化还原反应与四种基本反应类型的关系
(1)有单质参与的化合反应是氧化还原反应。
(2)有单质生成的分解反应是氧化还原反应。
(3)所有的置换反应都是氧化还原反应。
(4)所有的复分解反应都是非氧化还原反应。
[思考]是否只有得氧失氧的反应才是氧化还原反应?
如果一个反应中没有氧的得失,是否一定不是氧化还原反应呢?
2.从化合价角度分析:
如: 0 +2 -2 0 +1-2 元素化合价升高 被 氧化反应
H2+CuO高温Cu+H2O 元素化合价降低 被 还原反应
0 0 +1-1 元素化合价升高 被 氧化反应
2Na+Cl2=2NaCl 元素化合价降低 被 还原反应
[小结]①、从反应前后元素化合价是否升降看,氧化还原反应是 。
②、氧化反应:物质所含元素化合价 的反应;
还原反应:物质所含元素化合价 的反应。
③、判断一个反应是否为氧化还原反应的依据 。
④.新的化学反应的分类方法依据:
[练习1]下列反应属于氧化还原反应的是( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑ B、CaCO3高温CaO+CO2↑
C、Na2O+H2O=2NaOH D、Mg+2HCl=MgCl2+H2↑
[练习2]课后1
[练习3]金属钠的性质我们已经熟悉,将其露置于空气中,会发生以下变化:第一步,变成Na2O,第二步转化为NaOH,第三步逐渐生成Na2CO3·10 H2O,第四步脱水变成碳酸钠粉末,上述四步属于氧化还原反应的是:
A 第一步 B 第二步 C 第三步 D 第四步
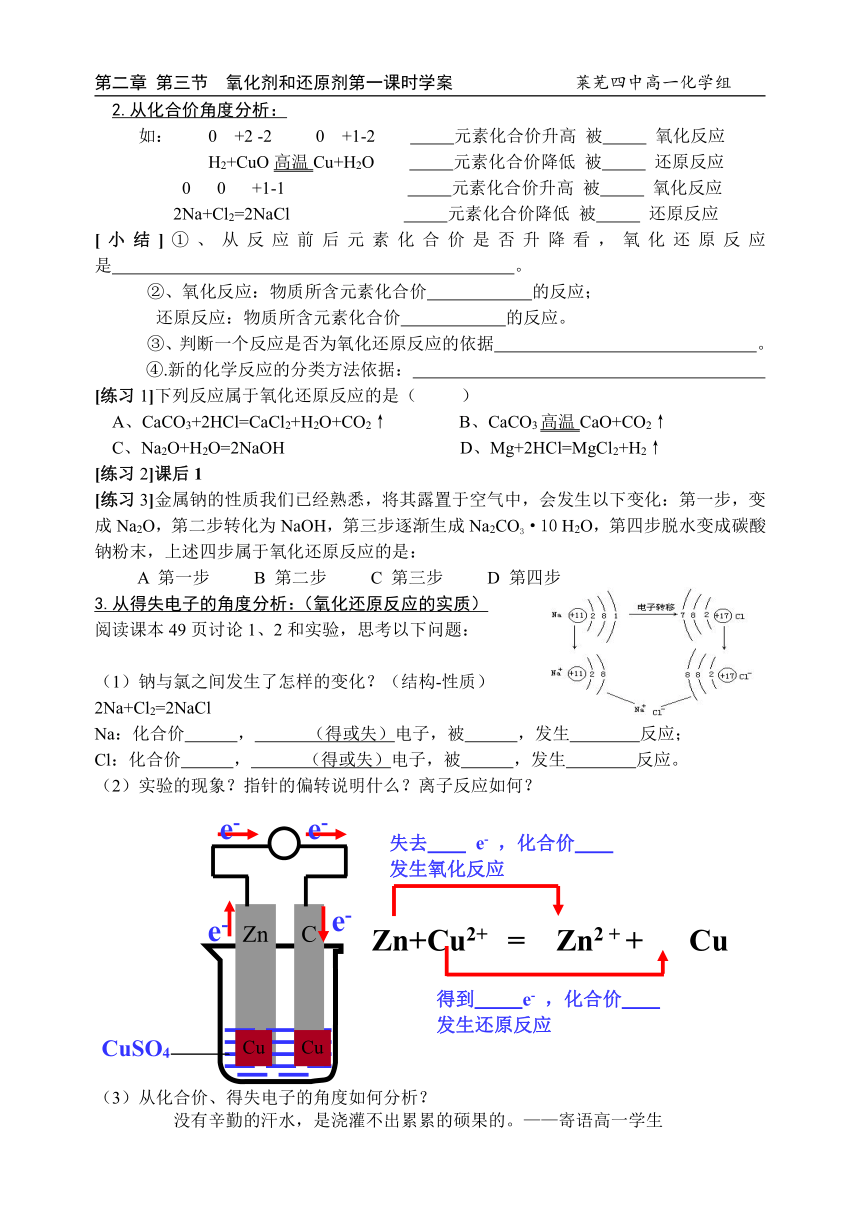
3.从得失电子的角度分析:(氧化还原反应的实质)
阅读课本49页讨论1、2和实验,思考以下问题:
(1)钠与氯之间发生了怎样的变化?(结构-性质)
2Na+Cl2=2NaCl
Na:化合价 , (得或失)电子,被 ,发生 反应;
Cl:化合价 , (得或失)电子,被 ,发生 反应。
(2)实验的现象?指针的偏转说明什么?离子反应如何?
(3)从化合价、得失电子的角度如何分析?
[小结]1、氧化还原反应: ;
2、氧化反应:表现为被氧化的元素化合价 ,其实质是 ;
还原反应:表现为被还原的元素化合价 ,其实质是 。
3、总之,氧化还原的本质就是 。
4.表示方法:
【参考“知识支持”,了解双线桥,单线桥表示法】
双线桥书写步骤:
(1).标出变化了的元素化合价;
(2).箭头总是从反应物指向生成物;
(3).箭头指向同种元素;
(4).标出化合价升、降。
练习: 用双线桥表示该反应的电子得失:2CuO + C == 2Cu + CO2
[练习4]在反应MnO2+4HCl=MnCl2+2H2O+Cl2↑中, 元素化合价升高,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应; 元素化合价降低,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。
[练习5] 下列叙述正确的是( )
A、 在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、 凡有元素化合价升降的化学反应都是氧化还原反应
C、 在氧化还原反应中一定所有的元素化合价都发生变化
D、 氧化还原反应的本质是电子的得失或偏移
[思考]请分析四种基本反应类型的反应与氧化还原反应之间的关系,并试着画出它们之间的交叉分类示意图,然后列举一些具体的化学反应加以说明。(参考课本57页概括整合)
5.作用
[阅读]教材最后一部分了解氧化还原反应在生产、生活中的广泛应用。科学合理的利用氧化还原反应。
【我的收获】请同学们自己总结本节课所学主要内容。然后填写下表:
得氧失氧观点 化合价升降观点 电子转移观点
氧化反应
还原反应
氧化还原的关系
氧化还原反应
说明:1、从得氧失氧观点描述氧化还原反应是不完善的,有其局限性;
2、从化合价升降观点可以判断是否为氧化还原反应(特征表现)。
3、电子转移是氧化还原反应的本质。
[作业]教材习题5。
八反馈练习
1.下列反应中属于氧化还原反应的是 ( )
A.CaCO3高温CaO+CO2↑
B.Na2O+H2O=2NaOH
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑
D.4HNO3(浓)△4NO2↑+O2↑+2H2O
2.下列基本反应类型中,一定是氧化还原反应的是 ( )
A、化合反应 B、分解反应
C、置换反应 D、复分解反应
5.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化 B.一定被还原
C.可能被氧化,也可能被还原 D.以上都不是
6. 根据物质中元素的价态的数值,可以推断物质所具有的性质。下列叙述不正确的是( )
A. 氯酸钾具有氧化性 B. 具有还原性
C. 氯气既有氧化性,又有还原性 D. 不可能具有还原性
7. 下列反应中属于氧化还原反应,但水没有发生氧化还原反应的是( )
A. B.
C. D.
得到 e- ,化合价
发生还原反应
失去 e- ,化合价
发生氧化反应
Zn+Cu2+ = Zn2 + + Cu
e-
e-
G
e-
e-
Cu
C
Cu
CuSO4
溶液
Zn
没有辛勤的汗水,是浇灌不出累累的硕果的。——寄语高一学生
化学1(必修)第2章第三节“氧化剂和还原剂” 第一课时
制作:李斌才 2008.11
[学习目标]
(1)通过分析化学反应中元素化合价的变化,建立氧化还原反应的概念;
(2)通过实验事实和思考,初步理解氧化还原反应的本质是电子转移。
(3)通过“迁移·应用”、“交流·研讨”、“活动·探究”等活动,提高分析、联想、类比、迁移以及概括的能力。
(4)了解氧化—还原反应在工农业生产、日常生活中的应用,认识并理解化学这门学科对提高人类生活质量、促进社会发展的重要作用。
[学习重点]
(1)认识并建立氧化还原反应的概念。
(2)理解氧化还原反应的本质是电子转移。
[学习难点]能从化合价的变化,认识并建立氧化还原反应的概念。
[学习过程]
【温故知新】1.复习初中化学四种基本反应类型: , , , ;
2.回顾初中化学中常用的元素的化合价及 “氢气还原氧化铜”反应中氧化反应
和还原反应 的定义。
【自主学习】
一、氧化还原反应
1.从得失氧角度分析:
如:氢气还原氧化铜:
失去氧,发生了 (填“氧化”或“还原”)反应; 得到氧,发生了 (填“氧化”或“还原”)反应。也就是说,氧化反应和还原反应是 (填“先后”或“同时”)发生的。
[小结]氧化还原反应: 。
(练习)结合初中所学四大基本反应类型,分析以下反应属于哪一种?
2Cu+O2 =2CuO 2Na+Cl2=2NaCl
CaCO3高温CaO+CO2↑ 2KClO3 加热 2KCl+ O2
H2+CuO高温Cu+H2O Fe+Cu2+=Cu+Fe2+
NaCl+AgNO3 =AgCl+NaNO3
(分析)
【知识补充】氧化还原反应与四种基本反应类型的关系
(1)有单质参与的化合反应是氧化还原反应。
(2)有单质生成的分解反应是氧化还原反应。
(3)所有的置换反应都是氧化还原反应。
(4)所有的复分解反应都是非氧化还原反应。
[思考]是否只有得氧失氧的反应才是氧化还原反应?
如果一个反应中没有氧的得失,是否一定不是氧化还原反应呢?
2.从化合价角度分析:
如: 0 +2 -2 0 +1-2 元素化合价升高 被 氧化反应
H2+CuO高温Cu+H2O 元素化合价降低 被 还原反应
0 0 +1-1 元素化合价升高 被 氧化反应
2Na+Cl2=2NaCl 元素化合价降低 被 还原反应
[小结]①、从反应前后元素化合价是否升降看,氧化还原反应是 。
②、氧化反应:物质所含元素化合价 的反应;
还原反应:物质所含元素化合价 的反应。
③、判断一个反应是否为氧化还原反应的依据 。
④.新的化学反应的分类方法依据:
[练习1]下列反应属于氧化还原反应的是( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑ B、CaCO3高温CaO+CO2↑
C、Na2O+H2O=2NaOH D、Mg+2HCl=MgCl2+H2↑
[练习2]课后1
[练习3]金属钠的性质我们已经熟悉,将其露置于空气中,会发生以下变化:第一步,变成Na2O,第二步转化为NaOH,第三步逐渐生成Na2CO3·10 H2O,第四步脱水变成碳酸钠粉末,上述四步属于氧化还原反应的是:
A 第一步 B 第二步 C 第三步 D 第四步
3.从得失电子的角度分析:(氧化还原反应的实质)
阅读课本49页讨论1、2和实验,思考以下问题:
(1)钠与氯之间发生了怎样的变化?(结构-性质)
2Na+Cl2=2NaCl
Na:化合价 , (得或失)电子,被 ,发生 反应;
Cl:化合价 , (得或失)电子,被 ,发生 反应。
(2)实验的现象?指针的偏转说明什么?离子反应如何?
(3)从化合价、得失电子的角度如何分析?
[小结]1、氧化还原反应: ;
2、氧化反应:表现为被氧化的元素化合价 ,其实质是 ;
还原反应:表现为被还原的元素化合价 ,其实质是 。
3、总之,氧化还原的本质就是 。
4.表示方法:
【参考“知识支持”,了解双线桥,单线桥表示法】
双线桥书写步骤:
(1).标出变化了的元素化合价;
(2).箭头总是从反应物指向生成物;
(3).箭头指向同种元素;
(4).标出化合价升、降。
练习: 用双线桥表示该反应的电子得失:2CuO + C == 2Cu + CO2
[练习4]在反应MnO2+4HCl=MnCl2+2H2O+Cl2↑中, 元素化合价升高,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应; 元素化合价降低,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。
[练习5] 下列叙述正确的是( )
A、 在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、 凡有元素化合价升降的化学反应都是氧化还原反应
C、 在氧化还原反应中一定所有的元素化合价都发生变化
D、 氧化还原反应的本质是电子的得失或偏移
[思考]请分析四种基本反应类型的反应与氧化还原反应之间的关系,并试着画出它们之间的交叉分类示意图,然后列举一些具体的化学反应加以说明。(参考课本57页概括整合)
5.作用
[阅读]教材最后一部分了解氧化还原反应在生产、生活中的广泛应用。科学合理的利用氧化还原反应。
【我的收获】请同学们自己总结本节课所学主要内容。然后填写下表:
得氧失氧观点 化合价升降观点 电子转移观点
氧化反应
还原反应
氧化还原的关系
氧化还原反应
说明:1、从得氧失氧观点描述氧化还原反应是不完善的,有其局限性;
2、从化合价升降观点可以判断是否为氧化还原反应(特征表现)。
3、电子转移是氧化还原反应的本质。
[作业]教材习题5。
八反馈练习
1.下列反应中属于氧化还原反应的是 ( )
A.CaCO3高温CaO+CO2↑
B.Na2O+H2O=2NaOH
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑
D.4HNO3(浓)△4NO2↑+O2↑+2H2O
2.下列基本反应类型中,一定是氧化还原反应的是 ( )
A、化合反应 B、分解反应
C、置换反应 D、复分解反应
5.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化 B.一定被还原
C.可能被氧化,也可能被还原 D.以上都不是
6. 根据物质中元素的价态的数值,可以推断物质所具有的性质。下列叙述不正确的是( )
A. 氯酸钾具有氧化性 B. 具有还原性
C. 氯气既有氧化性,又有还原性 D. 不可能具有还原性
7. 下列反应中属于氧化还原反应,但水没有发生氧化还原反应的是( )
A. B.
C. D.
得到 e- ,化合价
发生还原反应
失去 e- ,化合价
发生氧化反应
Zn+Cu2+ = Zn2 + + Cu
e-
e-
G
e-
e-
Cu
C
Cu
CuSO4
溶液
Zn
没有辛勤的汗水,是浇灌不出累累的硕果的。——寄语高一学生
