专题1揭示物质结构的奥秘教学案苏教版
图片预览


文档简介
《物质结构与性质》
课标要求
在本课程模块中,我们将从原子、分子水平上认识物质构成的规律,以微粒之间不同的作用力为线索,侧重研究不同类型物质的有关性质,帮助高中学生进一步丰富物质结构的知识,提高分析问题和解决问题的能力。
通过本课程模块的学习,学生应主要在以下几个方面得到发展:
1.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,增强学习化学的兴趣;
2.进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系;
3.能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质;
4.在理论分析和实验探究过程中学习辩证唯物主义的方法论,逐步形成科学的价值观。
课时划分
《物质结构与性质》…………………………………………………………32+4课时
专题1 揭示物质结构的奥秘……………………………………1课时
专题2 原子结构与元素的性质…………………………………6+1课时
第一单元 原子核外电子的运动…………………2+1课时
第二单元 元素性质的递变规律…………………3课时
专题3 微粒间作用力与物质性质………………………………13+2课时
第一单元 金属键 金属晶体……………………2课时
第二单元 离子键 离子晶体……………………2课时
第三单元 共价键 原子晶体……………………4+1课时
第四单元 分子间作用力 分子晶体……………3+1课时
专题4 分子空间结构与物质性质………………………………7+1课时
第一单元 分子构型与物质的性质………………3+1课时
第二单元 配合物是如何形成的…………………3课时
专题5 物质结构的探索无止境…………………………………1课时
专题1 揭示物质结构的奥秘
【课标要求】
1.了解人类探索物质结构的历史与价值,认识在分子等层次研究物质的意义。
2.知道物质是由微粒构成的,了解研究物质结构的基本方法和实验手段。
3.初步认识物质的结构与性质之间的关系,知道物质结构的研究有助于发现具有预期性质的新物质。
【教材内容展示】
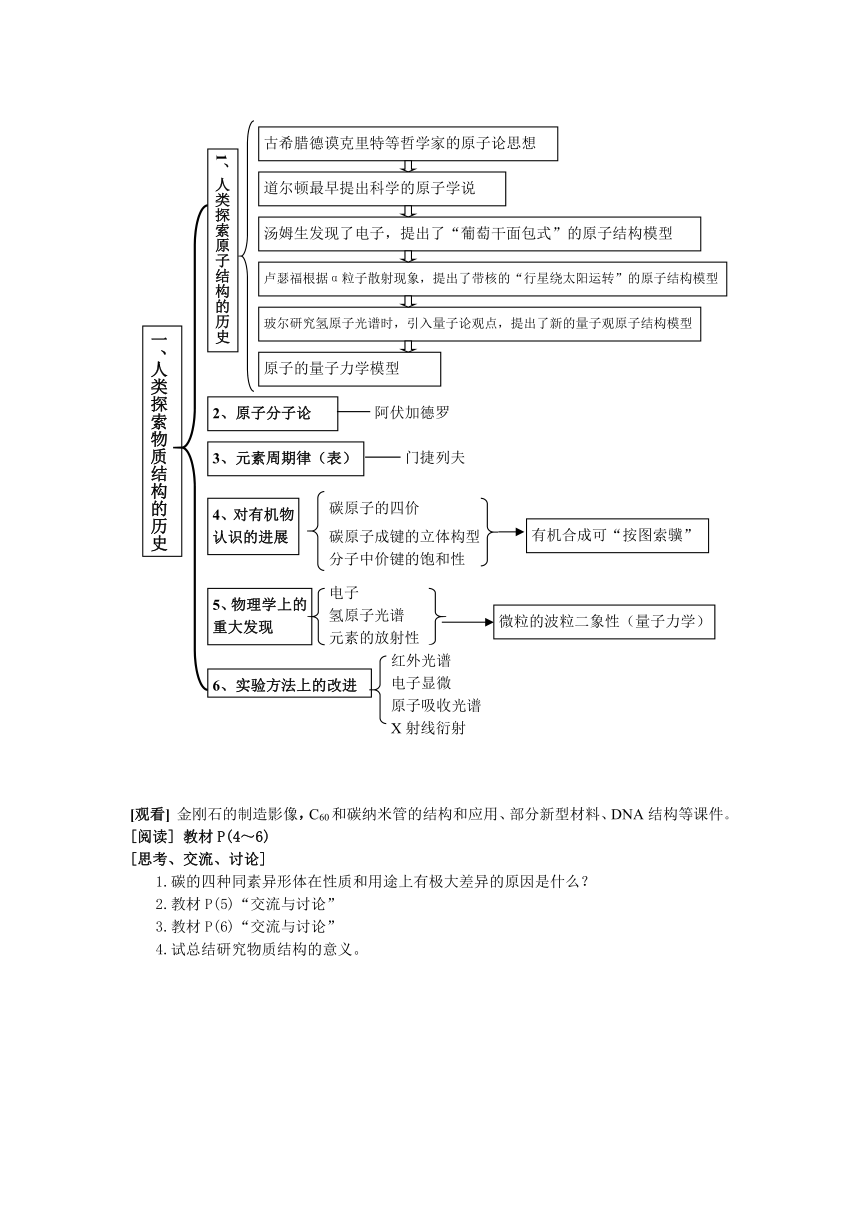
1.人类探索物质结构的历史:原子学说、原子分子论、元素周期律的发现、对有机物认识的进展、波粒二象性、量子化学、实验方法上的改进。
2.研究物质结构的意义:揭示物质的结构与性能的关系、根据结构预测物质性质、合成或分离预期性质的新材料、从分子水平探索生命现象、研究结构实现绿色合成,促进社会可持续发展。
【教学内容选取建议】
1.学生对“探索物质结构的历史与意义”已经不很系统的知道一些,加之教材所提及的也很简略,建议对这部分教学的重点应放在激发学生学习的兴趣上。可适当补充诸如:某些科学家趣事,金刚石的制造影像,以及有关高科技、新材料、先进仪器的课件等。
2.应把专题2第一单元中“人类对原子结构的认识历史”提上来讲。这样既避免了重复,又使学习“历史”完整。
3.建议回忆已学过的原子结构的基础知识,为下一节的学习做好铺垫。
专题1 揭示物质结构的奥秘学案
【课标要求】
1.了解人类探索物质结构的历史;
2.了解研究物质结构的意义;
3.掌握原子结构的基础知识。
[思考]
1.大千世界中的物质是由什么构成的?
2.如何才能获得具有优异性能的新物质?
一、人类探索物质结构的历史
[阅读]
教材P(2~3)——人类探索物质结构的历史;P(8~9)——人类对原子结构的认识
[交流与讨论]
3.是谁最早提出科学的原子概念?人们通常称的原子之父又是谁?
4.原子学说的基本要点是什么?它能否解释“1体积的氯气和1体积的氢气生成2体积的氯化氢”?试分析原子学说缺陷所在。
5.是谁最早提出了分子的概念?原子分子论的基本要点是什么?基本要点是什么?
6.俄国化学家________________总结出元素周期律:元素的性质随着______的变化而呈现周期性变的化。他排出的第一张元素周期表包含_____种元素。元素周期律从理论上指导了化学元素的发现和应用。
7.19世纪中叶以后,对有机物认识有何进展?
8.物理学上的那些重大发现提供了分析原子结构和分子结构的理论基础?
9.研究原子、分子和晶体结构的实验方法有何发展?
10.人类对原子结构的认识,每前进一步都是建立在_______的基础上的,最有影响的两位物理学家是________和_________,前者是通过________________实验提出原子结构的有核模型,后者研究了______________后,大胆地引入量子论观点,提出了新的原子结构模型。
11.原子结构模型的演变历史说明了什么科学道理?
[观看] 金刚石的制造影像,C60和碳纳米管的结构和应用、部分新型材料、DNA结构等课件。
[阅读] 教材P(4~6)
[思考、交流、讨论]
1.碳的四种同素异形体在性质和用途上有极大差异的原因是什么?
2.教材P(5)“交流与讨论”
3.教材P(6)“交流与讨论”
4.试总结研究物质结构的意义。
[思考]
1.在《必修1》中学过原子结构的初步知识,你能否较为具体的说一说原子的组成及各部分的特征?存在那些等量关系?
3.元素、核素、同位素三者有何异同?
三、原子结构的基础知识
3、 三素”比较:
元素——具有相同核电荷数(即核内质子数)的一类原子的总称。元素的种类由质子数决定,与中子数、电子数无关。如:11H、12H+、T、D2 是氢元素的四种不同粒子。
核素——具有一定质子数和一定中子数的一种原子。核素即原子,其种类由质子数和中子数决定。绝大多数元素都存在不同种核素,但有些元素只有一种核素。
同位素——质子数相同,中子数(或质量数)不同的原子的互称。
1 常见同位素举例
氕(11H)、氘(重氢,D或12H)、氚(超重氢,T或31H),12C、13C、14C,16O、17O、18O,3517Cl、3717Cl,23492U、23592U、23892U。
2 同位素是同种元素的不同原子,不同元素的原子不是同位素。
3 同位素的物理性质不同,但它们的化学性质几乎完全相同。
4 同位素的不同原子构成的单质是化学性质几乎相同的不同单质。
5 同位素构成的化合物是不同的化合物,如H2O、D2O、T2O,其物理性质不同,化学性质几乎相同。
6 天然稳定存在的同位素,无论游离态还是化合态,各同位素所占的原子分数一般不变。
7 元素的相对原子质量是这种元素的各同位素的原子质量的平均值。
8 如果用各同位素的质量数代替相对原子质量进行以上计算,则得到元素的近似相对原子质量。
9 同位素的应用较广,可以利用12H、31H制造氢弹,利用23592U制造原子弹和作核反应堆的燃料,利用放射性同位素给金属制品探伤、抑制马铃薯和洋葱等发芽,延长贮存保鲜期。在医疗方面,可以利用某些同位素放射出的射线治疗肿瘤等。
[练习]
1.在物质结构研究的历史上,首先提出原子始一个实心球体的是( )
A. 汤姆生 B. 卢瑟福 C. 道尔顿 D. 玻尔
2.在1911年前后,物理学家卢瑟福把一束高速运动的α粒子(质量数为4的带2个单位正电荷的氦原子核),射向一片极薄的金箔。他惊奇的发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列成的金箔,竟为大多数α粒子畅通无阻得通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。根据上述实验现象能的出关于金箔中Au原子结构的一些结论,试写出其中的三点:
A __________________________________________;
B___________________________________________;
C___________________________________________。
3. 13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kuit WU Thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A. 13C与15N有相同的中子数 B. 13C与C60互为同素异形体
C. 15N与14N互为同位素 D. 15N的核外电子数与中子数相同
4. 已知氧元素有三种稳定同位素:168O、178O、188O,氧气中存在几种氧分子?它们的近似相对分子质量有几种?
5. 有关元素周期表的叙述正确的是( )
A.元素周期表是由苏联化学家门捷列夫初绘
B.门捷列夫是在梦中想到周期表
C.最初的元素周期表是按原子内质子数由少到多排的
D.初排元素周期表时共有元素92种
[课外阅读]
+|
一、人类探索物质结构的历史
1、人类探索原子结构的历史
古希腊德谟克里特等哲学家的原子论思想
道尔顿最早提出科学的原子学说
汤姆生发现了电子,提出了“葡萄干面包式”的原子结构模型
卢瑟福根据α粒子散射现象,提出了带核的“行星绕太阳运转”的原子结构模型
玻尔研究氢原子光谱时,引入量子论观点,提出了新的量子观原子结构模型
原子的量子力学模型
2、原子分子论
阿伏加德罗
3、元素周期律(表)
门捷列夫
4、对有机物认识的进展
碳原子的四价
碳原子成键的立体构型
分子中价键的饱和性
有机合成可“按图索骥”
5、物理学上的重大发现
电子
氢原子光谱
元素的放射性
微粒的波粒二象性(量子力学)
6、实验方法上的改进
红外光谱
电子显微
原子吸收光谱
X射线衍射
二、研究物质结构的意义
1、结构决定性质、性质体现结构
如
2、根据结构预测物质性质
3、合成或分离预期性质的新材料
4、从分子水平探索生命现象
5、研究结构实现绿色合成,促进社会可持续发展
碳的四种同素异形体
金刚石
石墨
C60
碳纳米管
结构不同,性质不同
1、原子
原子核
核外电子
组成
特征
质子
①质量数约为1,带1个单位正电荷
②质子数=核电荷数=原子序数=核外电子数
③是元素分类本质依据
中子
①质量数为1,不带电
②中子数=质量数-质子数(N=A-Z)
③同种元素,中子数不同则形成同位素
1 位于原子中心,体积小,质量比重大——由于电子质量小,原子的质量主要集中在核上
2 化学变化中核不变
电子特征
1 体积小,质量约为质子质量的1/1836,带1个单位负电荷,负电荷数=核所带正电核数,故原子不显电性
2 核外电子数=核电核数=原子序数
3 主族元素的化学性质主要决定于最外层电子数
位置:在原子核外分层排布
2、重要关系式:
核电荷数=核内质子数=核外电子数=原子序数
质量数(A)=质子数(Z)+中子数(N)
离子电荷=质子数-核外电子数
质子数(Z)=阳离子的核外电子数+阳离子的电荷数
质子数(Z)=阴离子的核外电子数-阴离子的电荷数
质量数(A)≈该同位素的相对原子质量
中各字母所代表的意义是什么?
2. n
A m
Z p
1.道尔顿不是那种天资卓著的人,但他勤奋、刻苦、百折不挠。以他做气象观测记录为例,从21岁直到他临终的前一天,他从未停过气象纪录。在他生命的最后一天,他仍顽强的记下了那天的气压和温度数据,在“微雨”两字的旁边,是一大滴的墨迹,说明此时的他实际上已经很难控制自己的行动了。
2.门捷列夫1834年生于俄国的西伯利亚西部的一个小城镇——托波尔斯克。父亲是个懂得教育规律的中学校长,母亲是个刚强能干的妇女,有一个良好的家庭环境,从小对事物有广泛的兴趣和惊人的探索精神。
当他十三岁的时候,父亲病故了,母亲担负起繁重的抚养十七个孩子的任务。1849年中学毕业后,母亲千里迢迢送他去莫斯科上大学,但未能如愿,费尽周折,1850年才考取了彼得堡师范学院的物理系。1855年门捷列夫以优异的成绩完成了学业,次年获得“物理和化学硕士”学位。1859年到德国海得尔堡深造,受到德国的化学家罗的特、本生和物理学家基尔霍夫的教导,学到大量化学和物理学知识。1865年获得博士学位,1867年怀着报效祖国的意愿回到了彼得堡大学,成为彼得堡大学最年轻的教授。在这里他一直工作到1890年辞职,1907年1月20日因心肌梗塞与世长辞了。
+|
课标要求
在本课程模块中,我们将从原子、分子水平上认识物质构成的规律,以微粒之间不同的作用力为线索,侧重研究不同类型物质的有关性质,帮助高中学生进一步丰富物质结构的知识,提高分析问题和解决问题的能力。
通过本课程模块的学习,学生应主要在以下几个方面得到发展:
1.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,增强学习化学的兴趣;
2.进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系;
3.能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质;
4.在理论分析和实验探究过程中学习辩证唯物主义的方法论,逐步形成科学的价值观。
课时划分
《物质结构与性质》…………………………………………………………32+4课时
专题1 揭示物质结构的奥秘……………………………………1课时
专题2 原子结构与元素的性质…………………………………6+1课时
第一单元 原子核外电子的运动…………………2+1课时
第二单元 元素性质的递变规律…………………3课时
专题3 微粒间作用力与物质性质………………………………13+2课时
第一单元 金属键 金属晶体……………………2课时
第二单元 离子键 离子晶体……………………2课时
第三单元 共价键 原子晶体……………………4+1课时
第四单元 分子间作用力 分子晶体……………3+1课时
专题4 分子空间结构与物质性质………………………………7+1课时
第一单元 分子构型与物质的性质………………3+1课时
第二单元 配合物是如何形成的…………………3课时
专题5 物质结构的探索无止境…………………………………1课时
专题1 揭示物质结构的奥秘
【课标要求】
1.了解人类探索物质结构的历史与价值,认识在分子等层次研究物质的意义。
2.知道物质是由微粒构成的,了解研究物质结构的基本方法和实验手段。
3.初步认识物质的结构与性质之间的关系,知道物质结构的研究有助于发现具有预期性质的新物质。
【教材内容展示】
1.人类探索物质结构的历史:原子学说、原子分子论、元素周期律的发现、对有机物认识的进展、波粒二象性、量子化学、实验方法上的改进。
2.研究物质结构的意义:揭示物质的结构与性能的关系、根据结构预测物质性质、合成或分离预期性质的新材料、从分子水平探索生命现象、研究结构实现绿色合成,促进社会可持续发展。
【教学内容选取建议】
1.学生对“探索物质结构的历史与意义”已经不很系统的知道一些,加之教材所提及的也很简略,建议对这部分教学的重点应放在激发学生学习的兴趣上。可适当补充诸如:某些科学家趣事,金刚石的制造影像,以及有关高科技、新材料、先进仪器的课件等。
2.应把专题2第一单元中“人类对原子结构的认识历史”提上来讲。这样既避免了重复,又使学习“历史”完整。
3.建议回忆已学过的原子结构的基础知识,为下一节的学习做好铺垫。
专题1 揭示物质结构的奥秘学案
【课标要求】
1.了解人类探索物质结构的历史;
2.了解研究物质结构的意义;
3.掌握原子结构的基础知识。
[思考]
1.大千世界中的物质是由什么构成的?
2.如何才能获得具有优异性能的新物质?
一、人类探索物质结构的历史
[阅读]
教材P(2~3)——人类探索物质结构的历史;P(8~9)——人类对原子结构的认识
[交流与讨论]
3.是谁最早提出科学的原子概念?人们通常称的原子之父又是谁?
4.原子学说的基本要点是什么?它能否解释“1体积的氯气和1体积的氢气生成2体积的氯化氢”?试分析原子学说缺陷所在。
5.是谁最早提出了分子的概念?原子分子论的基本要点是什么?基本要点是什么?
6.俄国化学家________________总结出元素周期律:元素的性质随着______的变化而呈现周期性变的化。他排出的第一张元素周期表包含_____种元素。元素周期律从理论上指导了化学元素的发现和应用。
7.19世纪中叶以后,对有机物认识有何进展?
8.物理学上的那些重大发现提供了分析原子结构和分子结构的理论基础?
9.研究原子、分子和晶体结构的实验方法有何发展?
10.人类对原子结构的认识,每前进一步都是建立在_______的基础上的,最有影响的两位物理学家是________和_________,前者是通过________________实验提出原子结构的有核模型,后者研究了______________后,大胆地引入量子论观点,提出了新的原子结构模型。
11.原子结构模型的演变历史说明了什么科学道理?
[观看] 金刚石的制造影像,C60和碳纳米管的结构和应用、部分新型材料、DNA结构等课件。
[阅读] 教材P(4~6)
[思考、交流、讨论]
1.碳的四种同素异形体在性质和用途上有极大差异的原因是什么?
2.教材P(5)“交流与讨论”
3.教材P(6)“交流与讨论”
4.试总结研究物质结构的意义。
[思考]
1.在《必修1》中学过原子结构的初步知识,你能否较为具体的说一说原子的组成及各部分的特征?存在那些等量关系?
3.元素、核素、同位素三者有何异同?
三、原子结构的基础知识
3、 三素”比较:
元素——具有相同核电荷数(即核内质子数)的一类原子的总称。元素的种类由质子数决定,与中子数、电子数无关。如:11H、12H+、T、D2 是氢元素的四种不同粒子。
核素——具有一定质子数和一定中子数的一种原子。核素即原子,其种类由质子数和中子数决定。绝大多数元素都存在不同种核素,但有些元素只有一种核素。
同位素——质子数相同,中子数(或质量数)不同的原子的互称。
1 常见同位素举例
氕(11H)、氘(重氢,D或12H)、氚(超重氢,T或31H),12C、13C、14C,16O、17O、18O,3517Cl、3717Cl,23492U、23592U、23892U。
2 同位素是同种元素的不同原子,不同元素的原子不是同位素。
3 同位素的物理性质不同,但它们的化学性质几乎完全相同。
4 同位素的不同原子构成的单质是化学性质几乎相同的不同单质。
5 同位素构成的化合物是不同的化合物,如H2O、D2O、T2O,其物理性质不同,化学性质几乎相同。
6 天然稳定存在的同位素,无论游离态还是化合态,各同位素所占的原子分数一般不变。
7 元素的相对原子质量是这种元素的各同位素的原子质量的平均值。
8 如果用各同位素的质量数代替相对原子质量进行以上计算,则得到元素的近似相对原子质量。
9 同位素的应用较广,可以利用12H、31H制造氢弹,利用23592U制造原子弹和作核反应堆的燃料,利用放射性同位素给金属制品探伤、抑制马铃薯和洋葱等发芽,延长贮存保鲜期。在医疗方面,可以利用某些同位素放射出的射线治疗肿瘤等。
[练习]
1.在物质结构研究的历史上,首先提出原子始一个实心球体的是( )
A. 汤姆生 B. 卢瑟福 C. 道尔顿 D. 玻尔
2.在1911年前后,物理学家卢瑟福把一束高速运动的α粒子(质量数为4的带2个单位正电荷的氦原子核),射向一片极薄的金箔。他惊奇的发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列成的金箔,竟为大多数α粒子畅通无阻得通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。根据上述实验现象能的出关于金箔中Au原子结构的一些结论,试写出其中的三点:
A __________________________________________;
B___________________________________________;
C___________________________________________。
3. 13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kuit WU Thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A. 13C与15N有相同的中子数 B. 13C与C60互为同素异形体
C. 15N与14N互为同位素 D. 15N的核外电子数与中子数相同
4. 已知氧元素有三种稳定同位素:168O、178O、188O,氧气中存在几种氧分子?它们的近似相对分子质量有几种?
5. 有关元素周期表的叙述正确的是( )
A.元素周期表是由苏联化学家门捷列夫初绘
B.门捷列夫是在梦中想到周期表
C.最初的元素周期表是按原子内质子数由少到多排的
D.初排元素周期表时共有元素92种
[课外阅读]
+|
一、人类探索物质结构的历史
1、人类探索原子结构的历史
古希腊德谟克里特等哲学家的原子论思想
道尔顿最早提出科学的原子学说
汤姆生发现了电子,提出了“葡萄干面包式”的原子结构模型
卢瑟福根据α粒子散射现象,提出了带核的“行星绕太阳运转”的原子结构模型
玻尔研究氢原子光谱时,引入量子论观点,提出了新的量子观原子结构模型
原子的量子力学模型
2、原子分子论
阿伏加德罗
3、元素周期律(表)
门捷列夫
4、对有机物认识的进展
碳原子的四价
碳原子成键的立体构型
分子中价键的饱和性
有机合成可“按图索骥”
5、物理学上的重大发现
电子
氢原子光谱
元素的放射性
微粒的波粒二象性(量子力学)
6、实验方法上的改进
红外光谱
电子显微
原子吸收光谱
X射线衍射
二、研究物质结构的意义
1、结构决定性质、性质体现结构
如
2、根据结构预测物质性质
3、合成或分离预期性质的新材料
4、从分子水平探索生命现象
5、研究结构实现绿色合成,促进社会可持续发展
碳的四种同素异形体
金刚石
石墨
C60
碳纳米管
结构不同,性质不同
1、原子
原子核
核外电子
组成
特征
质子
①质量数约为1,带1个单位正电荷
②质子数=核电荷数=原子序数=核外电子数
③是元素分类本质依据
中子
①质量数为1,不带电
②中子数=质量数-质子数(N=A-Z)
③同种元素,中子数不同则形成同位素
1 位于原子中心,体积小,质量比重大——由于电子质量小,原子的质量主要集中在核上
2 化学变化中核不变
电子特征
1 体积小,质量约为质子质量的1/1836,带1个单位负电荷,负电荷数=核所带正电核数,故原子不显电性
2 核外电子数=核电核数=原子序数
3 主族元素的化学性质主要决定于最外层电子数
位置:在原子核外分层排布
2、重要关系式:
核电荷数=核内质子数=核外电子数=原子序数
质量数(A)=质子数(Z)+中子数(N)
离子电荷=质子数-核外电子数
质子数(Z)=阳离子的核外电子数+阳离子的电荷数
质子数(Z)=阴离子的核外电子数-阴离子的电荷数
质量数(A)≈该同位素的相对原子质量
中各字母所代表的意义是什么?
2. n
A m
Z p
1.道尔顿不是那种天资卓著的人,但他勤奋、刻苦、百折不挠。以他做气象观测记录为例,从21岁直到他临终的前一天,他从未停过气象纪录。在他生命的最后一天,他仍顽强的记下了那天的气压和温度数据,在“微雨”两字的旁边,是一大滴的墨迹,说明此时的他实际上已经很难控制自己的行动了。
2.门捷列夫1834年生于俄国的西伯利亚西部的一个小城镇——托波尔斯克。父亲是个懂得教育规律的中学校长,母亲是个刚强能干的妇女,有一个良好的家庭环境,从小对事物有广泛的兴趣和惊人的探索精神。
当他十三岁的时候,父亲病故了,母亲担负起繁重的抚养十七个孩子的任务。1849年中学毕业后,母亲千里迢迢送他去莫斯科上大学,但未能如愿,费尽周折,1850年才考取了彼得堡师范学院的物理系。1855年门捷列夫以优异的成绩完成了学业,次年获得“物理和化学硕士”学位。1859年到德国海得尔堡深造,受到德国的化学家罗的特、本生和物理学家基尔霍夫的教导,学到大量化学和物理学知识。1865年获得博士学位,1867年怀着报效祖国的意愿回到了彼得堡大学,成为彼得堡大学最年轻的教授。在这里他一直工作到1890年辞职,1907年1月20日因心肌梗塞与世长辞了。
+|
