《物质的量》
图片预览







文档简介
课件23张PPT。2019/2/271白城师范学院化学系
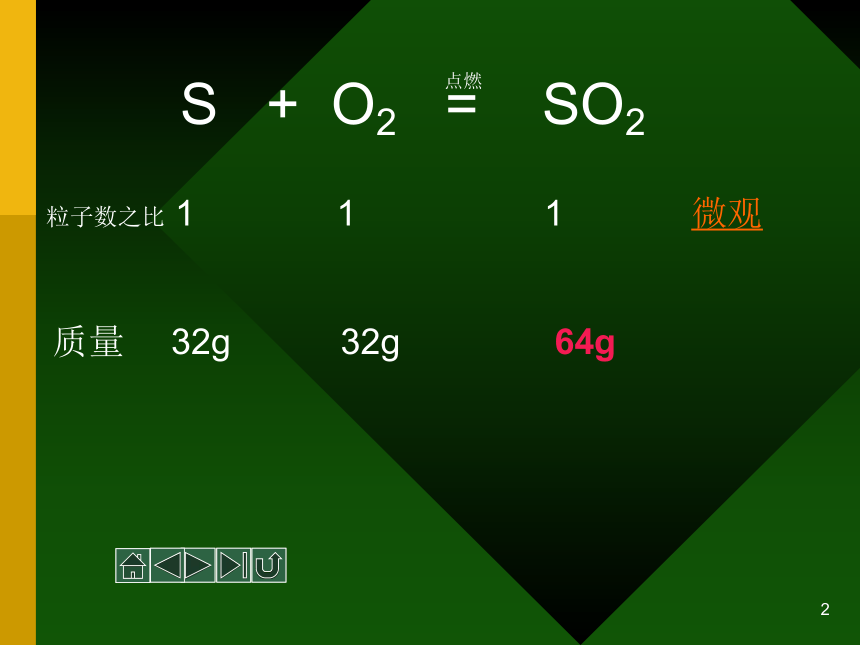
04级1班:陈同天1.2 化学计量在实验中的应用2 S + O2 = SO2 点燃粒子数之比 1 1 1 微观质量 64g 32g 32g3是什么将微观粒子与宏观物体联系起来的呢??4 物质的量 5物质的量(n)6表示含有一定数目粒子集体的物理量71、物质的量这四个字可以拆吗,可以将其理解成 物质的质量或物质的数量吗?2、定义中的“粒子”是指微观粒子还是宏观粒子呢?3、物质的量描述的是粒子集体的多少还是粒子的多少呢?8物质的量是一个专用名词,不能拆开理解;也不能理解成物质的质量和物质的数量。9“粒子”是指微观粒子(分子、原子、离子、电子等),在使用物质的量时要用化学式指明粒子种类或名称。10物质的量描述的是粒子集体的数目而不是粒子的多少。111、物质的量是一个专用名词,不能拆开理解;也不能理解成物质的质量和物质的数量。2、“粒子”是指微观粒子(分子、原子、离子、电子等)注意:3、在使用物质的量时要用化学式指明粒子种类或名称。4、物质的量描述的是粒子集体的数目而不是粒子的多少。12 摩尔 mol13 含有与0.012kg12C中所含碳原子数(约为6.02X1023个)相同的任何粒子集体计量为1mol14阿伏加德罗常数(NA):科学上把0.012kg12C中所含碳原子数称为阿伏加德罗常数。
阿伏加德罗常数经过试验已测得比较准确的数值,一般采用6.02×1023mol-1这个近似的数值151molC中约含有_________个C
1molH2O中约含有_________个H2O
1molSO42-中约含有_________个SO42-
1mol e-中约含有_________个e-
6.02×10236.02×10236.02×10236.02×102316O2的物质的量 阿伏加德罗常数 粒子数
1mol × 6.02×1023 mol-1 =____________
0.5mol × 6.02×1023 mol-1 =____________
2mol × 6.02×1023 mol-1 =____________
n × NA =__________6.02×10233.01×10231.204×1023 N17n = ─
或者:
物质的量=粒子数/阿伏加德罗常数N
NA18例题一在0.5molO2中含有的O2的分子数目是多少?
解:O2的分子数为N = n × NA = 0.5 mol × 6.02 ×1023个/mol = 3.01 × 1023个 答:O2的分子数为3.01 × 1023个19例题二:在0.5molO2中含有的O的原子数目是多少?
解:O2的O原子数为N = n ×2 × NA = 0.5 mol ×2× 6.02 ×1023个/mol = 6.02 × 1023个 答:O2的O原子数为6.02 × 1023个20练习一:在下列叙述中正确的事( )
1mol氮
5mol原子氧
0.1mol水分子含有6.02×1023个水分子321练习二: 2molH2SO4中氧原子的物质的量为____mol,氢原子的数目为________个82.408 ×1024 22小结: 物质的量是国际单位制中七个基本单位之一,不能拆开写也不能理解成物质的质量和物质的数量,它描述的是微观粒子集体的多少,使用时要指明粒子的种类. 23下课了制作:陈同天
指导:尚老师
白城师范学院化学系!
04级1班:陈同天1.2 化学计量在实验中的应用2 S + O2 = SO2 点燃粒子数之比 1 1 1 微观质量 64g 32g 32g3是什么将微观粒子与宏观物体联系起来的呢??4 物质的量 5物质的量(n)6表示含有一定数目粒子集体的物理量71、物质的量这四个字可以拆吗,可以将其理解成 物质的质量或物质的数量吗?2、定义中的“粒子”是指微观粒子还是宏观粒子呢?3、物质的量描述的是粒子集体的多少还是粒子的多少呢?8物质的量是一个专用名词,不能拆开理解;也不能理解成物质的质量和物质的数量。9“粒子”是指微观粒子(分子、原子、离子、电子等),在使用物质的量时要用化学式指明粒子种类或名称。10物质的量描述的是粒子集体的数目而不是粒子的多少。111、物质的量是一个专用名词,不能拆开理解;也不能理解成物质的质量和物质的数量。2、“粒子”是指微观粒子(分子、原子、离子、电子等)注意:3、在使用物质的量时要用化学式指明粒子种类或名称。4、物质的量描述的是粒子集体的数目而不是粒子的多少。12 摩尔 mol13 含有与0.012kg12C中所含碳原子数(约为6.02X1023个)相同的任何粒子集体计量为1mol14阿伏加德罗常数(NA):科学上把0.012kg12C中所含碳原子数称为阿伏加德罗常数。
阿伏加德罗常数经过试验已测得比较准确的数值,一般采用6.02×1023mol-1这个近似的数值151molC中约含有_________个C
1molH2O中约含有_________个H2O
1molSO42-中约含有_________个SO42-
1mol e-中约含有_________个e-
6.02×10236.02×10236.02×10236.02×102316O2的物质的量 阿伏加德罗常数 粒子数
1mol × 6.02×1023 mol-1 =____________
0.5mol × 6.02×1023 mol-1 =____________
2mol × 6.02×1023 mol-1 =____________
n × NA =__________6.02×10233.01×10231.204×1023 N17n = ─
或者:
物质的量=粒子数/阿伏加德罗常数N
NA18例题一在0.5molO2中含有的O2的分子数目是多少?
解:O2的分子数为N = n × NA = 0.5 mol × 6.02 ×1023个/mol = 3.01 × 1023个 答:O2的分子数为3.01 × 1023个19例题二:在0.5molO2中含有的O的原子数目是多少?
解:O2的O原子数为N = n ×2 × NA = 0.5 mol ×2× 6.02 ×1023个/mol = 6.02 × 1023个 答:O2的O原子数为6.02 × 1023个20练习一:在下列叙述中正确的事( )
1mol氮
5mol原子氧
0.1mol水分子含有6.02×1023个水分子321练习二: 2molH2SO4中氧原子的物质的量为____mol,氢原子的数目为________个82.408 ×1024 22小结: 物质的量是国际单位制中七个基本单位之一,不能拆开写也不能理解成物质的质量和物质的数量,它描述的是微观粒子集体的多少,使用时要指明粒子的种类. 23下课了制作:陈同天
指导:尚老师
白城师范学院化学系!
