原电池原理及应用(江苏省徐州市邳州市)
图片预览




文档简介
课件22张PPT。第二单元
化学能与电能的转化
第一节 原电池的工作原理
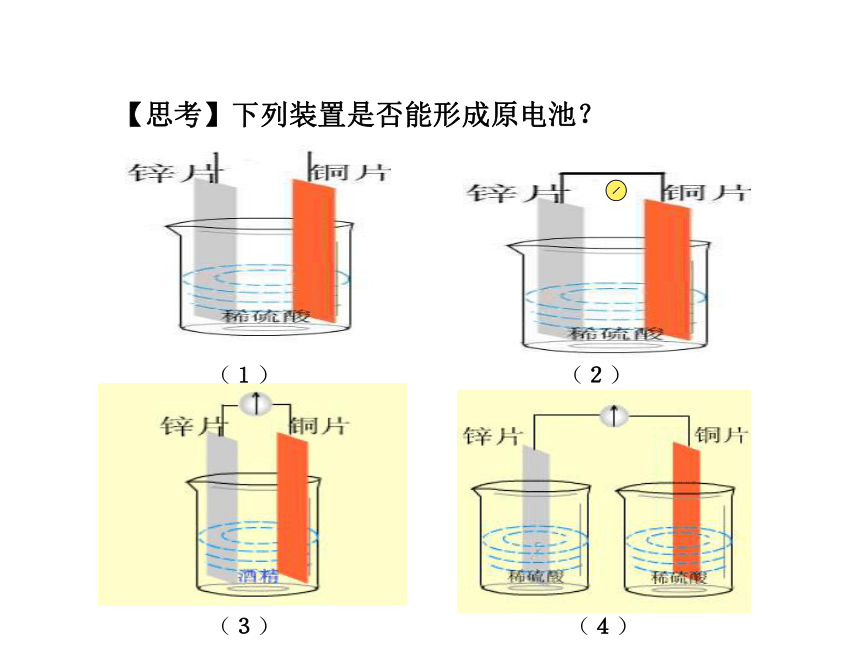
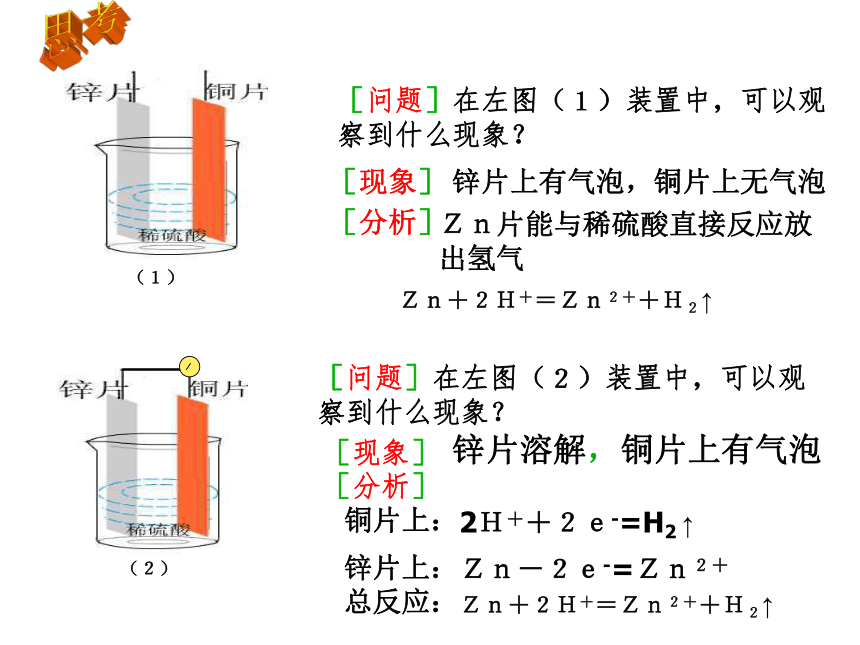
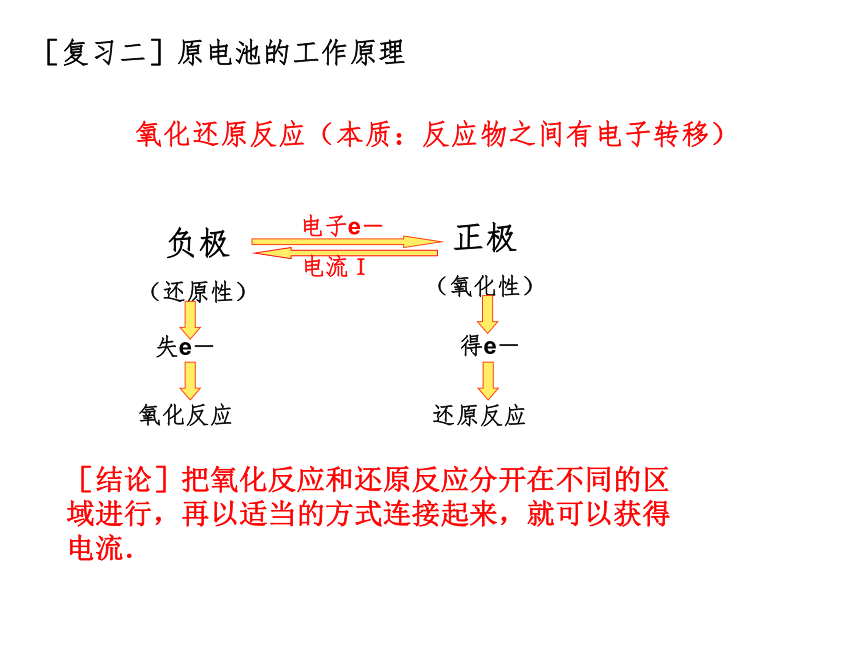
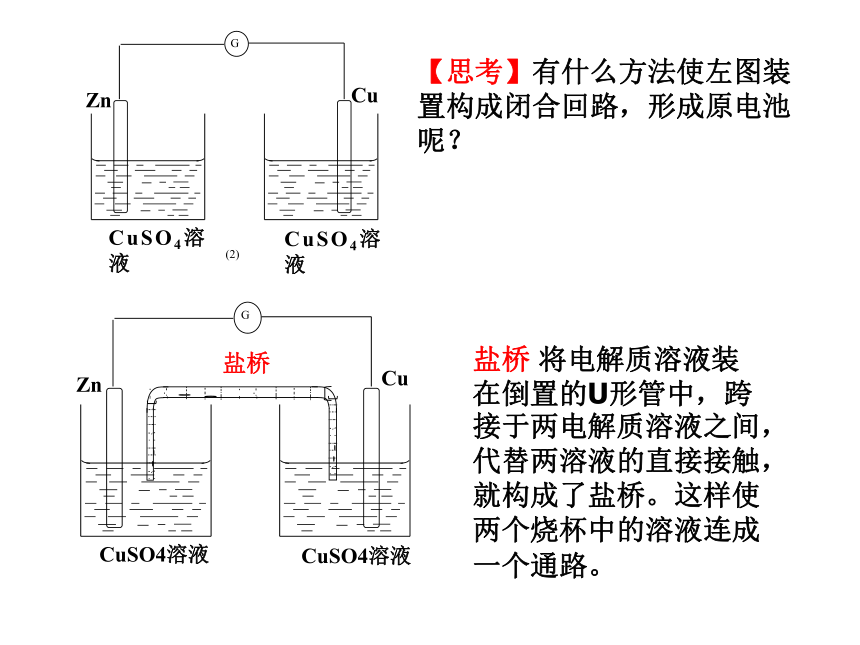
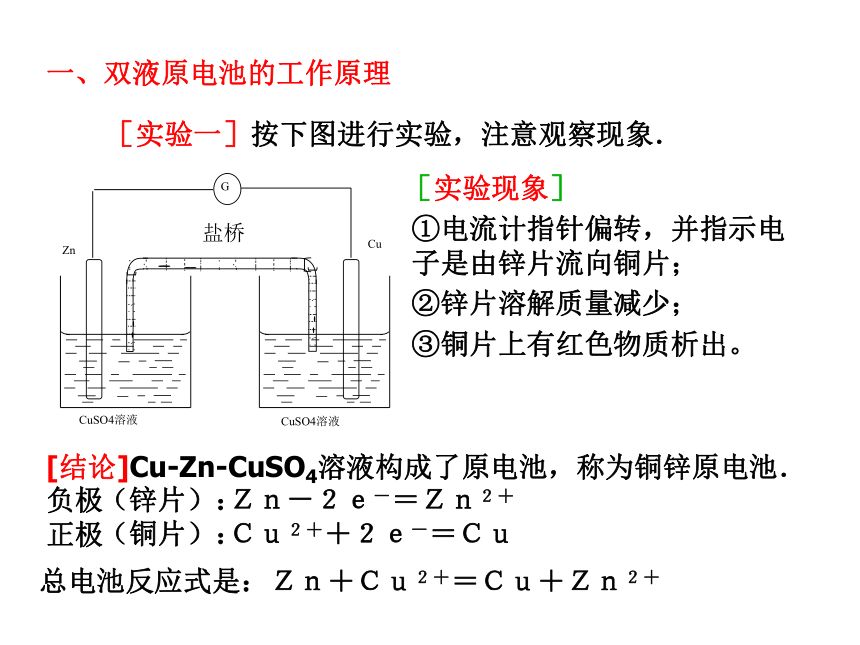
【思考】下列装置是否能形成原电池?(1)(2)(3)(4)【复习一 】构成原电池的条件:1、有两种活动性不同的金属(或金属与非金属)作电极。2、电极材料均插入电解质溶液中(能发生氧化还原反应)。3、两极相连形成闭合电路。两极一液一连线负极(活泼金属):正极(较不活泼金属做或非金属):电子流出的一极、发生氧化反应电子流入的一极、发生还原反应[问题]在左图(1)装置中,可以观察到什么现象?[现象](1)(2)[问题]在左图(2)装置中,可以观察到什么现象?[现象][分析]Zn片能与稀硫酸直接反应放出氢气Zn+2H+=Zn2++H2↑[分析]铜片上:2H++2e-=H2 ↑锌片上:Zn-2e-=Zn2+总反应:Zn+2H+=Zn2++H2↑思考锌片上有气泡,铜片上无气泡锌片溶解,铜片上有气泡[复习二]原电池的工作原理氧化还原反应(本质:反应物之间有电子转移)[结论]把氧化反应和还原反应分开在不同的区域进行,再以适当的方式连接起来,就可以获得电流.【思考】有什么方法使左图装置构成闭合回路,形成原电池呢?盐桥 将电解质溶液装在倒置的U形管中,跨接于两电解质溶液之间,代替两溶液的直接接触,就构成了盐桥。这样使两个烧杯中的溶液连成一个通路。 [实验一]按下图进行实验,注意观察现象.[实验现象]②锌片溶解质量减少;③铜片上有红色物质析出。[结论]Cu-Zn-CuSO4溶液构成了原电池,称为铜锌原电池.
负极
正极(锌片):(铜片):Zn-2e-=Zn2+Cu2++2e-=Cu①电流计指针偏转,并指示电子是由锌片流向铜片;总电池反应式是:Zn+Cu2+=Cu+Zn2+一、双液原电池的工作原理[实验二]继续观察实验一装置中电流计电流强度随时间延续的情况,以及锌片表面的变化。 实验现象:指针偏转角度渐渐减少,同时锌片表面有铜 析出。讨论:如何设法阻止溶液中的Cu2+在负极锌表面还原以及能使该装置原电池得到持续、稳定的电流呢?[设想]若把装置中左烧杯中的CuSO4溶液换成ZnSO4溶液可以吗? [实验三]教材P12“实验1-9” 实验现象:①盐桥存在时电流计指针偏转,且指针偏转角度随时间的延续几乎保持不变;②Zn片溶解,无红色物质析出,Cu片上有红色物质析出;③取出盐桥电流计指针回到零点。 实验结论:Zn—Cu—ZnSO4溶液—CuSO4溶液—盐桥构成了原电池(双液原电池),能产生持续、稳定的电流;取出盐桥时没有电流产生,不能形成原电池.一、双液原电池的工作原理1、构造特点:由两个半电池组成,每个半电池中的电极与电解质溶液互不反应,电池反应的还原剂与氧化剂分别位于两个半电池中,中间通过盐桥连接形成闭合回路。2、电极反应:负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Cu):Cu2++2e-=Cu(还原反应)电池反应:Zn+Cu2+=Zn2++Cu3、电子、电流的流向外电路:电子由负极(Zn片)流向正极(Cu片);电流由正极(Cu片)流向负极(Zn片);内电路:阳离子移向正极(Cu片);阴离子移向负极(Zn片)。4、盐桥的作用通过阴、阳离子的定向移动,在内电路形成电流回路而不中断电流。 5、意义:随开随用,并能长时间产生持续、稳定的电流。 [小结]练习:利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。 参考答案 二、原电池的原理及形成条件 [小结]1、原电池的定义: 化学能转变为电能的装置。 2、构成原电池的条件:(1)有两种活动性不同的金属(或金属与非金属)作电极。(2)电极材料均插入电解质溶液中。(3)两极相连形成闭合电路。两极-液-连线3、原电池的电极:①材料种类:②负极:还原剂,发生氧化反应的一极; ③正、负极的判断方法:电流计指针的偏转方向:电子流出或电流流入的一极为负极,
电子流入或电流流出的一极为正极正极:氧化剂,发生还原反应的一极;金属—金属(活泼性不同);
金属—非金属;金属—金属氧化物等。1.关于原电池的叙述中正确的是( )
构成原电池两极的必须是两种不同金属
内电路阳离子移向的一极为正极,外电路电子流出的一极为负极
原电池工作中总是负极溶解,正极上有物质析出
原电池的正极是还原剂,总是溶液中的阳离子在此被还原
2.判断下图装置,哪些能形成原电池( )
3.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是( )
A、C(s)+H2O(g)=CO(g)+H2(g) △H>0
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C、4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0
D、CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H<0B AEC D 随堂检测4.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是5。试将下列两个氧化还原反应分别设计成两个原电池⑴Zn + 2AgNO3=Zn(NO3)2+2Ag⑵2Fe3++Fe=3Fe2+( D )( Zn∣AgNO3∣C )( Fe∣Fe2(SO4)3∣C )A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜; 任一自发的氧化还原反应都可以组成一个原电池。6判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO4 ⑦⑥(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu⑧⑨(×)(∨)负极:正极:总反应:Fe-2e- =Fe2+2H++2e-=H2↑Fe+2H+= Fe2++H2↑或 Fe+H2SO4=FeSO4+H2↑7.某原电池总反应式为:Cu+2Fe3+=Cu2++2Fe2+,能实现该反应的原电池是( )
8.将镁片和铝片用导线相连,分别同时插入稀H2SO4和NaOH溶液中,写出两池中的电极反应式和电池反应式。B ①Mg—Al—稀H2SO4原电池:
负极(Mg):Mg-2e-=Mg2+(氧化反应)
正极(Al):2H++2e-=H2↑(还原反应)
电池反应:Mg+2H+=Mg2++H2↑
②Al—Mg—NaOH原电池:
负极(Al):2Al-6e-+8OH-=2AlO2-+4H2O(氧化反应) 正极(Mg):6H2O+6e-=3H2↑+6OH-(还原反应)
电池反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ 9、 把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B
化学能与电能的转化
第一节 原电池的工作原理
【思考】下列装置是否能形成原电池?(1)(2)(3)(4)【复习一 】构成原电池的条件:1、有两种活动性不同的金属(或金属与非金属)作电极。2、电极材料均插入电解质溶液中(能发生氧化还原反应)。3、两极相连形成闭合电路。两极一液一连线负极(活泼金属):正极(较不活泼金属做或非金属):电子流出的一极、发生氧化反应电子流入的一极、发生还原反应[问题]在左图(1)装置中,可以观察到什么现象?[现象](1)(2)[问题]在左图(2)装置中,可以观察到什么现象?[现象][分析]Zn片能与稀硫酸直接反应放出氢气Zn+2H+=Zn2++H2↑[分析]铜片上:2H++2e-=H2 ↑锌片上:Zn-2e-=Zn2+总反应:Zn+2H+=Zn2++H2↑思考锌片上有气泡,铜片上无气泡锌片溶解,铜片上有气泡[复习二]原电池的工作原理氧化还原反应(本质:反应物之间有电子转移)[结论]把氧化反应和还原反应分开在不同的区域进行,再以适当的方式连接起来,就可以获得电流.【思考】有什么方法使左图装置构成闭合回路,形成原电池呢?盐桥 将电解质溶液装在倒置的U形管中,跨接于两电解质溶液之间,代替两溶液的直接接触,就构成了盐桥。这样使两个烧杯中的溶液连成一个通路。 [实验一]按下图进行实验,注意观察现象.[实验现象]②锌片溶解质量减少;③铜片上有红色物质析出。[结论]Cu-Zn-CuSO4溶液构成了原电池,称为铜锌原电池.
负极
正极(锌片):(铜片):Zn-2e-=Zn2+Cu2++2e-=Cu①电流计指针偏转,并指示电子是由锌片流向铜片;总电池反应式是:Zn+Cu2+=Cu+Zn2+一、双液原电池的工作原理[实验二]继续观察实验一装置中电流计电流强度随时间延续的情况,以及锌片表面的变化。 实验现象:指针偏转角度渐渐减少,同时锌片表面有铜 析出。讨论:如何设法阻止溶液中的Cu2+在负极锌表面还原以及能使该装置原电池得到持续、稳定的电流呢?[设想]若把装置中左烧杯中的CuSO4溶液换成ZnSO4溶液可以吗? [实验三]教材P12“实验1-9” 实验现象:①盐桥存在时电流计指针偏转,且指针偏转角度随时间的延续几乎保持不变;②Zn片溶解,无红色物质析出,Cu片上有红色物质析出;③取出盐桥电流计指针回到零点。 实验结论:Zn—Cu—ZnSO4溶液—CuSO4溶液—盐桥构成了原电池(双液原电池),能产生持续、稳定的电流;取出盐桥时没有电流产生,不能形成原电池.一、双液原电池的工作原理1、构造特点:由两个半电池组成,每个半电池中的电极与电解质溶液互不反应,电池反应的还原剂与氧化剂分别位于两个半电池中,中间通过盐桥连接形成闭合回路。2、电极反应:负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Cu):Cu2++2e-=Cu(还原反应)电池反应:Zn+Cu2+=Zn2++Cu3、电子、电流的流向外电路:电子由负极(Zn片)流向正极(Cu片);电流由正极(Cu片)流向负极(Zn片);内电路:阳离子移向正极(Cu片);阴离子移向负极(Zn片)。4、盐桥的作用通过阴、阳离子的定向移动,在内电路形成电流回路而不中断电流。 5、意义:随开随用,并能长时间产生持续、稳定的电流。 [小结]练习:利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。 参考答案 二、原电池的原理及形成条件 [小结]1、原电池的定义: 化学能转变为电能的装置。 2、构成原电池的条件:(1)有两种活动性不同的金属(或金属与非金属)作电极。(2)电极材料均插入电解质溶液中。(3)两极相连形成闭合电路。两极-液-连线3、原电池的电极:①材料种类:②负极:还原剂,发生氧化反应的一极; ③正、负极的判断方法:电流计指针的偏转方向:电子流出或电流流入的一极为负极,
电子流入或电流流出的一极为正极正极:氧化剂,发生还原反应的一极;金属—金属(活泼性不同);
金属—非金属;金属—金属氧化物等。1.关于原电池的叙述中正确的是( )
构成原电池两极的必须是两种不同金属
内电路阳离子移向的一极为正极,外电路电子流出的一极为负极
原电池工作中总是负极溶解,正极上有物质析出
原电池的正极是还原剂,总是溶液中的阳离子在此被还原
2.判断下图装置,哪些能形成原电池( )
3.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是( )
A、C(s)+H2O(g)=CO(g)+H2(g) △H>0
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C、4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0
D、CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H<0B AEC D 随堂检测4.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是5。试将下列两个氧化还原反应分别设计成两个原电池⑴Zn + 2AgNO3=Zn(NO3)2+2Ag⑵2Fe3++Fe=3Fe2+( D )( Zn∣AgNO3∣C )( Fe∣Fe2(SO4)3∣C )A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜; 任一自发的氧化还原反应都可以组成一个原电池。6判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO4 ⑦⑥(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu⑧⑨(×)(∨)负极:正极:总反应:Fe-2e- =Fe2+2H++2e-=H2↑Fe+2H+= Fe2++H2↑或 Fe+H2SO4=FeSO4+H2↑7.某原电池总反应式为:Cu+2Fe3+=Cu2++2Fe2+,能实现该反应的原电池是( )
8.将镁片和铝片用导线相连,分别同时插入稀H2SO4和NaOH溶液中,写出两池中的电极反应式和电池反应式。B ①Mg—Al—稀H2SO4原电池:
负极(Mg):Mg-2e-=Mg2+(氧化反应)
正极(Al):2H++2e-=H2↑(还原反应)
电池反应:Mg+2H+=Mg2++H2↑
②Al—Mg—NaOH原电池:
负极(Al):2Al-6e-+8OH-=2AlO2-+4H2O(氧化反应) 正极(Mg):6H2O+6e-=3H2↑+6OH-(还原反应)
电池反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ 9、 把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B
