弱电解质的电离平衡 盐类的水解(山东省潍坊市青州市)
文档属性
| 名称 | 弱电解质的电离平衡 盐类的水解(山东省潍坊市青州市) |  | |
| 格式 | rar | ||
| 文件大小 | 149.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-11-21 08:22:00 | ||
图片预览










文档简介
课件34张PPT。知识回顾:练习 下列物质中:
a. Na b. Br2 c.CaCO3 d.NH3 e. SO3
f. H2S g. H2SO4 h.盐酸 i. HClO j. HF
k. Ba(OH)2 l. NH3?H2O m. NaCl n. BaSO4 o. H2O p. CH3 COOH q. C2H5OH
(1) 属于电解质的有( )
(2) 属于非电解质的有( )
(3) 属于强电解质的有( )
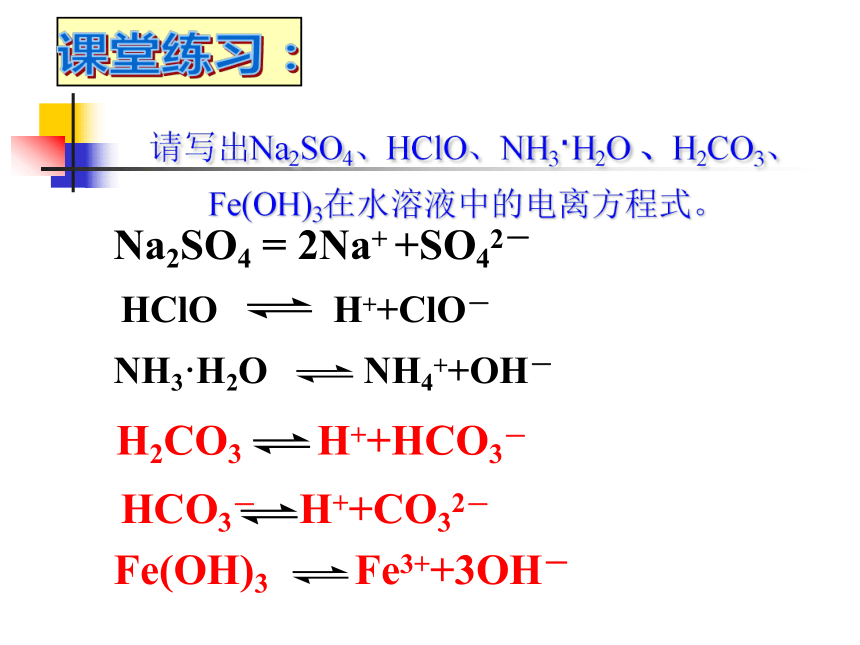
(4) 属于弱电解质的有( ) cfgijklmnop deqcgkmnf ijlop 请写出Na2SO4、HClO、NH3·H2O 、H2CO3、Fe(OH)3在水溶液中的电离方程式。
Na2SO4 = 2Na+ +SO42-HClO H++ClO-NH3·H2O NH4++OH-H2CO3 H++HCO3-HCO3- H++CO32-Fe(OH)3 Fe3++3OH-课堂练习: 第2节弱电解质的电离 盐类的水解学习目标:
1.理解电离平衡常数的含义
2.能说明温度,浓度,外加物质对电离平衡的影响
3.知道盐类水解的原理,能说明温度、浓度、外加酸碱对水解平衡的影响。
4.了解盐类水解在生产生活中的重要应用。弱电解质的电离平衡
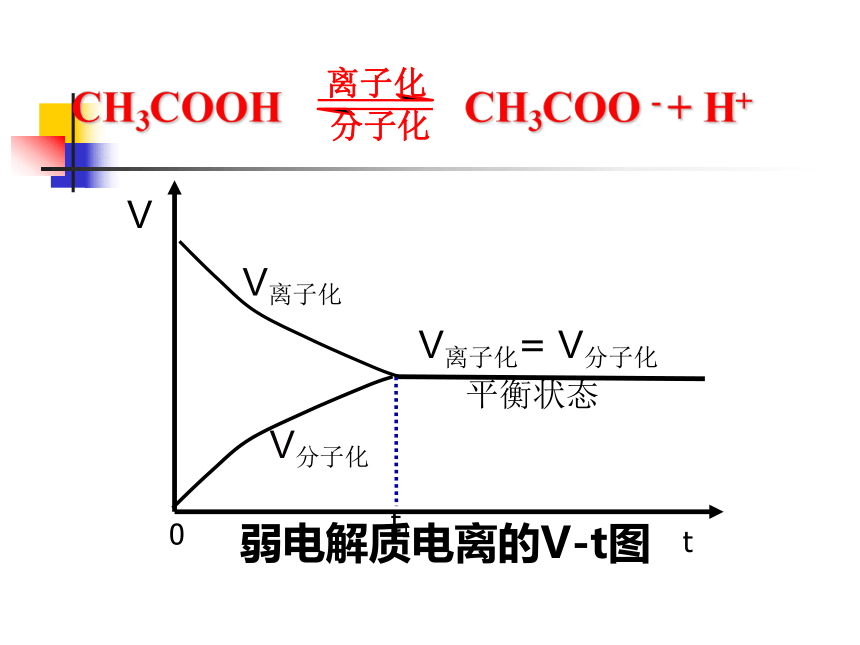
1、电离平衡概念2、电离平衡的特征及电离平 衡常数的含义3、影响电离平衡的外因V离子化= V分子化平衡状态V分子化t1弱电解质电离的V-t图V离子化 CH3COOH CH3COO - + H+1、概念 在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。2、电离平衡的特征 等:离子化速率=分子化速率
动:离子化速率=分子化速率≠0
定:
变:改变条件,电离平衡会发生移动 定的含义①分子和离子的浓度保持不变;
②对于任意弱电解质的电离平衡: AB A+ + B-
有 K =
且K只与温度有关,温度不变,K值不变。K称作弱电解质的电离平衡常数。 返回3、影响电离平衡的外因
①浓度的影响
a、增大弱电解质分子的浓度或减小弱电解质的离子浓度使电离平衡向正反应方向移动;反之,电离平衡向逆反应方向移动。
b、加水稀释时,电离平衡向正反应方向移动。
②温度的影响
升高温度,电离平衡向正反应方向移动。
CH3COOH CH3COO― + H+ , △H>0 电离结合练习 1、 在氨水中存在下列电离平衡
NH3·H2O NH4+ + OH―
下列条件的改变能否引起电离平衡移动,向哪个方向移动?
①?? 加NH4Cl固体 ②加NaOH溶液 ③加HCl ④加CH3COOH溶液 ⑤加热(不考虑NH3的挥发) ⑥加水 ⑦加压
答:正移的有:___________; 逆移的有:______________
不移的有:__________.
③④⑤⑥①②⑦2.填表:0.1mol/L的CH3COOH溶液
增大增大减小减弱不变增大增大增大增强增大减小减小减小增强不变减小增大增大增强不变增大减小减小增强不变课堂练习:3.弱电解质加水稀释时,?_____,离子浓度______? (填变大、变小、不变或不能确定) 变大不能确定 画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。 总结温度升高温度促进电离
浓度稀释有利于电离同离子效应抑制电离新物质消耗弱电解质产生的离子则促进电离电离平衡常数改变电离平衡常数不变 盐类的水解它们的酸碱性会如何呢盐溶液?检测下列溶液的酸碱性 , 填写下表:中性碱性碱性酸性酸性中性中性碱性碱性酸性酸性 试用归纳法找出盐的组成与盐溶液的酸碱性关系。中性碱性酸性强酸弱碱盐弱酸强碱盐强酸强碱盐盐的组成与盐溶液的酸碱性的关系H2O?酸性碱性中性中性碱性酸性强酸弱碱盐强碱弱酸盐强酸强碱盐 按照盐的组成分类 ,为什么不同类型盐溶液酸碱性不同呢? 分组讨论、交流… …提示:可以从下列角度和顺序思考:盐溶液中存在哪些离子?哪些离子间可能相互结合?对水的电离平衡有何影响?CH3COONa = CH3COO- + Na+探讨与交流 (以CH3COONa溶液例):C(H+) < C(OH-)NH4Cl = NH4+ + Cl-探讨与交流 (以NH4Cl溶液为例):C(OH-) < C(H+) NaCl溶液的情况又如何呢 ?盐类水解的定义: 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 H2O H + + OH - CH3COONa = Na+ + CH3COO-NH4Cl = Cl- + NH4+ 结合CH3COONa和NH4Cl的水解机理,分析归纳… 从盐的组成以及其溶液的酸碱性分析归纳,下列问题:1、结合盐类水解的定义分析盐类水解的条件、实质是什么?有什么规律?2、盐类水解反应与中和反应的关系如
何?探究问题3:1、盐类水解的条件、实质和规 律是什么? 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 水解的条件:水解的实质:(要生成弱电解质)破坏了水的电离平衡,
促进了水的电离。水解的规律:谁弱谁水解,无弱不水解,谁强显谁性,都强显中性。分组讨论…在水溶液中、易溶于水、电离出弱酸阴离子或弱碱阳离子。2、盐类水解反应与中和反应的关系如何?CH3COOH+NaOH CH3COONa+H2OCH3COONa+H2O CH3COOH+NaOH水解中和水解中和C、NaNO3 向水中加入下列哪些物质,可使水的电 离平衡发生移动?怎样移动?向左移动向右移动不 移 动向左移动向右移动A、H2SO4习 题 1 :B、FeCl3E、KOHD、K2CO31. 下列溶液PH小于7的是A、 KBr B、 CuSO4 C、NaF D、Ba(NO3)2
2. 下列溶液能使酚酞指示剂显红色的是A 、 K2CO3 B、 NaHSO4 C、 Na2S D、 FeCl33.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_4.? 氯化铵溶液中离子浓度从大到小排列正确的是:A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl、 NH4+ 、 OH- 、H +习 题 2 :下列盐的水溶液中,离子浓度比正确的是: D、NaF c(Na+) : c(F-) < 1 : 1B、K2SO4 c(K+) : c(SO42-) = 2 : 1C、(NH4)2SO4 c(NH4+) : c(SO42-) < 2 : 1A、NaClO c(Na+) : c(ClO-) = 1 : 1习 题 3 :B C 能力提高 : 1、若某盐溶液呈中性,能否判断该盐未发生水解反应?该盐可能是什么盐?为什么?(结合CH3COO NH4为例思考)2、酸式盐的水溶液一定显酸性吗?(结合NaHSO4 、 NaH2PO4、 NaHPO4 、NaHCO3 、 NaHS 等为例思考)思考……越弱越水解 ! 2、弱酸弱碱盐能否水解?若能水解,弱酸弱碱盐溶液的酸碱性如何确定?说明理由。 课后探究 : 1、盐类水解程度的大小是否一样,若不一样,主要受什么因素的影响?都弱都水解 !强酸弱酸强碱弱碱1、强酸强碱盐2、强酸弱碱盐4、弱酸弱碱盐3、弱酸强碱盐生成
的盐CH3COOH + NH3·H2O = CH3COONH4 + H2OHCl + NaOH = NaCl + H2O内容小结: 在检测溶液酸碱性的实验得出的结果的感性认识的基础上,进行分析归纳,逻辑推理,进而形成“盐类的水解”概念,并且在挖掘概念内涵的基础上,总结归纳出“盐类的水解规律”。2、盐类水解的概念、条件、实质和规 律。1、不同盐类溶液酸碱性不同的原因。一、知识内容:二、知识技能呈现方法:
a. Na b. Br2 c.CaCO3 d.NH3 e. SO3
f. H2S g. H2SO4 h.盐酸 i. HClO j. HF
k. Ba(OH)2 l. NH3?H2O m. NaCl n. BaSO4 o. H2O p. CH3 COOH q. C2H5OH
(1) 属于电解质的有( )
(2) 属于非电解质的有( )
(3) 属于强电解质的有( )
(4) 属于弱电解质的有( ) cfgijklmnop deqcgkmnf ijlop 请写出Na2SO4、HClO、NH3·H2O 、H2CO3、Fe(OH)3在水溶液中的电离方程式。
Na2SO4 = 2Na+ +SO42-HClO H++ClO-NH3·H2O NH4++OH-H2CO3 H++HCO3-HCO3- H++CO32-Fe(OH)3 Fe3++3OH-课堂练习: 第2节弱电解质的电离 盐类的水解学习目标:
1.理解电离平衡常数的含义
2.能说明温度,浓度,外加物质对电离平衡的影响
3.知道盐类水解的原理,能说明温度、浓度、外加酸碱对水解平衡的影响。
4.了解盐类水解在生产生活中的重要应用。弱电解质的电离平衡
1、电离平衡概念2、电离平衡的特征及电离平 衡常数的含义3、影响电离平衡的外因V离子化= V分子化平衡状态V分子化t1弱电解质电离的V-t图V离子化 CH3COOH CH3COO - + H+1、概念 在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。2、电离平衡的特征 等:离子化速率=分子化速率
动:离子化速率=分子化速率≠0
定:
变:改变条件,电离平衡会发生移动 定的含义①分子和离子的浓度保持不变;
②对于任意弱电解质的电离平衡: AB A+ + B-
有 K =
且K只与温度有关,温度不变,K值不变。K称作弱电解质的电离平衡常数。 返回3、影响电离平衡的外因
①浓度的影响
a、增大弱电解质分子的浓度或减小弱电解质的离子浓度使电离平衡向正反应方向移动;反之,电离平衡向逆反应方向移动。
b、加水稀释时,电离平衡向正反应方向移动。
②温度的影响
升高温度,电离平衡向正反应方向移动。
CH3COOH CH3COO― + H+ , △H>0 电离结合练习 1、 在氨水中存在下列电离平衡
NH3·H2O NH4+ + OH―
下列条件的改变能否引起电离平衡移动,向哪个方向移动?
①?? 加NH4Cl固体 ②加NaOH溶液 ③加HCl ④加CH3COOH溶液 ⑤加热(不考虑NH3的挥发) ⑥加水 ⑦加压
答:正移的有:___________; 逆移的有:______________
不移的有:__________.
③④⑤⑥①②⑦2.填表:0.1mol/L的CH3COOH溶液
增大增大减小减弱不变增大增大增大增强增大减小减小减小增强不变减小增大增大增强不变增大减小减小增强不变课堂练习:3.弱电解质加水稀释时,?_____,离子浓度______? (填变大、变小、不变或不能确定) 变大不能确定 画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。 总结温度升高温度促进电离
浓度稀释有利于电离同离子效应抑制电离新物质消耗弱电解质产生的离子则促进电离电离平衡常数改变电离平衡常数不变 盐类的水解它们的酸碱性会如何呢盐溶液?检测下列溶液的酸碱性 , 填写下表:中性碱性碱性酸性酸性中性中性碱性碱性酸性酸性 试用归纳法找出盐的组成与盐溶液的酸碱性关系。中性碱性酸性强酸弱碱盐弱酸强碱盐强酸强碱盐盐的组成与盐溶液的酸碱性的关系H2O?酸性碱性中性中性碱性酸性强酸弱碱盐强碱弱酸盐强酸强碱盐 按照盐的组成分类 ,为什么不同类型盐溶液酸碱性不同呢? 分组讨论、交流… …提示:可以从下列角度和顺序思考:盐溶液中存在哪些离子?哪些离子间可能相互结合?对水的电离平衡有何影响?CH3COONa = CH3COO- + Na+探讨与交流 (以CH3COONa溶液例):C(H+) < C(OH-)NH4Cl = NH4+ + Cl-探讨与交流 (以NH4Cl溶液为例):C(OH-) < C(H+) NaCl溶液的情况又如何呢 ?盐类水解的定义: 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 H2O H + + OH - CH3COONa = Na+ + CH3COO-NH4Cl = Cl- + NH4+ 结合CH3COONa和NH4Cl的水解机理,分析归纳… 从盐的组成以及其溶液的酸碱性分析归纳,下列问题:1、结合盐类水解的定义分析盐类水解的条件、实质是什么?有什么规律?2、盐类水解反应与中和反应的关系如
何?探究问题3:1、盐类水解的条件、实质和规 律是什么? 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 水解的条件:水解的实质:(要生成弱电解质)破坏了水的电离平衡,
促进了水的电离。水解的规律:谁弱谁水解,无弱不水解,谁强显谁性,都强显中性。分组讨论…在水溶液中、易溶于水、电离出弱酸阴离子或弱碱阳离子。2、盐类水解反应与中和反应的关系如何?CH3COOH+NaOH CH3COONa+H2OCH3COONa+H2O CH3COOH+NaOH水解中和水解中和C、NaNO3 向水中加入下列哪些物质,可使水的电 离平衡发生移动?怎样移动?向左移动向右移动不 移 动向左移动向右移动A、H2SO4习 题 1 :B、FeCl3E、KOHD、K2CO31. 下列溶液PH小于7的是A、 KBr B、 CuSO4 C、NaF D、Ba(NO3)2
2. 下列溶液能使酚酞指示剂显红色的是A 、 K2CO3 B、 NaHSO4 C、 Na2S D、 FeCl33.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_4.? 氯化铵溶液中离子浓度从大到小排列正确的是:A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl、 NH4+ 、 OH- 、H +习 题 2 :下列盐的水溶液中,离子浓度比正确的是: D、NaF c(Na+) : c(F-) < 1 : 1B、K2SO4 c(K+) : c(SO42-) = 2 : 1C、(NH4)2SO4 c(NH4+) : c(SO42-) < 2 : 1A、NaClO c(Na+) : c(ClO-) = 1 : 1习 题 3 :B C 能力提高 : 1、若某盐溶液呈中性,能否判断该盐未发生水解反应?该盐可能是什么盐?为什么?(结合CH3COO NH4为例思考)2、酸式盐的水溶液一定显酸性吗?(结合NaHSO4 、 NaH2PO4、 NaHPO4 、NaHCO3 、 NaHS 等为例思考)思考……越弱越水解 ! 2、弱酸弱碱盐能否水解?若能水解,弱酸弱碱盐溶液的酸碱性如何确定?说明理由。 课后探究 : 1、盐类水解程度的大小是否一样,若不一样,主要受什么因素的影响?都弱都水解 !强酸弱酸强碱弱碱1、强酸强碱盐2、强酸弱碱盐4、弱酸弱碱盐3、弱酸强碱盐生成
的盐CH3COOH + NH3·H2O = CH3COONH4 + H2OHCl + NaOH = NaCl + H2O内容小结: 在检测溶液酸碱性的实验得出的结果的感性认识的基础上,进行分析归纳,逻辑推理,进而形成“盐类的水解”概念,并且在挖掘概念内涵的基础上,总结归纳出“盐类的水解规律”。2、盐类水解的概念、条件、实质和规 律。1、不同盐类溶液酸碱性不同的原因。一、知识内容:二、知识技能呈现方法:
