钠的重要化合物(黑龙江省大庆市)
文档属性
| 名称 | 钠的重要化合物(黑龙江省大庆市) |  | |
| 格式 | rar | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-11-30 09:43:00 | ||
图片预览







文档简介
课件29张PPT。一、钠的重要化合物复习:Na2O、Na2O2
它们是金属钠与氧气在什么条件下化合生成的?写出反应的化学方程式,标出电子转移的方向和数目。指出它们属于何种类型的物质?
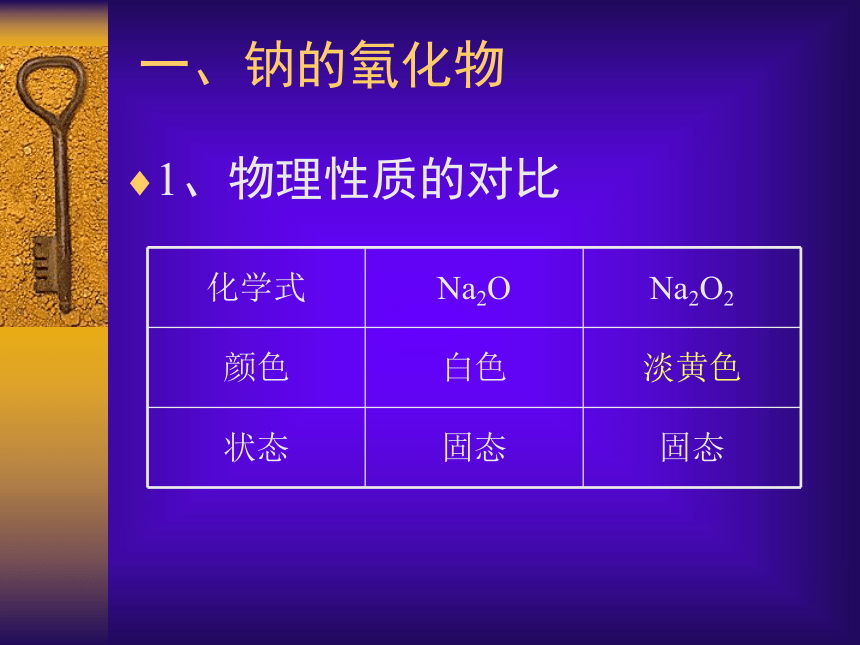
一、钠的氧化物 1、物理性质的对比俗话说:“水火不相容。”
水能灭火,水能生火吗?
让我们来试验一下。
①过氧化钠与水反应2.化学性质 现象:Na2O2与H2O剧烈反应,有气泡产生,溶液颜色先变红,然后褪色。
自身氧化还原反应2Na2O2+2H2O==4NaOH+O2 ②过氧化钠与二氧化碳反应2Na2O2+2CO2==2Na2CO3+O2观察现象:Na2O2与CO2剧烈反应,使
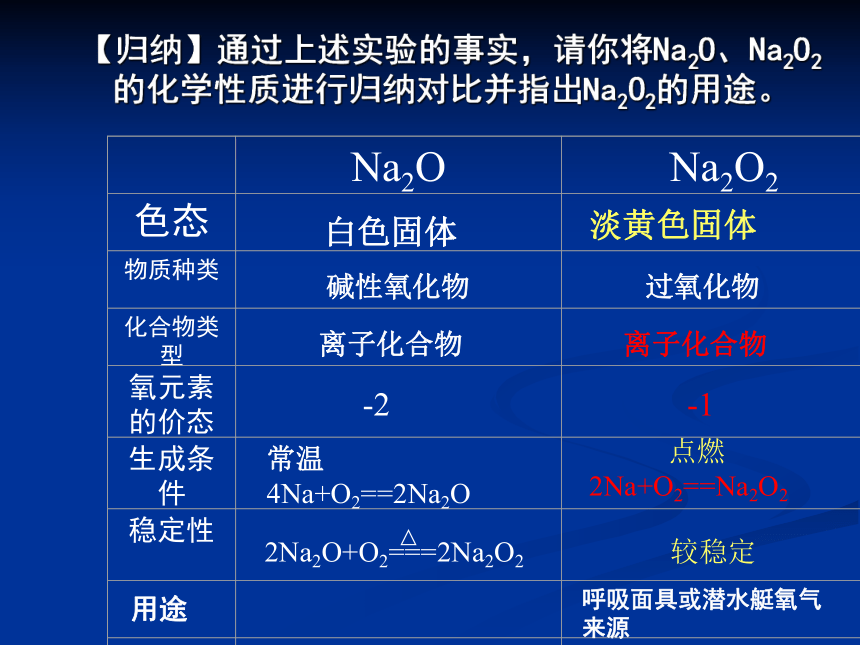
脱脂棉燃烧。反应放热③漂白性Na2O2 中-1价的氧元素具有强氧性,所以可使有色物质褪色。表现漂白性。所以过氧化钠与水反应中加入酚酞,溶液一开始变红,最后红色消失。【归纳】通过上述实验的事实,请你将Na2O、Na2O2的化学性质进行归纳对比并指出Na2O2的用途。 一、氧化钠与过氧化钠的比较
白色固体淡黄色固体碱性氧化物过氧化物离子化合物离子化合物-2 -1常温
4Na+O2==2Na2O 点燃
2Na+O2==Na2O22Na2O+O2===2Na2O2较稳定
用途呼吸面具或潜水艇氧气来源与水反应 与酸性氧
化物反应
与酸反应
特性
Na2O+H2O==2NaOH
Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl
+H2O2Na2O2+2H2O==4NaOH+O2
2Na2O2+2CO2==2Na2CO3+O2
2Na2O2+4HCl=4NaCl+O2
+2H2O
强氧化性、漂白性
【随堂检测】 1.氧化钠与过氧化钠的共同之处是
(A)都是淡黄色固体???
(B)都是碱性氧化物
(C)都能与水反应生成碱
(D)都能与二氧化碳化合
C2.在下列变化中,水或二氧化碳既不是氧化剂,也不是还原剂的氧化还原反应是(?? )。
①2F2+2H2O=4HF+O2↑
②Cl2+H2O=HClO+HCl
③2Na+2H2O=2NaOH+H2↑
④2Na2O2+2H2O=4NaOH+O2↑
⑤2H2O === 2H2 ↑ + O2 ↑
⑥2Na2O2+2CO2=2Na2CO3+O2↑
(A)①、②、③(B)②、⑤、⑥
(C)②、④、⑥(D)①、③、⑥通电C?二、碳酸钠和碳酸氢钠1、物理性质:
碳酸钠: 白色粉末 易溶于水。
碳酸氢钠:细小白色晶体,易溶于水。
小结:碳酸盐的溶解性 1、大部分碳酸盐难溶。
2、大部分酸式盐溶解性大于正盐如:
3、钾、钠、铵盐的正盐和酸式盐都易溶于水,但同温下正盐溶解度大于酸式盐,如:
故向饱和Na2CO3溶液中通入过量CO2,会有晶体析出。2、化学性质(1)水溶液都使酚酞变红(2)均可与酸反应 分析:
(1)相似性:Na2CO3、NaHCO3均可与酸反应。
(2)差异性:
①溶解性不同,Na2CO3比NaHCO3更易溶解于水
②与酸反应的剧烈程度不同;NaHCO3与酸反应更剧烈。且当NaCO3过量时,可以首先与酸反应,生成NaHCO3,故开始可能并不产生气泡。
书写方程式 Na2CO3 + HCl == NaCl + NaHCO3
+) NaHCO3 + HCl == NaCl + H2O + CO2↑
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
NaHCO3 + HCl == NaCl + H2O + CO2↑
?
HCO3-既能与酸反应又能与碱反应HCO3- + OH- = CO32- + H2OHCO3- + H+ = CO2 + H2O而CO32- 只与H+反应CO32- +H+ = HCO3- 或 CO32- + 2H+ = CO2 + H2O(3)碳酸钠、碳酸氢钠的热稳定性讨论:
a、实验3-13说明Na2CO3 和NaHCO3哪种稳定?
b、写出NaHCO3分解的化学方程式,此反应在化学上有何运用? NaHCO3俗称
色态溶解性
热稳定性溶解度与酸反应
与碱反应
与BaCl2反应
纯碱或苏打
小苏打
白色粉末
Na2CO3·10H2O为白色晶体
细小的白色晶体
易溶
易溶
同温下的溶解度:Na2CO3>NaHCO3
稳定
不稳定
2NaHCO3==Na2CO3+H2O+CO2
CO2
CO2
与酸反应速率
与相同酸溶液反应速度:NaHCO3>Na2CO3
不与NaOH反应
OH- + HCO3- = CO32- + H2OBa2++CO32 - =BaCO3
不反应
Na2CO3
小结:碳酸和碳酸盐的热稳定性一般规律
(1) M2CO3 > MHCO3 > H2CO3(M为碱金属)
(2)Li2CO3 > Na2CO3 > K2CO3 > Rb2CO3
?用途简介:
(1)碳酸钠:用于玻璃、制皂、造纸、纺织等;
(2)碳酸氢钠:发酵粉、治胃病药剂 【随堂检测】 1.关于Na2CO3和NaHCO3,下列说法中正确的是(??A. )。
(A)Na2CO3比NaHCO3易溶于水
(B)NaHCO3比Na2CO3热稳定性好
(C)石灰水能与NaHCO3反应,不与Na2CO3反应
(D)等物质的量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2∶1。
2.要除去在Na2CO3固体中混有的NaHCO3的最好办法是(??C? )。
(A)加入适量的稀盐酸?
(B)加入适量的NaOH溶液
(C)加热至质量不再减轻
(D)通入过量的CO2
三、焰色反应金属或化合物在燃烧时使火焰呈特殊的颜色,叫做焰色反应。
实验3-6黄 色紫 色绿 色砖红色黄绿色紫红色紫 色洋红色小节Na2O、Na2O2性质比较;
Na2CO3和NaHCO3的化学性质。作业课后习题:1、4、5、13
预习铝的重要化合物
一、钠的氧化物 1、物理性质的对比俗话说:“水火不相容。”
水能灭火,水能生火吗?
让我们来试验一下。
①过氧化钠与水反应2.化学性质 现象:Na2O2与H2O剧烈反应,有气泡产生,溶液颜色先变红,然后褪色。
自身氧化还原反应2Na2O2+2H2O==4NaOH+O2 ②过氧化钠与二氧化碳反应2Na2O2+2CO2==2Na2CO3+O2观察现象:Na2O2与CO2剧烈反应,使
脱脂棉燃烧。反应放热③漂白性Na2O2 中-1价的氧元素具有强氧性,所以可使有色物质褪色。表现漂白性。所以过氧化钠与水反应中加入酚酞,溶液一开始变红,最后红色消失。【归纳】通过上述实验的事实,请你将Na2O、Na2O2的化学性质进行归纳对比并指出Na2O2的用途。 一、氧化钠与过氧化钠的比较
白色固体淡黄色固体碱性氧化物过氧化物离子化合物离子化合物-2 -1常温
4Na+O2==2Na2O 点燃
2Na+O2==Na2O22Na2O+O2===2Na2O2较稳定
用途呼吸面具或潜水艇氧气来源与水反应 与酸性氧
化物反应
与酸反应
特性
Na2O+H2O==2NaOH
Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl
+H2O2Na2O2+2H2O==4NaOH+O2
2Na2O2+2CO2==2Na2CO3+O2
2Na2O2+4HCl=4NaCl+O2
+2H2O
强氧化性、漂白性
【随堂检测】 1.氧化钠与过氧化钠的共同之处是
(A)都是淡黄色固体???
(B)都是碱性氧化物
(C)都能与水反应生成碱
(D)都能与二氧化碳化合
C2.在下列变化中,水或二氧化碳既不是氧化剂,也不是还原剂的氧化还原反应是(?? )。
①2F2+2H2O=4HF+O2↑
②Cl2+H2O=HClO+HCl
③2Na+2H2O=2NaOH+H2↑
④2Na2O2+2H2O=4NaOH+O2↑
⑤2H2O === 2H2 ↑ + O2 ↑
⑥2Na2O2+2CO2=2Na2CO3+O2↑
(A)①、②、③(B)②、⑤、⑥
(C)②、④、⑥(D)①、③、⑥通电C?二、碳酸钠和碳酸氢钠1、物理性质:
碳酸钠: 白色粉末 易溶于水。
碳酸氢钠:细小白色晶体,易溶于水。
小结:碳酸盐的溶解性 1、大部分碳酸盐难溶。
2、大部分酸式盐溶解性大于正盐如:
3、钾、钠、铵盐的正盐和酸式盐都易溶于水,但同温下正盐溶解度大于酸式盐,如:
故向饱和Na2CO3溶液中通入过量CO2,会有晶体析出。2、化学性质(1)水溶液都使酚酞变红(2)均可与酸反应 分析:
(1)相似性:Na2CO3、NaHCO3均可与酸反应。
(2)差异性:
①溶解性不同,Na2CO3比NaHCO3更易溶解于水
②与酸反应的剧烈程度不同;NaHCO3与酸反应更剧烈。且当NaCO3过量时,可以首先与酸反应,生成NaHCO3,故开始可能并不产生气泡。
书写方程式 Na2CO3 + HCl == NaCl + NaHCO3
+) NaHCO3 + HCl == NaCl + H2O + CO2↑
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
NaHCO3 + HCl == NaCl + H2O + CO2↑
?
HCO3-既能与酸反应又能与碱反应HCO3- + OH- = CO32- + H2OHCO3- + H+ = CO2 + H2O而CO32- 只与H+反应CO32- +H+ = HCO3- 或 CO32- + 2H+ = CO2 + H2O(3)碳酸钠、碳酸氢钠的热稳定性讨论:
a、实验3-13说明Na2CO3 和NaHCO3哪种稳定?
b、写出NaHCO3分解的化学方程式,此反应在化学上有何运用? NaHCO3俗称
色态溶解性
热稳定性溶解度与酸反应
与碱反应
与BaCl2反应
纯碱或苏打
小苏打
白色粉末
Na2CO3·10H2O为白色晶体
细小的白色晶体
易溶
易溶
同温下的溶解度:Na2CO3>NaHCO3
稳定
不稳定
2NaHCO3==Na2CO3+H2O+CO2
CO2
CO2
与酸反应速率
与相同酸溶液反应速度:NaHCO3>Na2CO3
不与NaOH反应
OH- + HCO3- = CO32- + H2OBa2++CO32 - =BaCO3
不反应
Na2CO3
小结:碳酸和碳酸盐的热稳定性一般规律
(1) M2CO3 > MHCO3 > H2CO3(M为碱金属)
(2)Li2CO3 > Na2CO3 > K2CO3 > Rb2CO3
?用途简介:
(1)碳酸钠:用于玻璃、制皂、造纸、纺织等;
(2)碳酸氢钠:发酵粉、治胃病药剂 【随堂检测】 1.关于Na2CO3和NaHCO3,下列说法中正确的是(??A. )。
(A)Na2CO3比NaHCO3易溶于水
(B)NaHCO3比Na2CO3热稳定性好
(C)石灰水能与NaHCO3反应,不与Na2CO3反应
(D)等物质的量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2∶1。
2.要除去在Na2CO3固体中混有的NaHCO3的最好办法是(??C? )。
(A)加入适量的稀盐酸?
(B)加入适量的NaOH溶液
(C)加热至质量不再减轻
(D)通入过量的CO2
三、焰色反应金属或化合物在燃烧时使火焰呈特殊的颜色,叫做焰色反应。
实验3-6黄 色紫 色绿 色砖红色黄绿色紫红色紫 色洋红色小节Na2O、Na2O2性质比较;
Na2CO3和NaHCO3的化学性质。作业课后习题:1、4、5、13
预习铝的重要化合物
