铝的重要化合物
图片预览



文档简介
课件17张PPT。二、铝的重要化合物闪耀着六射星光的天然蓝宝石“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。闪耀着六射星光的天然红宝石“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。
1.氧化铝的天然存在形式铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成。刚 玉
氧化铝的天然晶体,硬度大,仅次于金刚石、金刚砂(SiC)。(蓝宝石、红宝石是刚玉的一种)
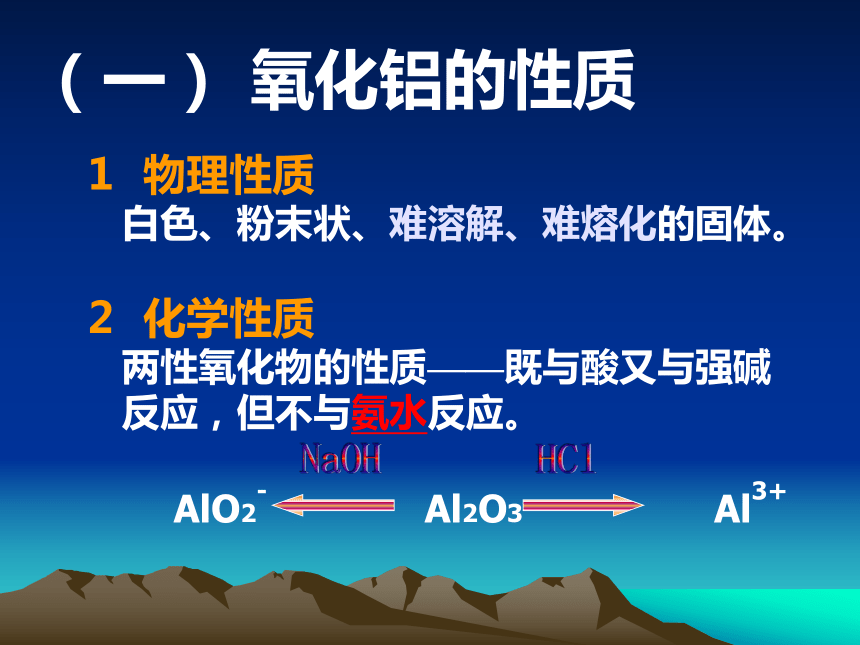
(一) 氧化铝的性质 物理性质
白色、粉末状、难溶解、难熔化的固体。
化学性质
两性氧化物的性质——既与酸又与强碱
反应,但不与氨水反应。AlO2- Al2O3 Al3+HClNaOH
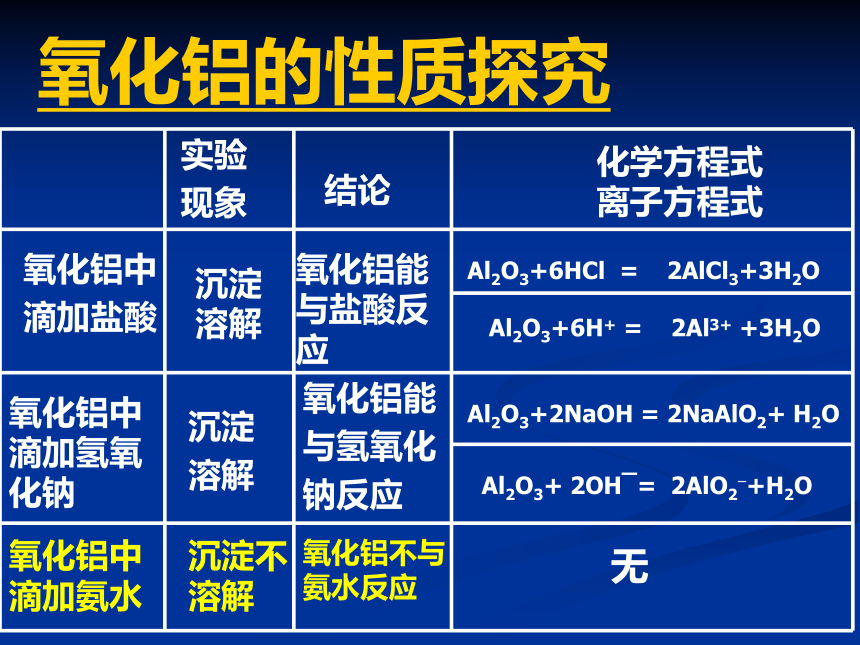
氧化铝的性质探究实验
现象结论化学方程式离子方程式氧化铝中
滴加盐酸氧化铝中
滴加氢氧
化钠沉淀
溶解氧化铝能
与盐酸反
应沉淀
溶解Al2O3+6HCl = 2AlCl3+3H2OAl2O3+6H+ = 2Al3+ +3H2OAl2O3+2NaOH = 2NaAlO2+ H2OAl2O3+ 2OHˉ= 2AlO2?+H2O氧化铝能
与氢氧化
钠反应氧化铝中
滴加氨水沉淀不溶解氧化铝不与氨水反应无
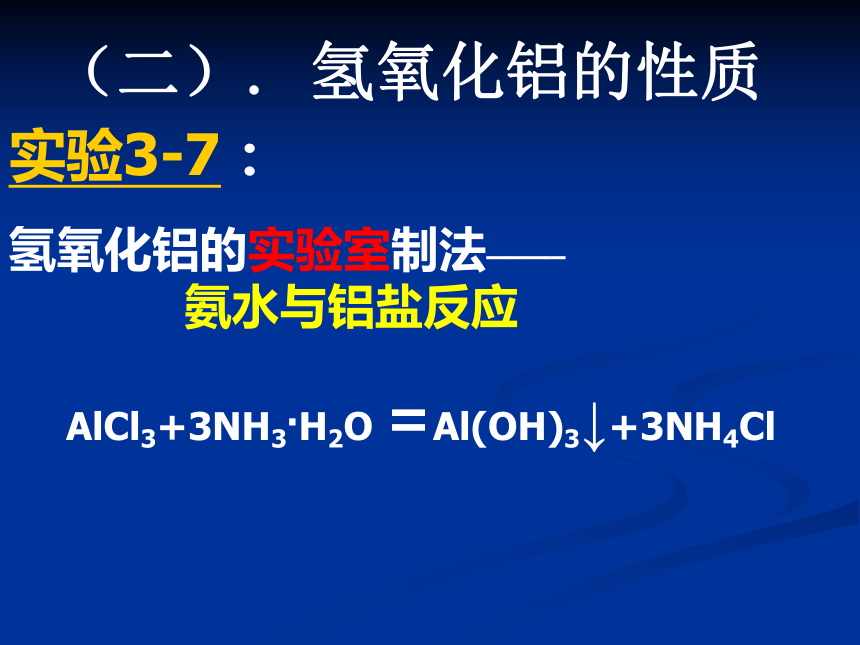
(二). 氢氧化铝的性质实验3-7:氢氧化铝的实验室制法____
氨水与铝盐反应AlCl3+3NH3.H2O =Al(OH)3↓+3NH4Cl
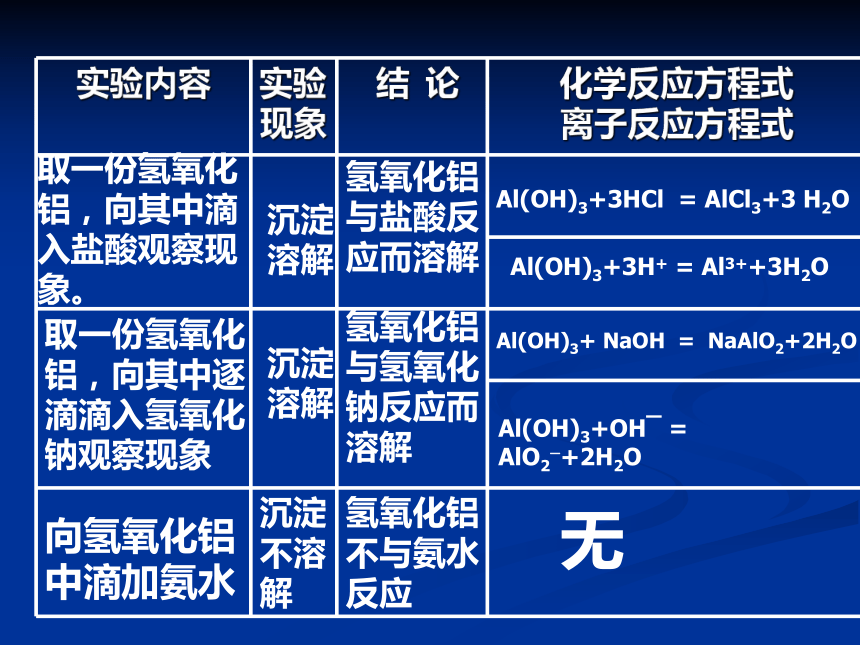
沉淀
溶解沉淀
溶解氢氧化铝与氢氧化钠反应而溶解 氢氧化铝
与盐酸反
应而溶解Al(OH)3+ NaOH = NaAlO2+2H2O Al(OH)3+OHˉ = AlO2?+2H2O Al(OH)3+3HCl = AlCl3+3 H2OAl(OH)3+3H+ = Al3++3H2O取一份氢氧化铝,向其中逐滴滴入氢氧化钠观察现象取一份氢氧化铝,向其中滴入盐酸观察现象。 向氢氧化铝中滴加氨水沉淀不溶解氢氧化铝不与氨水反应 无
AlO2? Al(OH)3 Al3+ HCl NaOH NaOH?1.氢氧化铝的物理性质
白色、胶状、难溶的物质
2.化学性质
典型的两性氢氧化物的性质——与强酸、强碱反应 H++ AlO2-+ H2O
Al(OH)3
Al3+ + 3OH-
实验三 偏铝酸盐的性质探究为什么Al(OH)3 、AlO2- 、Al3+之间能实现相互转化?
H+ + AlO2ˉ+ H2o Al(OH)3 Al3+ +3OHˉ酸式电离碱式电离加酸,C(H+)加碱,C(OHˉ ) Al(OH)3 Al3+ + 3OH-
H+ +AlO2- +H2O H3AlO3
AlO2? Al(OH)3 Al3+ AlAl2O3O2OH_加热H+OH_酸OH_OH_H+小结:酸三. 铝盐明矾:KAl(SO4)2·12H2O
或K2SO4·Al2(SO4)3·24H2O(1) 物理性质:无色晶体、易溶于水(2) 化学性质:在水中完全电离。KAl(SO4)2 =K++Al3++2SO42-Al3++3H2O(胶体)Al(OH)3+3H+练习题: 1. 3.42gAl2(SO4)3加到15mlNaOH中,得到1.17g沉淀,则原NaOH的物质的量浓度是多少?(NaOH反应完全)解:(1)Al2(SO)4过量,以NaOH为标准。
Al2(SO)4+6NaOH → 2Al(OH)3↓+3Na2SO4
6 156
X=0.045 1.17
C(NaOH)=0.045/0.015=3mol/L(2) NaOH过量,以Al2(SO4)3准 。
Al2(SO)4+6NaOH → 2Al(OH)3↓+3Na2SO4
342 6 156
y=3.42 x=0.06 1.56
Al(OH)3+NaOH → NaAlO2+2H2O
78 1
1.56-1.17 z=0.005
C(NaOH)=(0.06+0.005)/0.015=4.33mol/L 2. 盛有2mL0.5mol/L的Al(OH)3溶液的试管中
滴加1mol/L的NaOH溶液至过量,将会产生什么现象?写出有关反应的化学方程式,并画出加入NaOH物质的量与产生的沉淀的量的关系图。AlCl3+3NaOH → Al(OH)3↓+3H2O1123411234n[Al(OH)3] ↓n[Al(OH)3] ↓n(NaOH)n(HCl)NaOH+HCl →NaCl+H2O(中和过量碱)Al(OH)3+NaOH →NaAlO2+2H2ONaAlO2+HCl+H2O →Al(OH)3↓+NaClAl(OH)3+3HCl →AlCl3+3H2O5
1.氧化铝的天然存在形式铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成。刚 玉
氧化铝的天然晶体,硬度大,仅次于金刚石、金刚砂(SiC)。(蓝宝石、红宝石是刚玉的一种)
(一) 氧化铝的性质 物理性质
白色、粉末状、难溶解、难熔化的固体。
化学性质
两性氧化物的性质——既与酸又与强碱
反应,但不与氨水反应。AlO2- Al2O3 Al3+HClNaOH
氧化铝的性质探究实验
现象结论化学方程式离子方程式氧化铝中
滴加盐酸氧化铝中
滴加氢氧
化钠沉淀
溶解氧化铝能
与盐酸反
应沉淀
溶解Al2O3+6HCl = 2AlCl3+3H2OAl2O3+6H+ = 2Al3+ +3H2OAl2O3+2NaOH = 2NaAlO2+ H2OAl2O3+ 2OHˉ= 2AlO2?+H2O氧化铝能
与氢氧化
钠反应氧化铝中
滴加氨水沉淀不溶解氧化铝不与氨水反应无
(二). 氢氧化铝的性质实验3-7:氢氧化铝的实验室制法____
氨水与铝盐反应AlCl3+3NH3.H2O =Al(OH)3↓+3NH4Cl
沉淀
溶解沉淀
溶解氢氧化铝与氢氧化钠反应而溶解 氢氧化铝
与盐酸反
应而溶解Al(OH)3+ NaOH = NaAlO2+2H2O Al(OH)3+OHˉ = AlO2?+2H2O Al(OH)3+3HCl = AlCl3+3 H2OAl(OH)3+3H+ = Al3++3H2O取一份氢氧化铝,向其中逐滴滴入氢氧化钠观察现象取一份氢氧化铝,向其中滴入盐酸观察现象。 向氢氧化铝中滴加氨水沉淀不溶解氢氧化铝不与氨水反应 无
AlO2? Al(OH)3 Al3+ HCl NaOH NaOH?1.氢氧化铝的物理性质
白色、胶状、难溶的物质
2.化学性质
典型的两性氢氧化物的性质——与强酸、强碱反应 H++ AlO2-+ H2O
Al(OH)3
Al3+ + 3OH-
实验三 偏铝酸盐的性质探究为什么Al(OH)3 、AlO2- 、Al3+之间能实现相互转化?
H+ + AlO2ˉ+ H2o Al(OH)3 Al3+ +3OHˉ酸式电离碱式电离加酸,C(H+)加碱,C(OHˉ ) Al(OH)3 Al3+ + 3OH-
H+ +AlO2- +H2O H3AlO3
AlO2? Al(OH)3 Al3+ AlAl2O3O2OH_加热H+OH_酸OH_OH_H+小结:酸三. 铝盐明矾:KAl(SO4)2·12H2O
或K2SO4·Al2(SO4)3·24H2O(1) 物理性质:无色晶体、易溶于水(2) 化学性质:在水中完全电离。KAl(SO4)2 =K++Al3++2SO42-Al3++3H2O(胶体)Al(OH)3+3H+练习题: 1. 3.42gAl2(SO4)3加到15mlNaOH中,得到1.17g沉淀,则原NaOH的物质的量浓度是多少?(NaOH反应完全)解:(1)Al2(SO)4过量,以NaOH为标准。
Al2(SO)4+6NaOH → 2Al(OH)3↓+3Na2SO4
6 156
X=0.045 1.17
C(NaOH)=0.045/0.015=3mol/L(2) NaOH过量,以Al2(SO4)3准 。
Al2(SO)4+6NaOH → 2Al(OH)3↓+3Na2SO4
342 6 156
y=3.42 x=0.06 1.56
Al(OH)3+NaOH → NaAlO2+2H2O
78 1
1.56-1.17 z=0.005
C(NaOH)=(0.06+0.005)/0.015=4.33mol/L 2. 盛有2mL0.5mol/L的Al(OH)3溶液的试管中
滴加1mol/L的NaOH溶液至过量,将会产生什么现象?写出有关反应的化学方程式,并画出加入NaOH物质的量与产生的沉淀的量的关系图。AlCl3+3NaOH → Al(OH)3↓+3H2O1123411234n[Al(OH)3] ↓n[Al(OH)3] ↓n(NaOH)n(HCl)NaOH+HCl →NaCl+H2O(中和过量碱)Al(OH)3+NaOH →NaAlO2+2H2ONaAlO2+HCl+H2O →Al(OH)3↓+NaClAl(OH)3+3HCl →AlCl3+3H2O5
