钠与水的反应
图片预览





文档简介
课件13张PPT。第三章 金属及其化合物第一节 金属的化学性质
二.金属与水的反应 1.金属钠和水的反应实验5:将一小块金属钠投入滴有酚酞的水中 现 象 解 释浮游熔嘶红金属钠的密度小于水产生的气体推动金属钠来回游动反应放热,钠的熔点较低剧烈反应,产生气体有碱性物质生成 2Na + 2H2O == 2NaOH + H2 生成的气体是什么 ?氢气?氧气?氢气!总结:钠的物理性质和化学性质 物理性质:为银白色的固体,质软,密度比水还小(0.97g/cm3),熔点较低(97.87℃) 化学性质: 化学性质很活泼 1.与氧气反应常温
4Na + O2 == 2Na2O
2Na + O2 === Na2O2
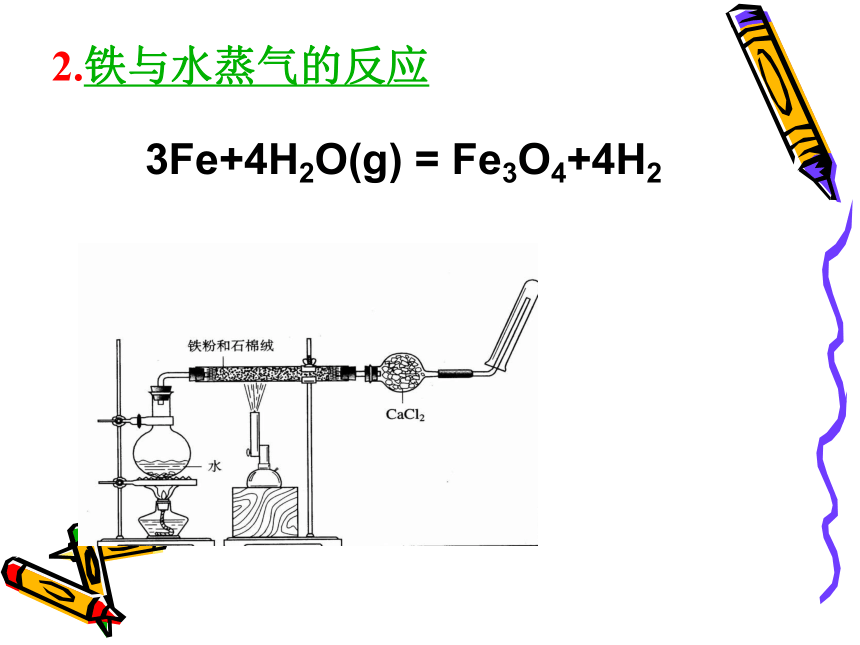
点燃2.与水反应2Na + 2H2O == 2NaOH + H22.铁与水蒸气的反应3Fe+4H2O(g) = Fe3O4+4H2三.铝与氢氧化钠溶液的反应1.铝与稀盐酸的反应化学方程式为:
2Al + 6HCl == 2AlCl3 + 3H2 离子方程式为:2Al+6H+==2Al3+ +3H2 2Al+2NaOH+2H2O==2NaAlO2+3H22.铝与氢氧化钠溶液的反应离子方程式:
2Al+2OH-+2H2O==2AlO2-+3H2因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身。铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。铝既能与强酸溶液反应也能与强碱溶液反应 以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都发生了变化,它们从0价升为正价。 在这些变化中,金属表现了强的还原性,做还原剂。 在自然界中金属多以化合态存在。只有极少数金属以游离态存在小节钠与氧气反应
钠与水反应
铁与水蒸汽反应
铝的两性作业:
书后练习7.8.9再见
二.金属与水的反应 1.金属钠和水的反应实验5:将一小块金属钠投入滴有酚酞的水中 现 象 解 释浮游熔嘶红金属钠的密度小于水产生的气体推动金属钠来回游动反应放热,钠的熔点较低剧烈反应,产生气体有碱性物质生成 2Na + 2H2O == 2NaOH + H2 生成的气体是什么 ?氢气?氧气?氢气!总结:钠的物理性质和化学性质 物理性质:为银白色的固体,质软,密度比水还小(0.97g/cm3),熔点较低(97.87℃) 化学性质: 化学性质很活泼 1.与氧气反应常温
4Na + O2 == 2Na2O
2Na + O2 === Na2O2
点燃2.与水反应2Na + 2H2O == 2NaOH + H22.铁与水蒸气的反应3Fe+4H2O(g) = Fe3O4+4H2三.铝与氢氧化钠溶液的反应1.铝与稀盐酸的反应化学方程式为:
2Al + 6HCl == 2AlCl3 + 3H2 离子方程式为:2Al+6H+==2Al3+ +3H2 2Al+2NaOH+2H2O==2NaAlO2+3H22.铝与氢氧化钠溶液的反应离子方程式:
2Al+2OH-+2H2O==2AlO2-+3H2因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身。铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。铝既能与强酸溶液反应也能与强碱溶液反应 以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都发生了变化,它们从0价升为正价。 在这些变化中,金属表现了强的还原性,做还原剂。 在自然界中金属多以化合态存在。只有极少数金属以游离态存在小节钠与氧气反应
钠与水反应
铁与水蒸汽反应
铝的两性作业:
书后练习7.8.9再见
