专题3 从矿物到基础材料 第二单元(第一课时)从自然界获取铁和铜
文档属性
| 名称 | 专题3 从矿物到基础材料 第二单元(第一课时)从自然界获取铁和铜 |  | |
| 格式 | rar | ||
| 文件大小 | 629.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-12-02 21:47:00 | ||
图片预览




文档简介
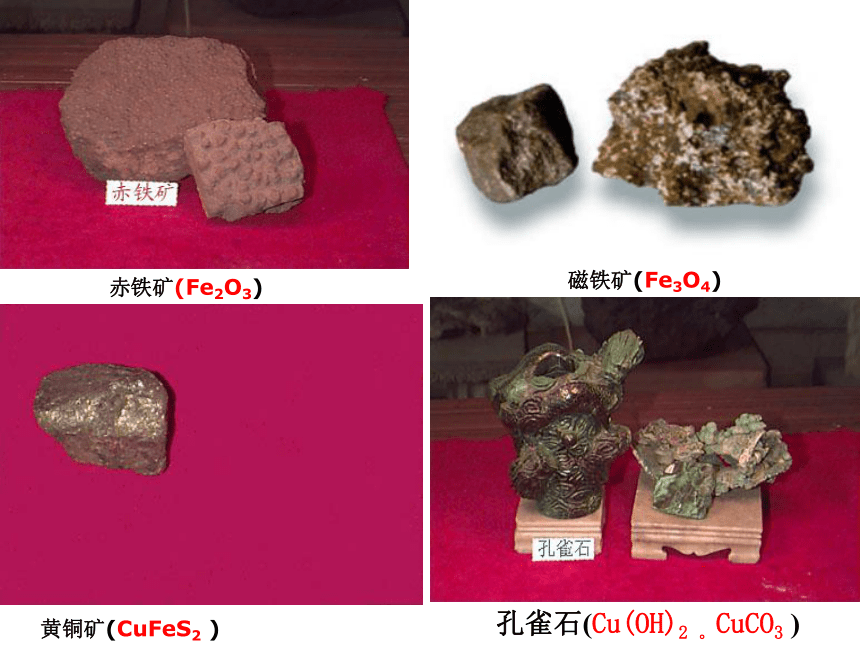
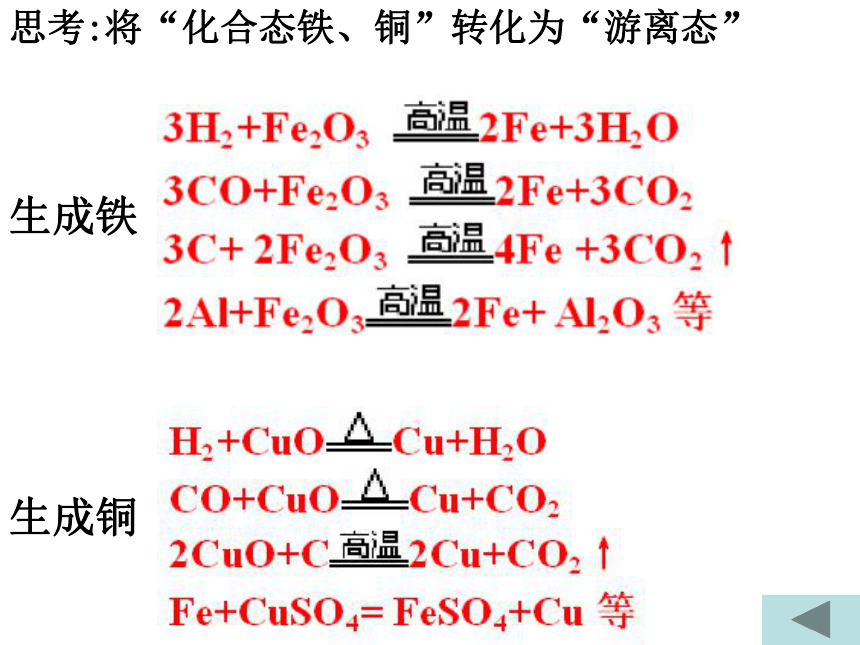
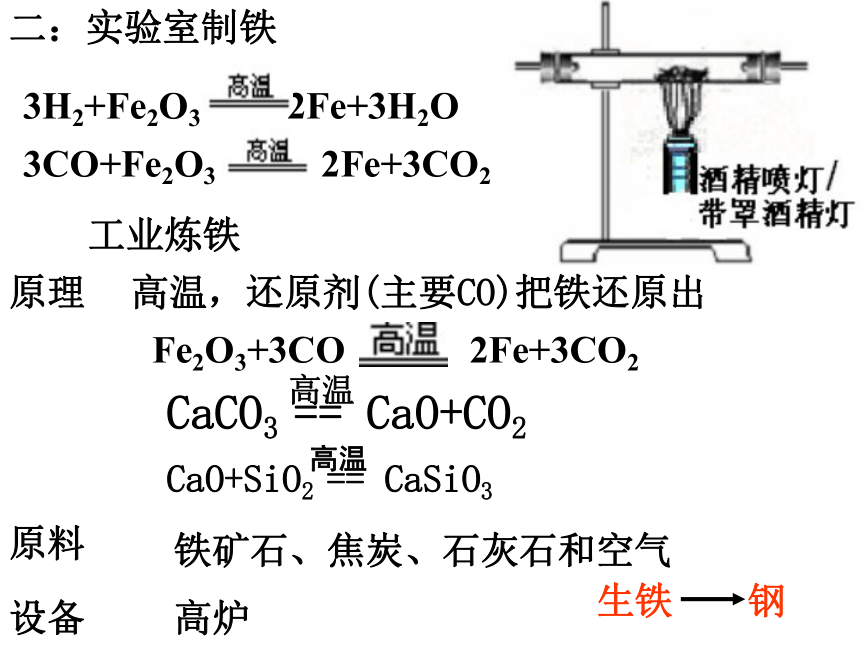
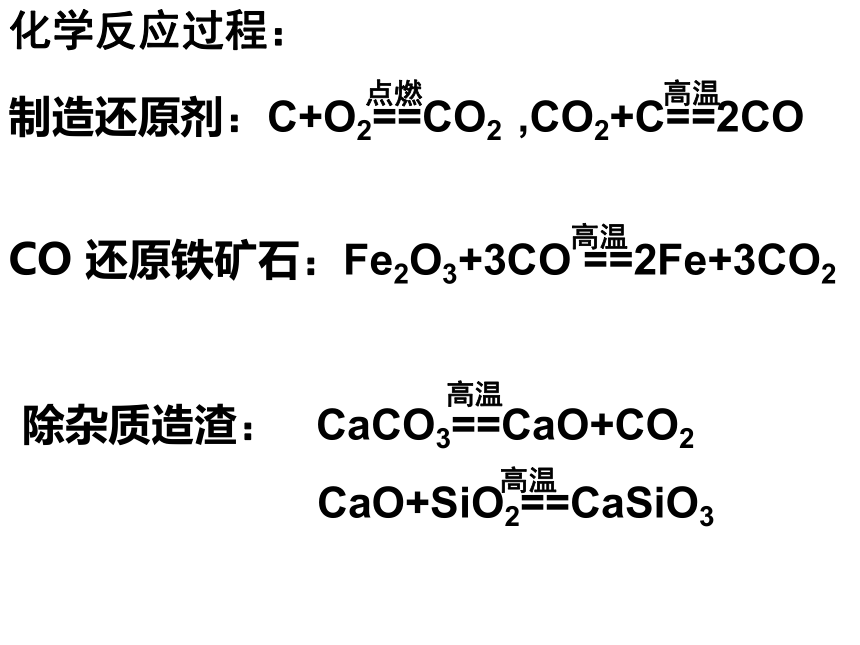
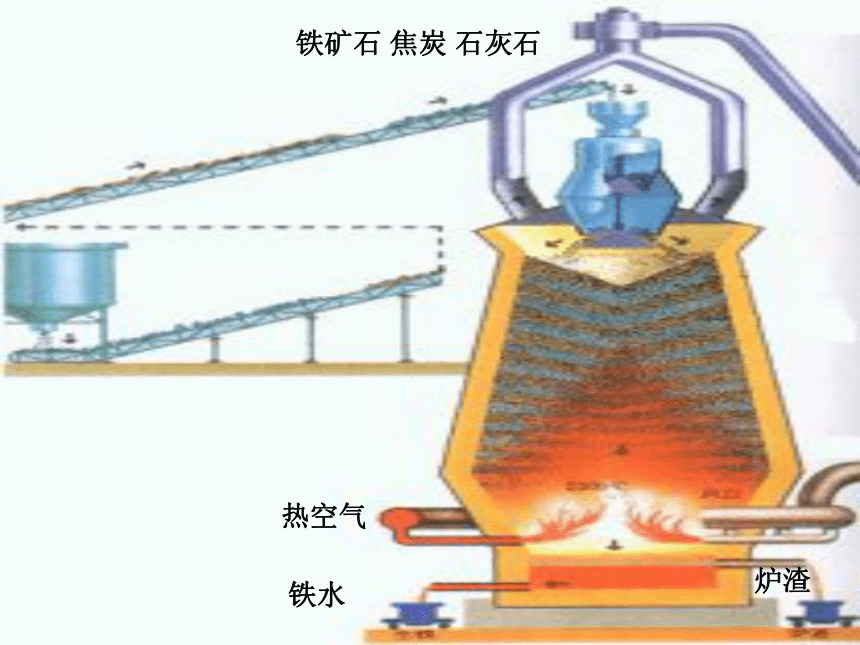
课件23张PPT。从自然界获取铁和铜从矿物到基础材料第二单元(第一课时)铁铁单质陨铁根据金属活动性顺序主要化合态、少量单质存在2、铁化合态——铜化合态铜比较活泼金属不太活泼金属磁铁矿(Fe3O4)赤铁矿(Fe2O3) 黄铜矿(CuFeS2 )孔雀石(CuCO3 .Cu(OH)2)天然单质铜思考:将“化合态铁、铜”转化为“游离态”生成铜生成铁二:实验室制铁3H2+Fe2O3 2Fe+3H2O 3CO+Fe2O3 2Fe+3CO2 铁矿石、焦炭、石灰石和空气高炉高温,还原剂(主要CO)把铁还原出Fe2O3+3CO 2Fe+3CO2 工业炼铁原理原料设备化学反应过程:铁矿石 焦炭 石灰石热空气炉渣铁水生物炼铜:工业炼铜黄铜矿
(CuFeS2)粗铜高纯铜含硫的铜矿硫酸铜→炼铜金属冶炼的一般方法 1、热分解法:2HgO 2Hg+O2↑ 、
2Ag2O 4Ag+O2↑
2、热还原法:
(使用H2 、C、CO或“用活泼金属”还原)
CuO+H2 Cu+H2O CuO+CO Cu+CO2
2CuO+C 2Cu+CO2↑
2Al+Fe2O3 2Fe+ Al2O3
3、电解方法:
2Al2O3 4Al+3O2↑ MgCl2 Mg+Cl2↑
4、湿法冶金:Fe+CuSO4= FeSO4+Cu
5、生物冶金:含硫的铜矿→硫酸铜→炼铜一、单质的物理性质1、铁是可以被磁铁吸引的银白色金属
铜是紫红色的金属。2、铁和铜都有良好的导电性和导热性。3、铁和铜的密度较大,熔沸点较高。二、单质化学性质不反应与非金属反应与盐酸反应与盐溶液反应①铜在反应中一般转化为+2价铜的化合物。特别提醒②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。3.高温下可用于还原氧化铁的化合物是( )
A.焦炭 B.氢气 C.二氧化碳 D.一氧化碳练习1.在化学反应:Fe3O4+3H2 3Fe+4H2O中,Fe3O4作 ? ?
A? 还原剂 B? 氧化剂 C? 催化剂 D? 溶剂B2.在化学反应:2Ag2O 4Ag+O2↑中,Ag2O作 ? ?
A? 还原剂 B? 氧化剂 C? 催化剂 D? 溶剂ABD5.在含有Cu(NO3)2 、Mg(NO3)2 和AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B. Cu C. Ag D. H24.西汉时期发现、宋朝初期应用于生产的湿法冶金术的反应原理是 ( )
A.CuO+H2 Cu+H2O
B.CuO+CO Cu+CO2
C.Fe+CuSO4= FeSO4+Cu D.2Cu2O+Cu2S 6Cu+SO2CC6.除去下列物质中混有的少量杂质应用怎样化学方法,写出有关反应的离子方程式。
(1)铜粉中混有铁粉:
、 。
(2)铁粉中混有铝粉:
、 。
(3)FeCl3溶液中混有FeCl2 :
、 。
(4)FeCl2溶液中混有CuCl2
、 。加入过量盐酸 Fe+2H+=Fe 2++H2↑ 加入过量NaOH 2Al+2OH-+2H2O=2AlO2-+3H2↑ 通入Cl2 2Fe2++Cl2=2Fe3++2Cl- 加入过量Fe Cu2++Fe=Fe2++Cu 铁、铜及其化合物的应用从矿物到基础材料第二单元(第二课时)本节内容:一、单质的物理性质二、单质化学性质与的鉴别三、Fe2+Fe3+与的相互转化四、五、铁及铜的化合物的应用一、单质的物理性质1、铁是可以被磁铁吸引的银白色金属
铜是紫红色的金属。2、铁和铜都有良好的导电性和导热性。3、铁和铜的密度较大,熔沸点较高。二、单质化学性质不反应与非金属反应与盐酸反应与盐溶液反应①铜在反应中一般转化为+2价铜的化合物。特别提醒②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。观察溶液颜色与KSCN反应与NaOH反应浅绿色棕黄色无明显现象溶液变为血红色白色沉淀迅速变灰
绿色最后呈红褐色立即产生红
褐色沉淀小结:氧化性较强的氧化剂如Cl2、硝酸等化合价 , 升高需加入氧化剂。还原剂。降低Fe氧化性较强的氧化剂如Cl2、硝酸等Zn 、Al、 Mg等等Zn、Al、Mg五、铁及铜的化合物的应用1、铁的化合物①Fe2O3作颜料②氯化铁、硫酸亚铁可作净水剂③作磁性材料④维持生命的微量元素2、铜的化合物:铜盐可杀菌,CuSO4溶液杀灭寄生虫,治疗皮肤病。2、要证明某溶液中不含 练习:而可能含有,进行如下实验操作时最佳顺序为①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液( )A. ①③ B. ③② C. ③① D. ①②③C1、向某溶液中加入含的溶液后,无明显变化,当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是 ( )B
(CuFeS2)粗铜高纯铜含硫的铜矿硫酸铜→炼铜金属冶炼的一般方法 1、热分解法:2HgO 2Hg+O2↑ 、
2Ag2O 4Ag+O2↑
2、热还原法:
(使用H2 、C、CO或“用活泼金属”还原)
CuO+H2 Cu+H2O CuO+CO Cu+CO2
2CuO+C 2Cu+CO2↑
2Al+Fe2O3 2Fe+ Al2O3
3、电解方法:
2Al2O3 4Al+3O2↑ MgCl2 Mg+Cl2↑
4、湿法冶金:Fe+CuSO4= FeSO4+Cu
5、生物冶金:含硫的铜矿→硫酸铜→炼铜一、单质的物理性质1、铁是可以被磁铁吸引的银白色金属
铜是紫红色的金属。2、铁和铜都有良好的导电性和导热性。3、铁和铜的密度较大,熔沸点较高。二、单质化学性质不反应与非金属反应与盐酸反应与盐溶液反应①铜在反应中一般转化为+2价铜的化合物。特别提醒②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。3.高温下可用于还原氧化铁的化合物是( )
A.焦炭 B.氢气 C.二氧化碳 D.一氧化碳练习1.在化学反应:Fe3O4+3H2 3Fe+4H2O中,Fe3O4作 ? ?
A? 还原剂 B? 氧化剂 C? 催化剂 D? 溶剂B2.在化学反应:2Ag2O 4Ag+O2↑中,Ag2O作 ? ?
A? 还原剂 B? 氧化剂 C? 催化剂 D? 溶剂ABD5.在含有Cu(NO3)2 、Mg(NO3)2 和AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B. Cu C. Ag D. H24.西汉时期发现、宋朝初期应用于生产的湿法冶金术的反应原理是 ( )
A.CuO+H2 Cu+H2O
B.CuO+CO Cu+CO2
C.Fe+CuSO4= FeSO4+Cu D.2Cu2O+Cu2S 6Cu+SO2CC6.除去下列物质中混有的少量杂质应用怎样化学方法,写出有关反应的离子方程式。
(1)铜粉中混有铁粉:
、 。
(2)铁粉中混有铝粉:
、 。
(3)FeCl3溶液中混有FeCl2 :
、 。
(4)FeCl2溶液中混有CuCl2
、 。加入过量盐酸 Fe+2H+=Fe 2++H2↑ 加入过量NaOH 2Al+2OH-+2H2O=2AlO2-+3H2↑ 通入Cl2 2Fe2++Cl2=2Fe3++2Cl- 加入过量Fe Cu2++Fe=Fe2++Cu 铁、铜及其化合物的应用从矿物到基础材料第二单元(第二课时)本节内容:一、单质的物理性质二、单质化学性质与的鉴别三、Fe2+Fe3+与的相互转化四、五、铁及铜的化合物的应用一、单质的物理性质1、铁是可以被磁铁吸引的银白色金属
铜是紫红色的金属。2、铁和铜都有良好的导电性和导热性。3、铁和铜的密度较大,熔沸点较高。二、单质化学性质不反应与非金属反应与盐酸反应与盐溶液反应①铜在反应中一般转化为+2价铜的化合物。特别提醒②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。观察溶液颜色与KSCN反应与NaOH反应浅绿色棕黄色无明显现象溶液变为血红色白色沉淀迅速变灰
绿色最后呈红褐色立即产生红
褐色沉淀小结:氧化性较强的氧化剂如Cl2、硝酸等化合价 , 升高需加入氧化剂。还原剂。降低Fe氧化性较强的氧化剂如Cl2、硝酸等Zn 、Al、 Mg等等Zn、Al、Mg五、铁及铜的化合物的应用1、铁的化合物①Fe2O3作颜料②氯化铁、硫酸亚铁可作净水剂③作磁性材料④维持生命的微量元素2、铜的化合物:铜盐可杀菌,CuSO4溶液杀灭寄生虫,治疗皮肤病。2、要证明某溶液中不含 练习:而可能含有,进行如下实验操作时最佳顺序为①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液( )A. ①③ B. ③② C. ③① D. ①②③C1、向某溶液中加入含的溶液后,无明显变化,当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是 ( )B
