专题三 盐类的水解 第二课时
图片预览







文档简介
课件21张PPT。 第三单元
盐类的水解
(第二课时)实质:盐类的水解
定义:在水溶液中盐电离产生的离子跟水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应水解的条件:形式:结果:复习巩固生成弱电解质使水的电离平衡移动促进了水的电离,使溶液呈酸碱性。规律小结:
谁弱谁水解,谁强显谁性,
双弱双水解,无弱不水解;
注意:水解程度都是微弱的。
?思考? ???
试判断下列盐类的水溶液的酸碱性:
NaF MgCl2 Na2S Al2(SO4)3
FeCl3 NaCN Ba(NO3)2
BaCl2 Na2CO3
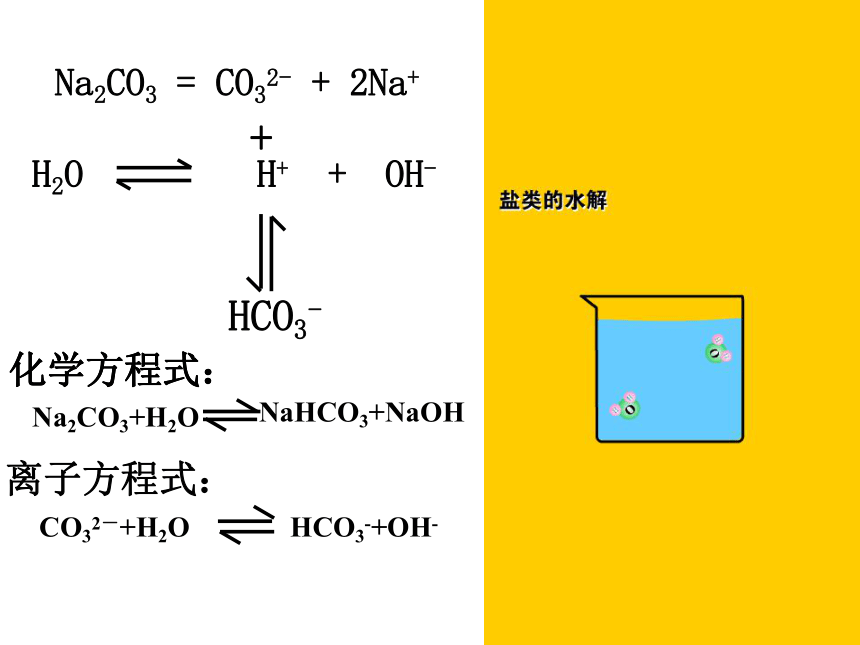
纯碱不是碱,是盐???Na2CO3 = CO32- + 2Na++HCO3-化学方程式:离子方程式:化学方程式:H2O H+ + OH_
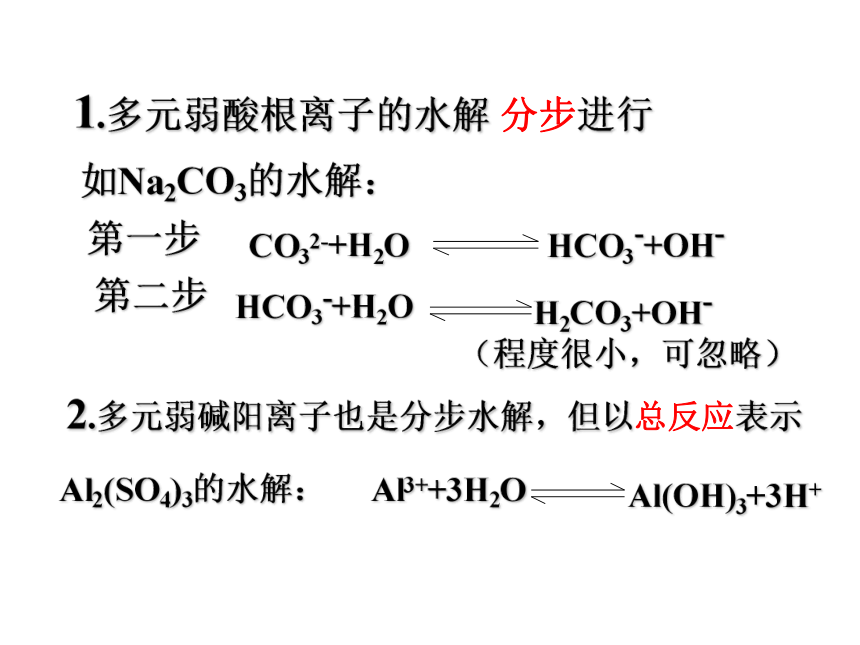
CO32-+H2O HCO3- +OH- (第一步水解)HCO3- +H2O H2CO3+OH- (第二步水解,很小)Na2CO3 = CO32- + 2Na+ +碳酸钠的水解 多元弱酸阴离子或多元弱碱阳离子是分步水解的,一步比一步的程度小补充 说明1.多元弱酸根离子的水解 分步进行如Na2CO3的水解:第一步第二步(程度很小,可忽略)2.多元弱碱阳离子也是分步水解,但以总反应表示Al2(SO4)3的水解:HCO3-+OH-H2CO3+OH-Al(OH)3+3H+CH3COONa + H2O CH3COOH+NaOHCH3COO- +H2O CH3COOH+OH_NH4Cl + H2O NH3·H2O +H ClNH4 + + H2O NH3·H2O +H+
1.一元弱酸强碱盐2.一元弱碱强酸盐CO32-+H2O HCO3- +OH- (第一步水解)HCH2O3- +H2O H2CO3+OH- (第二步水解,很小)NaHCO3 +H2O H2CO3+NaOH3.多元弱酸强碱盐4.多元弱碱强酸盐Al(OH)3+3H+AlCl3 +3H2O Al(OH)3+3HCl盐类的水解书写中应注意电荷守恒与质量守恒. 随堂练习下列水解离子方程式正确的是( )
A.Fe3+ + 3H2O Fe(OH)3 ↓ + 3H+
B.Br- + H2O HBr + OH-
C.CO32- + 2H2O H2CO3 + 2OH-
D.NH4+ +2H2O NH3·H2O + H3O+
D1. (盐类)水解的实质:溶液中盐电离出来的离子跟____ 电离出来的H+或OH-结合生成___________ 的反应;
2 只有_____________离子或___________离子才能与 水中H+或OH-结合生成弱电解质;水弱电解质弱酸酸根离子弱碱阳离子巩固练习 1.在溶液中,不能发生水解的离子是( )
A、ClO - B、CO32-
C、Fe3+ D、SO42--D随堂练习2. 下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
A. FeCl3 B. NaClO C. (NH4)2SO4
D. Na2S E.K2SO4
F. KI G. NaF ACBDG 随堂练习3. 盐类水解的过程中正确的说法是( )
A.盐的电离平衡破坏
B.水的电离平衡发生移动
C.溶液的pH减小
D.水的离子积发生了变化
B随堂练习练一练:
(1)FeCl3 (2) CuSO4
(3)K2CO3 (4)KI (5)Al2(SO4)3 补充作业:书写下列物质水解反应的化学方程式和离子方程式。CuCl2:
NaF :
NH4Cl:
Na2CO3:
Mg3N2:
Al2S3:
盐类的水解
(第二课时)实质:盐类的水解
定义:在水溶液中盐电离产生的离子跟水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应水解的条件:形式:结果:复习巩固生成弱电解质使水的电离平衡移动促进了水的电离,使溶液呈酸碱性。规律小结:
谁弱谁水解,谁强显谁性,
双弱双水解,无弱不水解;
注意:水解程度都是微弱的。
?思考? ???
试判断下列盐类的水溶液的酸碱性:
NaF MgCl2 Na2S Al2(SO4)3
FeCl3 NaCN Ba(NO3)2
BaCl2 Na2CO3
纯碱不是碱,是盐???Na2CO3 = CO32- + 2Na++HCO3-化学方程式:离子方程式:化学方程式:H2O H+ + OH_
CO32-+H2O HCO3- +OH- (第一步水解)HCO3- +H2O H2CO3+OH- (第二步水解,很小)Na2CO3 = CO32- + 2Na+ +碳酸钠的水解 多元弱酸阴离子或多元弱碱阳离子是分步水解的,一步比一步的程度小补充 说明1.多元弱酸根离子的水解 分步进行如Na2CO3的水解:第一步第二步(程度很小,可忽略)2.多元弱碱阳离子也是分步水解,但以总反应表示Al2(SO4)3的水解:HCO3-+OH-H2CO3+OH-Al(OH)3+3H+CH3COONa + H2O CH3COOH+NaOHCH3COO- +H2O CH3COOH+OH_NH4Cl + H2O NH3·H2O +H ClNH4 + + H2O NH3·H2O +H+
1.一元弱酸强碱盐2.一元弱碱强酸盐CO32-+H2O HCO3- +OH- (第一步水解)HCH2O3- +H2O H2CO3+OH- (第二步水解,很小)NaHCO3 +H2O H2CO3+NaOH3.多元弱酸强碱盐4.多元弱碱强酸盐Al(OH)3+3H+AlCl3 +3H2O Al(OH)3+3HCl盐类的水解书写中应注意电荷守恒与质量守恒. 随堂练习下列水解离子方程式正确的是( )
A.Fe3+ + 3H2O Fe(OH)3 ↓ + 3H+
B.Br- + H2O HBr + OH-
C.CO32- + 2H2O H2CO3 + 2OH-
D.NH4+ +2H2O NH3·H2O + H3O+
D1. (盐类)水解的实质:溶液中盐电离出来的离子跟____ 电离出来的H+或OH-结合生成___________ 的反应;
2 只有_____________离子或___________离子才能与 水中H+或OH-结合生成弱电解质;水弱电解质弱酸酸根离子弱碱阳离子巩固练习 1.在溶液中,不能发生水解的离子是( )
A、ClO - B、CO32-
C、Fe3+ D、SO42--D随堂练习2. 下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
A. FeCl3 B. NaClO C. (NH4)2SO4
D. Na2S E.K2SO4
F. KI G. NaF ACBDG 随堂练习3. 盐类水解的过程中正确的说法是( )
A.盐的电离平衡破坏
B.水的电离平衡发生移动
C.溶液的pH减小
D.水的离子积发生了变化
B随堂练习练一练:
(1)FeCl3 (2) CuSO4
(3)K2CO3 (4)KI (5)Al2(SO4)3 补充作业:书写下列物质水解反应的化学方程式和离子方程式。CuCl2:
NaF :
NH4Cl:
Na2CO3:
Mg3N2:
Al2S3:
