化学平衡移动
图片预览






文档简介
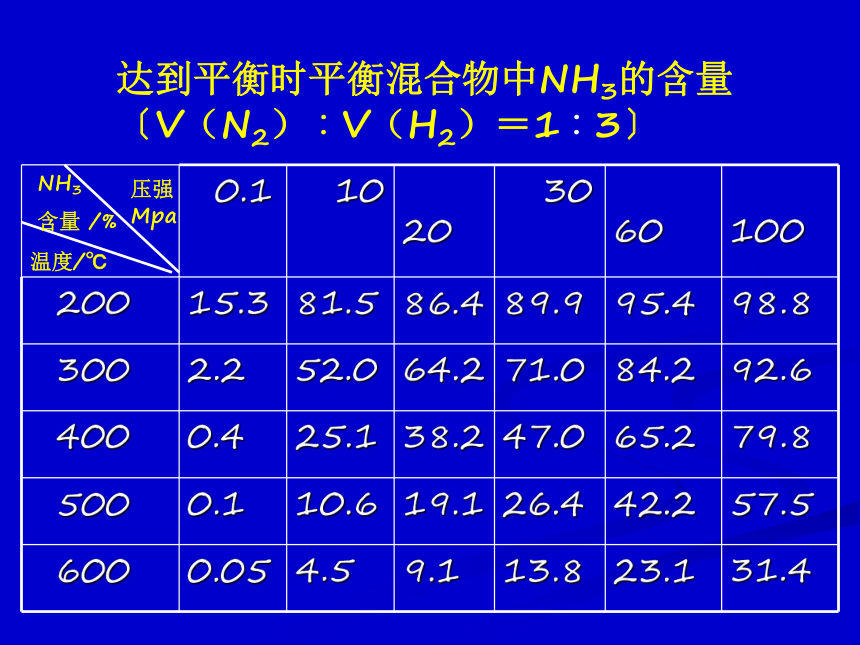
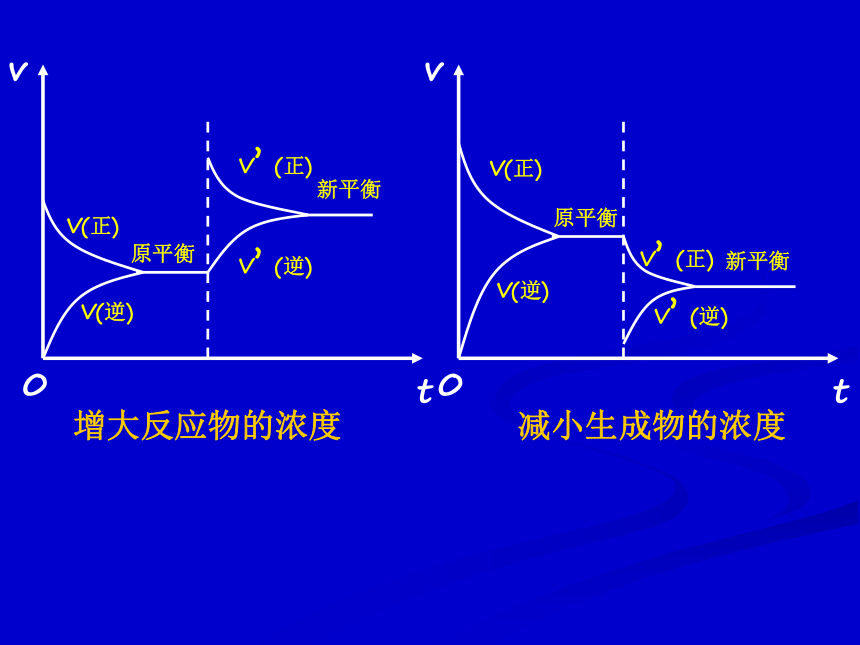
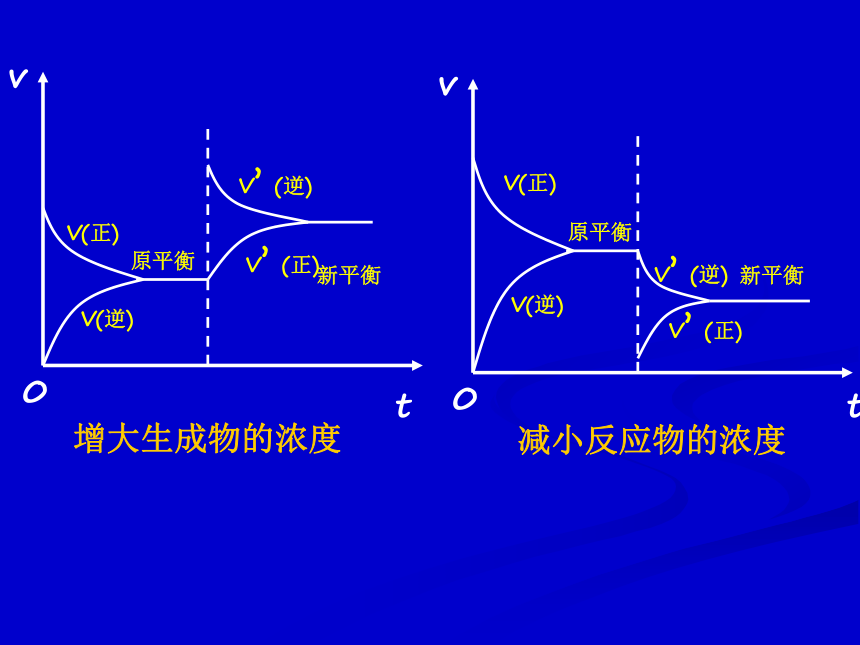
课件22张PPT。第三单元 化学平衡的移动化学平衡的移动: 改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。达到平衡时平衡混合物中NH3的含量〔V(N2)︰V(H2)=1︰3〕 在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆反应方向移动。1、浓度变化对化学平衡的影响P50 活动与探究新平衡注意
(1)增加固体或纯液体的量,由于浓度不变,所以化学平衡不移动。
(2)在溶液中进行的反应,如果是稀释溶液,反应物浓度减小,生成物浓度减小, V(正) 、V(逆)都减小,但减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。B练习2、在密闭容器中进行下列反应达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:(1)增加C,平衡 c(CO) . 不移动不变2、压强变化对化学平衡的影响增大压强,则 a﹥1若 m+n﹥p+q ,则K’ ﹤ K ,平衡正向移动。若 m+n﹤p+q ,则K’ ﹥ K ,平衡逆向移动。若 m+n=p+q ,则K’ =K ,平衡不发生移动。增大压强,a﹥1减小压强,则 a﹤1若 m+n﹥p+q ,则K’ ﹥ K ,平衡逆向移动。若 m+n﹤p+q ,则K’ ﹤ K ,平衡正向移动。若 m+n=p+q ,则K’ =K ,平衡不发生移动。减小压强,则 a﹤1m+n﹥p+qm+n﹤p+q练习3、在密闭容器中进行下列反应达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:(2)减小密闭容器体积,保持温度不变,则平衡 ; c(CO2) 。 (3)通入N2,保持密闭容器体积和温度不变,则平衡 ; c(CO2) 。 (4)通入N2,保持密闭容器压强和温度不变,则平衡 ; c(CO2) 。 逆向移动增大不移动不变正向移动减小练习4:在一密闭容器中充入1 molNO2,建立平衡:测得NO2转化率为a%。在其它条件不变时,再充入1 molNO2 ,待新平衡建立时,又测NO2的转化率为b%,问 a、b值的大小关系。b﹥a温度升高,平衡向吸热方向移动;
温度降低,平衡向放热方向移动。3、温度变化对化学平衡的影响升高温度降低温度(正反应为放热反应)的正确图像为:AC4、催化剂对化学平衡的影响化学平衡移动原理(勒夏特列原理) 改变影响化学平衡的一个因素,平衡将向能减弱这种改变的方向移动。“减弱”的双重含义定性角度:平衡移动的方向为减弱外界改变的方向。定量角度:移动的结果只是减弱了外界条件的变化, 而不能完全抵消外界条件的变化量。
(1)增加固体或纯液体的量,由于浓度不变,所以化学平衡不移动。
(2)在溶液中进行的反应,如果是稀释溶液,反应物浓度减小,生成物浓度减小, V(正) 、V(逆)都减小,但减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。B练习2、在密闭容器中进行下列反应达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:(1)增加C,平衡 c(CO) . 不移动不变2、压强变化对化学平衡的影响增大压强,则 a﹥1若 m+n﹥p+q ,则K’ ﹤ K ,平衡正向移动。若 m+n﹤p+q ,则K’ ﹥ K ,平衡逆向移动。若 m+n=p+q ,则K’ =K ,平衡不发生移动。增大压强,a﹥1减小压强,则 a﹤1若 m+n﹥p+q ,则K’ ﹥ K ,平衡逆向移动。若 m+n﹤p+q ,则K’ ﹤ K ,平衡正向移动。若 m+n=p+q ,则K’ =K ,平衡不发生移动。减小压强,则 a﹤1m+n﹥p+qm+n﹤p+q练习3、在密闭容器中进行下列反应达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:(2)减小密闭容器体积,保持温度不变,则平衡 ; c(CO2) 。 (3)通入N2,保持密闭容器体积和温度不变,则平衡 ; c(CO2) 。 (4)通入N2,保持密闭容器压强和温度不变,则平衡 ; c(CO2) 。 逆向移动增大不移动不变正向移动减小练习4:在一密闭容器中充入1 molNO2,建立平衡:测得NO2转化率为a%。在其它条件不变时,再充入1 molNO2 ,待新平衡建立时,又测NO2的转化率为b%,问 a、b值的大小关系。b﹥a温度升高,平衡向吸热方向移动;
温度降低,平衡向放热方向移动。3、温度变化对化学平衡的影响升高温度降低温度(正反应为放热反应)的正确图像为:AC4、催化剂对化学平衡的影响化学平衡移动原理(勒夏特列原理) 改变影响化学平衡的一个因素,平衡将向能减弱这种改变的方向移动。“减弱”的双重含义定性角度:平衡移动的方向为减弱外界改变的方向。定量角度:移动的结果只是减弱了外界条件的变化, 而不能完全抵消外界条件的变化量。
