离子反应书写规律
图片预览






文档简介
课件16张PPT。离 子 反 应
李 娜复习提问 1.离子反应的定义?
2.离子反应的发生条件?
3.什么是离子反应方程式?
4.离子反应方程式的书写步骤 ?三.离子方程式的书写规律:(一).强酸、强碱、易溶盐这些强电解质拆写成离子形式(须记住溶解性表中常见的难溶和易溶物质)。
强酸如:HCl、H2SO4、HNO3、
HClO4 、HBr、HI。
强碱如:NaOH、KOH 、Ca(OH)2、
Ba(OH)2等。
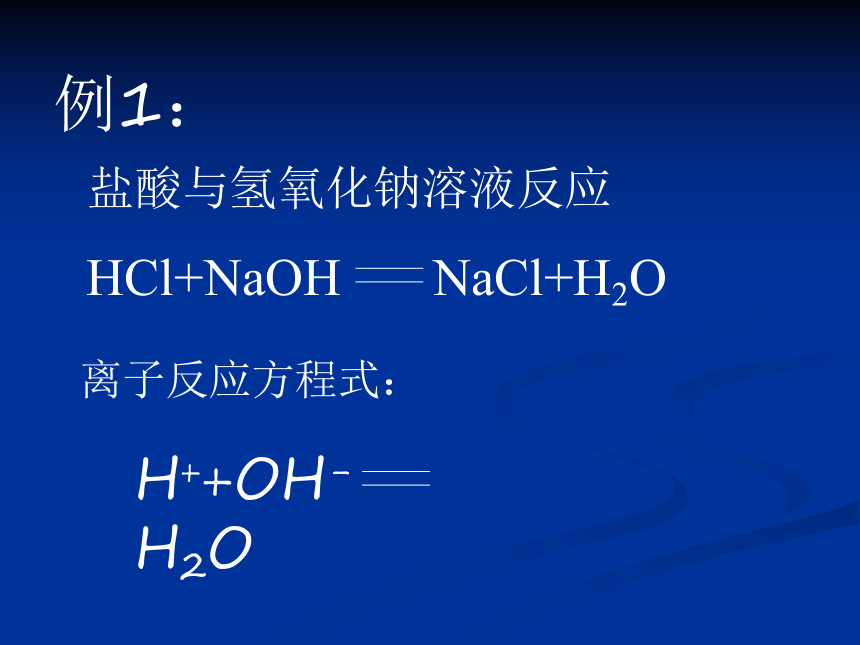
大多数的盐均为强电解质。例1:盐酸与氢氧化钠溶液反应 HCl+NaOH NaCl+H2O离子反应方程式:H++OH- H2O练习:氯化铁溶液与硫氢化钾溶液反应 FeCl3+3KSCN Fe(SCN)3+3KCl离子反应方程式:Fe3+ + 3SCN- Fe(SCN)3(二).难溶(或微溶)性物质、难电离的物质、挥发性物质、单质、氧化物等都要写成分子式。 难溶性物质较多,化学课本后面的附录“部分酸、
碱和盐的溶解性表”
难电离的物质,包括一些弱酸、弱碱及其水等弱电
解质。如: HClO、HF(氢氟酸)、H2SO3、
H3PO4、H2S(氢硫酸)、H2SiO3、NH3?H2O。可溶
性盐类,
一般说来属易电离的物质,但也有少数可溶性盐
难电离,如:Fe(SCN)3、(CH3COO)2Pb等。其它难
电离的物质还有水、苯酚、乙酸等。
挥发性物质,一般是指常温下沸点较低的气态物
质。如:Cl2、CO2、SO2、H2S、NH3等。
单质、氧化物也很多,这里不一一列举。例2:硫酸和氢氧化钡溶液反应 H2SO4+Ba(OH)2 BaSO4 +2H2O 离子反应方程式:2H+ + SO42- + Ba2+ +2OH- BaSO4↓+ 2H2O↓1.MnO2+4HCl MnCl2+Cl2 +2H2O
2.Zn+CuSO4 ZnSO4+Cu
3.2Na+CuSO4+H2O Na2SO4+
Cu(OH)2 +H2练习:↓↓↓(三).微溶物如作为反应物,强调其溶解
一面,按可溶物处理,写成离子符号(要注意
浓度的大小,如果固体或悬浊液参加反应则写
为化学式);如作为产物,强调其不溶一面写
成化学式。微溶物Ca(OH)2在水中的存在形态
问题值得注意:在澄清石灰水中, Ca(OH)2是以
Ca2+离子和OH-离子的形式存在,在书写离子方
程式时应写成离子形式;若是氢氧化钙悬浊液
(石灰乳), Ca(OH)2多以分子形式存在于溶液中
所以在书写离子方程式时应写分子式。例3:澄清石灰水与碳酸钠溶液反应石灰乳与碳酸钠溶液反应Ca2++CO32- 2CaCO3↓Ca(OH)2+CO32- CaCO3+2OH- 练习:CaCl2+2NaOH Ca(OH)2 ↓+2NaClCa(OH)2+Ca(HCO)2=2CaCO3↓+2H2O(四).固体间的反应(非熔融状态)、浓硫酸和固体发生的反应,不写离子方程式,用普通的化学反应方程式表示反应的情况。
NaNO3(固)+H2SO4(浓)NaHSO4+HNO3↑
2NH4Cl(固)+ Ca(OH)2(固)= CaCl2+2H2O+2NH3↑(五).弱酸、中强酸作为反应物;弱碱出现在离子方程式中一律写成化学式。例:CH3COOH+OH-=H2O+CH3COO- CH3COOH+NaOH=H2O+CH3COONaH3PO4+NaOH= Na2HPO4+H2O 练习:2HCl+Na2S=H2S↑+2NaCl CuSO4+2NH3?H2O= Cu(OH)2↓
+(NH4)2SO4 (六).铵盐与强碱在水中反应,若加热或在浓溶液中,产物应写作NH3↑+H2O,不加热则写作NH3·H2O。氯化铵稀溶液中加入少量氢氧化钠溶液 例:氯化铵浓溶液中加入少量氢氧化钠溶液 NH4+ + OH- = NH3?H2O NH4+ + OH- = NH3↑+H2O(七) 酸式盐中只有HSO4-可拆写为H+和SO42-,而HCO3ˉ、HSO3ˉ、HSˉ、H2PO4ˉ、HPO42-不能拆写。 碳酸氢钠溶液中滴加盐酸: ?
硫酸氢钠溶液和氢氧化钡溶液以溶质的物质的量比1:1反应:
?HCO3- + H+ = CO2↑+ H2OBa2++H++OH-+SO42-=BaSO4↓+H2O
李 娜复习提问 1.离子反应的定义?
2.离子反应的发生条件?
3.什么是离子反应方程式?
4.离子反应方程式的书写步骤 ?三.离子方程式的书写规律:(一).强酸、强碱、易溶盐这些强电解质拆写成离子形式(须记住溶解性表中常见的难溶和易溶物质)。
强酸如:HCl、H2SO4、HNO3、
HClO4 、HBr、HI。
强碱如:NaOH、KOH 、Ca(OH)2、
Ba(OH)2等。
大多数的盐均为强电解质。例1:盐酸与氢氧化钠溶液反应 HCl+NaOH NaCl+H2O离子反应方程式:H++OH- H2O练习:氯化铁溶液与硫氢化钾溶液反应 FeCl3+3KSCN Fe(SCN)3+3KCl离子反应方程式:Fe3+ + 3SCN- Fe(SCN)3(二).难溶(或微溶)性物质、难电离的物质、挥发性物质、单质、氧化物等都要写成分子式。 难溶性物质较多,化学课本后面的附录“部分酸、
碱和盐的溶解性表”
难电离的物质,包括一些弱酸、弱碱及其水等弱电
解质。如: HClO、HF(氢氟酸)、H2SO3、
H3PO4、H2S(氢硫酸)、H2SiO3、NH3?H2O。可溶
性盐类,
一般说来属易电离的物质,但也有少数可溶性盐
难电离,如:Fe(SCN)3、(CH3COO)2Pb等。其它难
电离的物质还有水、苯酚、乙酸等。
挥发性物质,一般是指常温下沸点较低的气态物
质。如:Cl2、CO2、SO2、H2S、NH3等。
单质、氧化物也很多,这里不一一列举。例2:硫酸和氢氧化钡溶液反应 H2SO4+Ba(OH)2 BaSO4 +2H2O 离子反应方程式:2H+ + SO42- + Ba2+ +2OH- BaSO4↓+ 2H2O↓1.MnO2+4HCl MnCl2+Cl2 +2H2O
2.Zn+CuSO4 ZnSO4+Cu
3.2Na+CuSO4+H2O Na2SO4+
Cu(OH)2 +H2练习:↓↓↓(三).微溶物如作为反应物,强调其溶解
一面,按可溶物处理,写成离子符号(要注意
浓度的大小,如果固体或悬浊液参加反应则写
为化学式);如作为产物,强调其不溶一面写
成化学式。微溶物Ca(OH)2在水中的存在形态
问题值得注意:在澄清石灰水中, Ca(OH)2是以
Ca2+离子和OH-离子的形式存在,在书写离子方
程式时应写成离子形式;若是氢氧化钙悬浊液
(石灰乳), Ca(OH)2多以分子形式存在于溶液中
所以在书写离子方程式时应写分子式。例3:澄清石灰水与碳酸钠溶液反应石灰乳与碳酸钠溶液反应Ca2++CO32- 2CaCO3↓Ca(OH)2+CO32- CaCO3+2OH- 练习:CaCl2+2NaOH Ca(OH)2 ↓+2NaClCa(OH)2+Ca(HCO)2=2CaCO3↓+2H2O(四).固体间的反应(非熔融状态)、浓硫酸和固体发生的反应,不写离子方程式,用普通的化学反应方程式表示反应的情况。
NaNO3(固)+H2SO4(浓)NaHSO4+HNO3↑
2NH4Cl(固)+ Ca(OH)2(固)= CaCl2+2H2O+2NH3↑(五).弱酸、中强酸作为反应物;弱碱出现在离子方程式中一律写成化学式。例:CH3COOH+OH-=H2O+CH3COO- CH3COOH+NaOH=H2O+CH3COONaH3PO4+NaOH= Na2HPO4+H2O 练习:2HCl+Na2S=H2S↑+2NaCl CuSO4+2NH3?H2O= Cu(OH)2↓
+(NH4)2SO4 (六).铵盐与强碱在水中反应,若加热或在浓溶液中,产物应写作NH3↑+H2O,不加热则写作NH3·H2O。氯化铵稀溶液中加入少量氢氧化钠溶液 例:氯化铵浓溶液中加入少量氢氧化钠溶液 NH4+ + OH- = NH3?H2O NH4+ + OH- = NH3↑+H2O(七) 酸式盐中只有HSO4-可拆写为H+和SO42-,而HCO3ˉ、HSO3ˉ、HSˉ、H2PO4ˉ、HPO42-不能拆写。 碳酸氢钠溶液中滴加盐酸: ?
硫酸氢钠溶液和氢氧化钡溶液以溶质的物质的量比1:1反应:
?HCO3- + H+ = CO2↑+ H2OBa2++H++OH-+SO42-=BaSO4↓+H2O
