化学键
图片预览






文档简介
课件22张PPT。 第三节 化学键你有想过吗?
1.为什么一百多种元素可形成千千万万种物质?
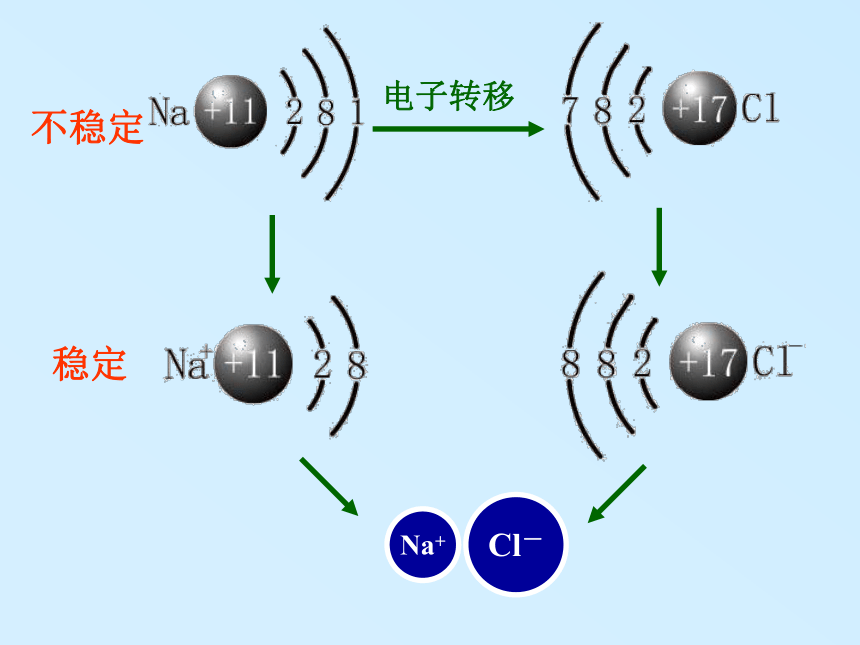
2. 为什么两个氢原子可以形成氢分子,而两个氦原子却不能形成氦分子?3.化合物中原子为什么总是按一定数目相结合? 离 子 键化 学 键——实验1—2:钠在氯气中燃烧Na在Cl2中剧烈燃烧,生成的NaCl小颗粒悬浮在空气中呈白烟状思考与交流: 试解释NaCl是怎样形成的。不稳定稳定1 定义:象Na+与Cl-之间,带相反电荷离子之间的相互作用称为离子键。阴、阳离子 静电引力离子键3.离子键的实质:静电作用静电斥力4 活泼的金属元素(IA,IIA)和活泼的非金属
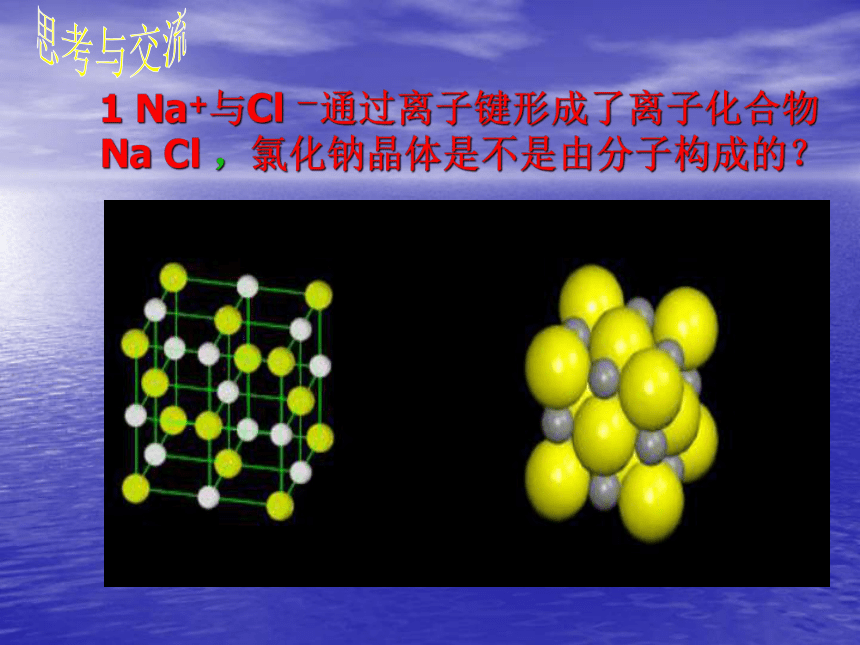
元素(VIA,VIIA)形成的化合物。 这是成 键 条 件哦!由离子键构成的化合物叫做离子化合物。1 Na+与Cl -通过离子键形成了离子化合物Na Cl ,氯化钠晶体是不是由分子构成的?思考与交流2 同种元素的原子和离子的化学性质是否相同?不同,因为它们的结构不同。氯化钠晶体中不存在氯化钠分子,只存在Na+与Cl -,构成氯化钠晶体的粒子是离子而不是分子。 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg ·原子的电子式:离子的电子式:H+Na+Mg2+电子式 2、非金属阴离子的电子式要标 [ ] 及“ 电荷数 ”。离子化合物的电子式:3、离子化合物的电子式就是由阴、阳离子的电子式合并而成。在元素符号周围用用“ · ”表示最外层电子Na+如何用电子式表示离子化合物的形成过程? 例:用电子式表示氯化钾、溴化钙的形成过程 K ·+→K +·Ca·++→Ca2+
1.原子A的电子式 + 原子B的电子式→化合物的电子式 2.不能把“→”写成“=”。 3.在箭号右边,不能把相同离子合并在一起,应逐个写。注意+·Ca·
→
Ca2+2错误 写出下列粒子的电子式:
硫原子, 溴离子, 钾离子K+
氟化镁Mg2+⑴ 用电子式表示氧化镁的形成过程 · Mg ·+→Mg2+⑵ 用电子式表示硫化钾的形成过程 2+→K+K++
K·
+K+→ K+
原子A的电子式 + 原子B的电子式 → 化合物的电子式 K·
K·
一.离子键:使阴、阳离子结合成化合物的静电作用。[思考与讨论]1.通常情况下,哪些元素之间最易形成离子化合物? 2.离子键是一种什么性质的 相互作用?3.离子化合物溶于水或熔化时离子键是否发生变化?活泼金属与活泼非金属阴阳离子间的静电作用 (静电吸引=静电排斥)转化成自由移动的离子,离子键即被破坏。离子键:使阴、阳离子结合成化合物的静电作用.
(成键粒子、成键条件)
活泼金属原子M活泼非金属原子N失去电子得到电子阳离子Mm+阴离子Nn-静电作用 静电吸引=静电排斥离 子 键 影 响 因 素 ①离子半径 ②离子电荷
离子化合物用电子式表示例本节小结课堂练习练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
D练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C. 11与17 D.6与14C3、M是元素周期表中ⅡA族元素,Y是ⅦA族元素,M、Y的两种单质化合生成Z。下列有关Z的判断错误的是
A.Z一定是离子化合物
B.Z的熔点、沸点高
C.Z一定溶于水
D.形成Z的反应用电子式表达为:D4、某化合物XY2中,各离子的电子层结构相同,且电子总数为54,则XY2的化学式为________________,电子式为
______________CaCl2The end
1.为什么一百多种元素可形成千千万万种物质?
2. 为什么两个氢原子可以形成氢分子,而两个氦原子却不能形成氦分子?3.化合物中原子为什么总是按一定数目相结合? 离 子 键化 学 键——实验1—2:钠在氯气中燃烧Na在Cl2中剧烈燃烧,生成的NaCl小颗粒悬浮在空气中呈白烟状思考与交流: 试解释NaCl是怎样形成的。不稳定稳定1 定义:象Na+与Cl-之间,带相反电荷离子之间的相互作用称为离子键。阴、阳离子 静电引力离子键3.离子键的实质:静电作用静电斥力4 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)形成的化合物。 这是成 键 条 件哦!由离子键构成的化合物叫做离子化合物。1 Na+与Cl -通过离子键形成了离子化合物Na Cl ,氯化钠晶体是不是由分子构成的?思考与交流2 同种元素的原子和离子的化学性质是否相同?不同,因为它们的结构不同。氯化钠晶体中不存在氯化钠分子,只存在Na+与Cl -,构成氯化钠晶体的粒子是离子而不是分子。 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg ·原子的电子式:离子的电子式:H+Na+Mg2+电子式 2、非金属阴离子的电子式要标 [ ] 及“ 电荷数 ”。离子化合物的电子式:3、离子化合物的电子式就是由阴、阳离子的电子式合并而成。在元素符号周围用用“ · ”表示最外层电子Na+如何用电子式表示离子化合物的形成过程? 例:用电子式表示氯化钾、溴化钙的形成过程 K ·+→K +·Ca·++→Ca2+
1.原子A的电子式 + 原子B的电子式→化合物的电子式 2.不能把“→”写成“=”。 3.在箭号右边,不能把相同离子合并在一起,应逐个写。注意+·Ca·
→
Ca2+2错误 写出下列粒子的电子式:
硫原子, 溴离子, 钾离子K+
氟化镁Mg2+⑴ 用电子式表示氧化镁的形成过程 · Mg ·+→Mg2+⑵ 用电子式表示硫化钾的形成过程 2+→K+K++
K·
+K+→ K+
原子A的电子式 + 原子B的电子式 → 化合物的电子式 K·
K·
一.离子键:使阴、阳离子结合成化合物的静电作用。[思考与讨论]1.通常情况下,哪些元素之间最易形成离子化合物? 2.离子键是一种什么性质的 相互作用?3.离子化合物溶于水或熔化时离子键是否发生变化?活泼金属与活泼非金属阴阳离子间的静电作用 (静电吸引=静电排斥)转化成自由移动的离子,离子键即被破坏。离子键:使阴、阳离子结合成化合物的静电作用.
(成键粒子、成键条件)
活泼金属原子M活泼非金属原子N失去电子得到电子阳离子Mm+阴离子Nn-静电作用 静电吸引=静电排斥离 子 键 影 响 因 素 ①离子半径 ②离子电荷
离子化合物用电子式表示例本节小结课堂练习练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
D练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C. 11与17 D.6与14C3、M是元素周期表中ⅡA族元素,Y是ⅦA族元素,M、Y的两种单质化合生成Z。下列有关Z的判断错误的是
A.Z一定是离子化合物
B.Z的熔点、沸点高
C.Z一定溶于水
D.形成Z的反应用电子式表达为:D4、某化合物XY2中,各离子的电子层结构相同,且电子总数为54,则XY2的化学式为________________,电子式为
______________CaCl2The end
