含硫化合物的性质和应用
图片预览






文档简介
课件19张PPT。专题4 第一单元 硫及其化合物一.S常见价态: -20+4+6强还原性强氧化性H2SO4分子形式既有氧化性又有还原性常见氧化剂:O2,H2O2,HNO3,HClO,Br2.Cl2,KMnO4(H+)……常见还原剂:金属单质,S2-,I- ……CO,H2(加热,表现还原性)NO3-+H+二.硫以及化合物1.H2S(g)
不稳定:H2S =H2+S
强还原性:
2H2S+3O2=2SO2↑+2H2O
2H2S+O2=2S+2H2O
H2S+Cl2=2HCl+SΔ点燃点燃2.H2S水溶液——氢硫酸
弱酸性
强还原性:
2H2S+O2=2S↓+2H2O
3.S
——淡黄色固体
弱氧化性: Fe+S=FeS
Hg+S=HgS(除有毒的Hg)
S的氧化性还原性:S+O2=SO2(氧气中明亮蓝紫色火焰)
自身氧化还原反应:
3S+6KOH=2K2S+K2SO3+3H2O(用于洗涤附在 试管内壁的硫)
Δ点燃Δ4.SO2:
物理性质:
无色,有刺激性气味的有毒气体.易液化,易溶于水,常温常压下1体积水大约能溶解40体积的SO2
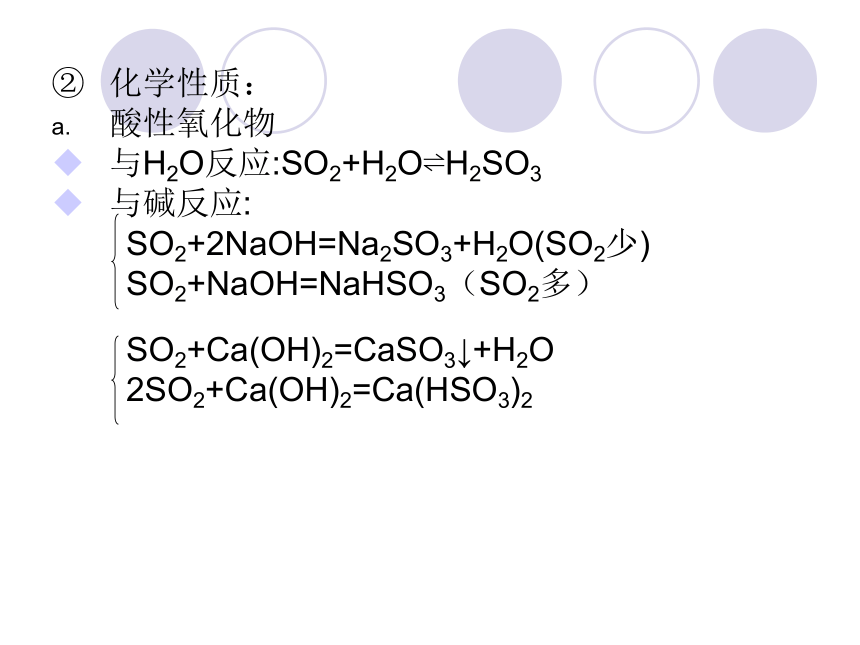
化学性质:
酸性氧化物
与H2O反应:SO2+H2O?H2SO3
与碱反应:
SO2+2NaOH=Na2SO3+H2O(SO2少)
SO2+NaOH=NaHSO3(SO2多)
SO2+Ca(OH)2=CaSO3↓+H2O
2SO2+Ca(OH)2=Ca(HSO3)2
较强的还原性:
SO2 +6
2SO2+O2 ? 2SO3
SO2+Br2+2H2O=H2SO4+2HBr
问:将SO2通入BaCl2溶液中为什么没有白色沉淀?若事先向BaCl2溶液中加入稀HNO3,再通入SO2为什么会有白色沉淀?O2,Cl2,Br2,I2,HNO3,KMnO4(H+),H2O2等被氧化催化剂
ΔCl2,I2比较:CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO
SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO ?
氧化性:
2H2S+SO2=3S↓+2H2O
SO2+2Mg=2MgO+S
S+Mg=MgS
ΔΔ×反应——CaSO4+HCl漂白性:使品红褪色
原理:SO2 无色物质
原来颜色 某些有色物质见光,遇热,长时间放置品红溶液,纸浆,毛丝,草帽辫等品红被氧化褪色永久性生成HClO将品红氧化褪色永久性化合生成不稳定无色物质易恢复原来颜色暂时疏松多孔吸附力强,物理变化永久性注:SO2能使酸碱指示剂变色,但不能使其褪色。SO2能使溴水,酸性高锰酸钾褪色,体现SO2的还原性而不是漂白性。SO2的制法和用途 实验室:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
工业:
4FeS2+11O2=2Fe2O3+8SO2
用途:杀灭霉菌和细菌,食物和干果的防腐剂,制 硫酸。焙烧空中死神:酸雨5.硫酸型酸雨含义:PH<5.6
危害:破坏生态系统
损坏建筑
危害人类健康
形成:2SO2+O2 ? 2SO3 →H2SO4
SO2+H2O ? H2SO3→H2SO4
防治:消除污染源,研究开发新能源;
对含硫燃料进行脱硫处理,以及对燃煤
烟气中的SO2进行回收;
增强“防酸”意思。催化剂H2OO2左侧图片摄于1908年右侧图片摄于1968年谁之过?
酸雨主要是燃烧硫燃料时释放SO2造成的。现取一份雨水样品,每隔一段时间测其pH,随着时间的推移其pH将 ( )
A.逐渐增大 B.逐渐减少至某数值
C.不变 D.无法判断是否变化
思考B作业:
随堂导学下课!谢谢!
不稳定:H2S =H2+S
强还原性:
2H2S+3O2=2SO2↑+2H2O
2H2S+O2=2S+2H2O
H2S+Cl2=2HCl+SΔ点燃点燃2.H2S水溶液——氢硫酸
弱酸性
强还原性:
2H2S+O2=2S↓+2H2O
3.S
——淡黄色固体
弱氧化性: Fe+S=FeS
Hg+S=HgS(除有毒的Hg)
S的氧化性
自身氧化还原反应:
3S+6KOH=2K2S+K2SO3+3H2O(用于洗涤附在 试管内壁的硫)
Δ点燃Δ4.SO2:
物理性质:
无色,有刺激性气味的有毒气体.易液化,易溶于水,常温常压下1体积水大约能溶解40体积的SO2
化学性质:
酸性氧化物
与H2O反应:SO2+H2O?H2SO3
与碱反应:
SO2+2NaOH=Na2SO3+H2O(SO2少)
SO2+NaOH=NaHSO3(SO2多)
SO2+Ca(OH)2=CaSO3↓+H2O
2SO2+Ca(OH)2=Ca(HSO3)2
较强的还原性:
SO2 +6
2SO2+O2 ? 2SO3
SO2+Br2+2H2O=H2SO4+2HBr
问:将SO2通入BaCl2溶液中为什么没有白色沉淀?若事先向BaCl2溶液中加入稀HNO3,再通入SO2为什么会有白色沉淀?O2,Cl2,Br2,I2,HNO3,KMnO4(H+),H2O2等被氧化催化剂
ΔCl2,I2比较:CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO
SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO ?
氧化性:
2H2S+SO2=3S↓+2H2O
SO2+2Mg=2MgO+S
S+Mg=MgS
ΔΔ×反应——CaSO4+HCl漂白性:使品红褪色
原理:SO2 无色物质
原来颜色 某些有色物质见光,遇热,长时间放置品红溶液,纸浆,毛丝,草帽辫等品红被氧化褪色永久性生成HClO将品红氧化褪色永久性化合生成不稳定无色物质易恢复原来颜色暂时疏松多孔吸附力强,物理变化永久性注:SO2能使酸碱指示剂变色,但不能使其褪色。SO2能使溴水,酸性高锰酸钾褪色,体现SO2的还原性而不是漂白性。SO2的制法和用途 实验室:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
工业:
4FeS2+11O2=2Fe2O3+8SO2
用途:杀灭霉菌和细菌,食物和干果的防腐剂,制 硫酸。焙烧空中死神:酸雨5.硫酸型酸雨含义:PH<5.6
危害:破坏生态系统
损坏建筑
危害人类健康
形成:2SO2+O2 ? 2SO3 →H2SO4
SO2+H2O ? H2SO3→H2SO4
防治:消除污染源,研究开发新能源;
对含硫燃料进行脱硫处理,以及对燃煤
烟气中的SO2进行回收;
增强“防酸”意思。催化剂H2OO2左侧图片摄于1908年右侧图片摄于1968年谁之过?
酸雨主要是燃烧硫燃料时释放SO2造成的。现取一份雨水样品,每隔一段时间测其pH,随着时间的推移其pH将 ( )
A.逐渐增大 B.逐渐减少至某数值
C.不变 D.无法判断是否变化
思考B作业:
随堂导学下课!谢谢!
