电化学复习 电解原理的应用
文档属性
| 名称 | 电化学复习 电解原理的应用 |  | |
| 格式 | rar | ||
| 文件大小 | 240.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-12-18 18:18:00 | ||
图片预览








文档简介
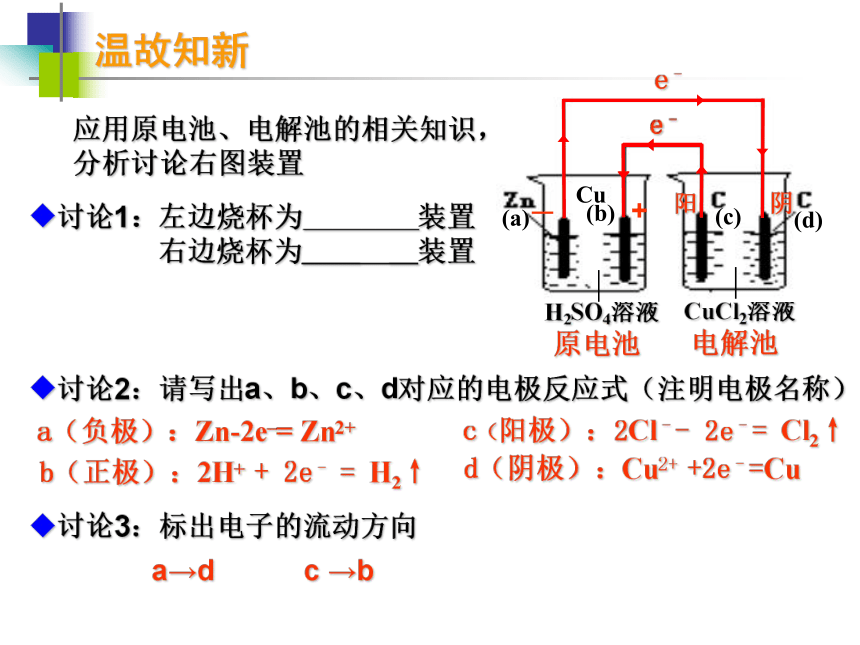
课件31张PPT。电解原理的应用 电化学复习 无锡市第一中学 尤艳丹温故知新应用原电池、电解池的相关知识,
分析讨论右图装置讨论1:左边烧杯为________装置
右边烧杯为____ __装置
讨论2:请写出a、b、c、d对应的电极反应式(注明电极名称)
讨论3:标出电子的流动方向原电池电解池—+阳阴a(负极):Zn-2e–= Zn2+b(正极):2H+ + 2e– = H2↑d(阴极):Cu2+ +2e–=Cuc(阳极):2Cl–- 2e–= Cl2↑c →ba→d探究与实践 结合原电池或电解池的工作原理,设计实验,
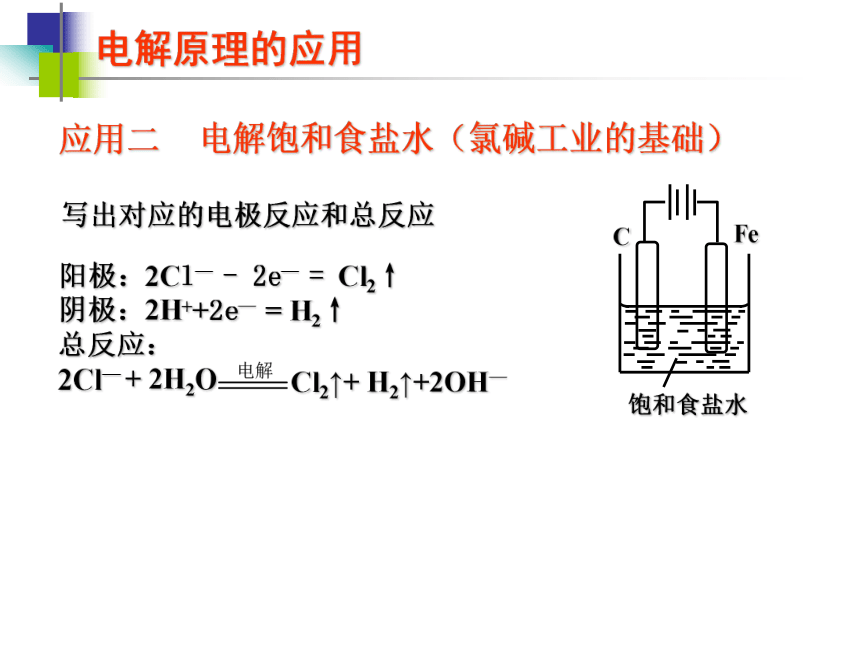
使图中的铁棒上析出铜,而铁的质量不变。(作图并说明原理) —+阳阴原电池原理电解原理电解原理的应用电解某些活泼金属的熔融盐,制取活泼金属单质
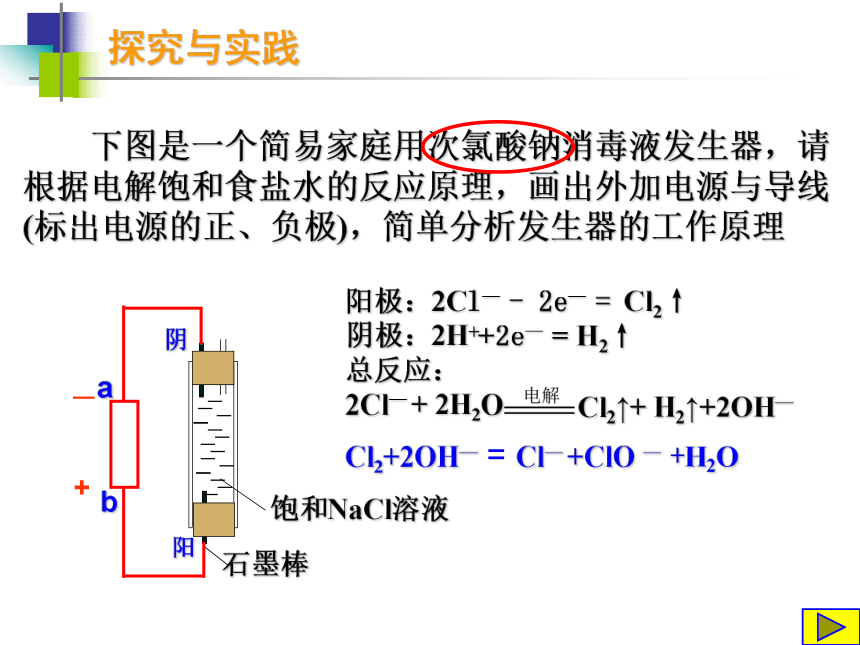
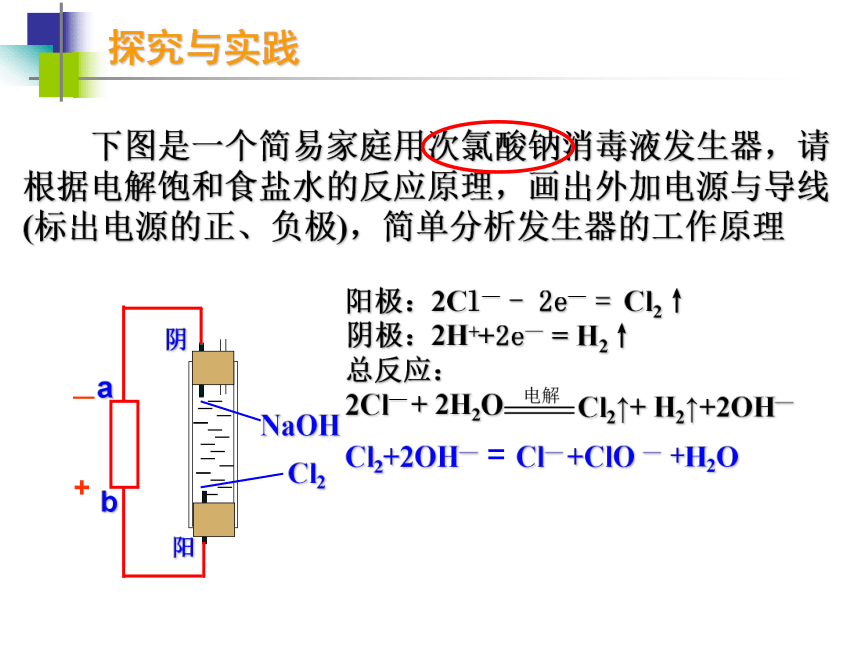
(如Na、Mg、Al等)Na:Mg:Al:电解原理的应用写出对应的电极反应和总反应阳离子交换膜电解槽探究与实践 下图是一个简易家庭用次氯酸钠消毒液发生器,请根据电解饱和食盐水的反应原理,画出外加电源与导线(标出电源的正、负极),简单分析发生器的工作原理 —+阳阴Cl2+2OH— = Cl— +ClO — +H2O探究与实践 下图是一个简易家庭用次氯酸钠消毒液发生器,请根据电解饱和食盐水的反应原理,画出外加电源与导线(标出电源的正、负极),简单分析发生器的工作原理 —+阳阴Cl2+2OH— = Cl— +ClO — +H2O电解原理的应用写出对应的电极反应和总反应?电解MgCl2溶液Mg2+Mg(OH)2↓拓展与延伸 电解法制备Fe(OH)2 Fe 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
(1)a极材料为 ,电极反应式为_____________Fe-2e=Fe2+石墨Fe已知两极材料分别为石墨和铁:拓展与延伸 电解法制备Fe(OH)2 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
已知两极材料分别为石墨和铁:(1)a极材料为 ,电极反应式为_____________Fe石墨(2)如果实验后看到有白色沉淀生成,则电解液c可以是______
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液Fe-2e=Fe2+Fe√√拓展与延伸 电解法制备Fe(OH)2 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
已知两极材料分别为石墨和铁:(1)a极材料为 ,电极反应式为_____________隔绝空气,防止生成的Fe(OH)2被空气中的氧气氧化排净溶液中溶解的氧气,防止生成的Fe(OH)2在溶液中被氧化Fe石墨(2)如果实验后看到有白色沉淀生成,则电解液c可以是______
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液(3)苯或汽油(3)液体d可为 ,其作用是 ,在加d之前对c
溶液进行加热煮沸处理,目的是 。Fe-2e=Fe2+Fe√√拓展与延伸 电解法制备Fe(OH)2 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
已知两极材料分别为石墨和铁:(4)若c改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接
电源继续电解,除了电极上看到的气泡外,另一明显的现象为:______ (1)a极材料为 ,电极反应式为_____________Fe石墨(3)液体d可为 ,其作用是 ,在加d之前对c
溶液进行加热煮沸处理,目的是 。(2)如果实验后看到有白色沉淀生成,则电解液c可以是______
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液Fe-2e=Fe2+Fe√√拓展与延伸 电解法制备Fe(OH)2 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
已知两极材料分别为石墨和铁:(4)若c改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接
电源继续电解,除了电极上看到的气泡外,另一明显的现象为:______ (4)白色沉淀迅速变为灰绿色,最后变为红褐色电解水思考1:如果阳极碳棒用Cu作电极,能达到实验目的吗?思考2:如果阳极和阴极都为铜棒,则实验现象如何呢?电解精炼铜电镀思考与讨论图中的铁棒上析出铜,而铁的质量不变电解精炼铜电镀
电解原理的应用电镀
电解原理的应用电解精炼铜电镀
电解原理的应用电解精炼铜铜的电解精炼纯铜粗铜小结电解原理的应用应用一:电解冶炼某些活泼金属(如Na、Mg、Al等)应用二:电解饱和食盐水(氯碱工业的基础)应用三:电镀、电解精炼铜巩固和提高 结合元素化合物及电化学原理等知识,利用废铜制备CuSO4实验室用铜和硫酸制取CuSO4有几种方法: 随着反应进行,浓硫酸浓度逐渐变小,而稀硫酸
不能再与铜发生反应巩固和提高 结合元素化合物及电化学原理等知识,利用废铜制备CuSO4实验室用铜和硫酸制取CuSO4有几种方法:(2)乙同学认为甲设计的实验方案不好,他自己设计的思路是
2Cu+O2 2CuO, CuO+H2SO4 = CuSO4+H2O。
对比甲的方案,乙同学方案的优点是 。 获取等量的CuSO4,乙消耗的硫酸的用量更少,
且不产生污染物SO2。△巩固和提高 2CuO,
CuO+H2SO4结合元素化合物及电化学原理等知识,利用废铜制备CuSO4实验室用铜和硫酸制取CuSO4有几种方法:△
(3)某地有丰富的电力资源。为了具备乙同学方案的优点,你能不能根据
该地的资源优势设计一个Cu和硫酸制取硫酸铜的方案?
(其他材料任选)用废铜作阳极,碳棒作阴极,
稀硫酸作电解质溶液进行电解(2)乙同学认为甲设计的实验方案不好,他自己设计的思路是
2Cu+O2 2CuO, CuO+H2SO4 = CuSO4+H2O。
对比甲的方案,乙同学方案的优点是 。 拓展与延伸(1)增加废水的导电性电化学方法处理污水 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;拓展与延伸电化学方法处理污水(2) Fe-2e- = Fe2+ (2)电极反应式:阳极 ,阴极 ;2H++2e- = H2↑ 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;拓展与延伸电化学方法处理污水 (3)6Fe2++Cr2O72— + 14H+ = 6Fe3+ + 2Cr3+ +7H2O (3)由Cr2O72— 转化为Cr3+ 的离子方程式为_______________(2)电极反应式:阳极 ,阴极 ; 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;拓展与延伸电化学方法处理污水(4)在阴极反应及Cr2O72—与Fe2+反应过程中,H+被大量
消耗,促使水的电离平衡向电离方向移动,OH-大量增加,
促使Fe3+、Cr3+最终转化为Cr(OH)3和Fe(OH)3沉淀 (4)电解过程Cr(OH)3和Fe(OH)3沉淀是怎样产生的?(3)由Cr2O72— 变Cr3+ 的离子方程式为_______________(2)电极反应式:阳极 ,阴极 ; 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;(4)在阴极反应及Cr2O72—与Fe2+反应过程中,H+被大量
消耗,促使水的电离平衡向电离方向移动,OH-大量增加,
促使Fe3+、Cr3+最终转化为Cr(OH)3和Fe(OH)3沉淀拓展与延伸电化学方法处理污水(5)不能改用石墨电极,因用石墨作电极,阳极产生Cl2,
得不到Fe2+ ,结果因缺少还原剂,不能使Cr2O72- 转化
成 Cr3+ ,最终生成Cr(OH)3 而除去(5)能否改用石墨作电极?原因是什么? 。 (4)电解过程Cr(OH)3和Fe(OH)3沉淀是怎样产生的?(3)由Cr2O72— 变Cr3+ 的离子方程式为_______________(2)电极反应式:阳极 ,阴极 ; 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;结合原电池及电解原理,思考分析金属的腐蚀与防护 课后思考?谢谢!
分析讨论右图装置讨论1:左边烧杯为________装置
右边烧杯为____ __装置
讨论2:请写出a、b、c、d对应的电极反应式(注明电极名称)
讨论3:标出电子的流动方向原电池电解池—+阳阴a(负极):Zn-2e–= Zn2+b(正极):2H+ + 2e– = H2↑d(阴极):Cu2+ +2e–=Cuc(阳极):2Cl–- 2e–= Cl2↑c →ba→d探究与实践 结合原电池或电解池的工作原理,设计实验,
使图中的铁棒上析出铜,而铁的质量不变。(作图并说明原理) —+阳阴原电池原理电解原理电解原理的应用电解某些活泼金属的熔融盐,制取活泼金属单质
(如Na、Mg、Al等)Na:Mg:Al:电解原理的应用写出对应的电极反应和总反应阳离子交换膜电解槽探究与实践 下图是一个简易家庭用次氯酸钠消毒液发生器,请根据电解饱和食盐水的反应原理,画出外加电源与导线(标出电源的正、负极),简单分析发生器的工作原理 —+阳阴Cl2+2OH— = Cl— +ClO — +H2O探究与实践 下图是一个简易家庭用次氯酸钠消毒液发生器,请根据电解饱和食盐水的反应原理,画出外加电源与导线(标出电源的正、负极),简单分析发生器的工作原理 —+阳阴Cl2+2OH— = Cl— +ClO — +H2O电解原理的应用写出对应的电极反应和总反应?电解MgCl2溶液Mg2+Mg(OH)2↓拓展与延伸 电解法制备Fe(OH)2 Fe 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
(1)a极材料为 ,电极反应式为_____________Fe-2e=Fe2+石墨Fe已知两极材料分别为石墨和铁:拓展与延伸 电解法制备Fe(OH)2 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
已知两极材料分别为石墨和铁:(1)a极材料为 ,电极反应式为_____________Fe石墨(2)如果实验后看到有白色沉淀生成,则电解液c可以是______
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液Fe-2e=Fe2+Fe√√拓展与延伸 电解法制备Fe(OH)2 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
已知两极材料分别为石墨和铁:(1)a极材料为 ,电极反应式为_____________隔绝空气,防止生成的Fe(OH)2被空气中的氧气氧化排净溶液中溶解的氧气,防止生成的Fe(OH)2在溶液中被氧化Fe石墨(2)如果实验后看到有白色沉淀生成,则电解液c可以是______
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液(3)苯或汽油(3)液体d可为 ,其作用是 ,在加d之前对c
溶液进行加热煮沸处理,目的是 。Fe-2e=Fe2+Fe√√拓展与延伸 电解法制备Fe(OH)2 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
已知两极材料分别为石墨和铁:(4)若c改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接
电源继续电解,除了电极上看到的气泡外,另一明显的现象为:______ (1)a极材料为 ,电极反应式为_____________Fe石墨(3)液体d可为 ,其作用是 ,在加d之前对c
溶液进行加热煮沸处理,目的是 。(2)如果实验后看到有白色沉淀生成,则电解液c可以是______
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液Fe-2e=Fe2+Fe√√拓展与延伸 电解法制备Fe(OH)2 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2,并可较长时间观察到白色沉淀。
已知两极材料分别为石墨和铁:(4)若c改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接
电源继续电解,除了电极上看到的气泡外,另一明显的现象为:______ (4)白色沉淀迅速变为灰绿色,最后变为红褐色电解水思考1:如果阳极碳棒用Cu作电极,能达到实验目的吗?思考2:如果阳极和阴极都为铜棒,则实验现象如何呢?电解精炼铜电镀思考与讨论图中的铁棒上析出铜,而铁的质量不变电解精炼铜电镀
电解原理的应用电镀
电解原理的应用电解精炼铜电镀
电解原理的应用电解精炼铜铜的电解精炼纯铜粗铜小结电解原理的应用应用一:电解冶炼某些活泼金属(如Na、Mg、Al等)应用二:电解饱和食盐水(氯碱工业的基础)应用三:电镀、电解精炼铜巩固和提高 结合元素化合物及电化学原理等知识,利用废铜制备CuSO4实验室用铜和硫酸制取CuSO4有几种方法: 随着反应进行,浓硫酸浓度逐渐变小,而稀硫酸
不能再与铜发生反应巩固和提高 结合元素化合物及电化学原理等知识,利用废铜制备CuSO4实验室用铜和硫酸制取CuSO4有几种方法:(2)乙同学认为甲设计的实验方案不好,他自己设计的思路是
2Cu+O2 2CuO, CuO+H2SO4 = CuSO4+H2O。
对比甲的方案,乙同学方案的优点是 。 获取等量的CuSO4,乙消耗的硫酸的用量更少,
且不产生污染物SO2。△巩固和提高 2CuO,
CuO+H2SO4结合元素化合物及电化学原理等知识,利用废铜制备CuSO4实验室用铜和硫酸制取CuSO4有几种方法:△
(3)某地有丰富的电力资源。为了具备乙同学方案的优点,你能不能根据
该地的资源优势设计一个Cu和硫酸制取硫酸铜的方案?
(其他材料任选)用废铜作阳极,碳棒作阴极,
稀硫酸作电解质溶液进行电解(2)乙同学认为甲设计的实验方案不好,他自己设计的思路是
2Cu+O2 2CuO, CuO+H2SO4 = CuSO4+H2O。
对比甲的方案,乙同学方案的优点是 。 拓展与延伸(1)增加废水的导电性电化学方法处理污水 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;拓展与延伸电化学方法处理污水(2) Fe-2e- = Fe2+ (2)电极反应式:阳极 ,阴极 ;2H++2e- = H2↑ 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;拓展与延伸电化学方法处理污水 (3)6Fe2++Cr2O72— + 14H+ = 6Fe3+ + 2Cr3+ +7H2O (3)由Cr2O72— 转化为Cr3+ 的离子方程式为_______________(2)电极反应式:阳极 ,阴极 ; 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;拓展与延伸电化学方法处理污水(4)在阴极反应及Cr2O72—与Fe2+反应过程中,H+被大量
消耗,促使水的电离平衡向电离方向移动,OH-大量增加,
促使Fe3+、Cr3+最终转化为Cr(OH)3和Fe(OH)3沉淀 (4)电解过程Cr(OH)3和Fe(OH)3沉淀是怎样产生的?(3)由Cr2O72— 变Cr3+ 的离子方程式为_______________(2)电极反应式:阳极 ,阴极 ; 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;(4)在阴极反应及Cr2O72—与Fe2+反应过程中,H+被大量
消耗,促使水的电离平衡向电离方向移动,OH-大量增加,
促使Fe3+、Cr3+最终转化为Cr(OH)3和Fe(OH)3沉淀拓展与延伸电化学方法处理污水(5)不能改用石墨电极,因用石墨作电极,阳极产生Cl2,
得不到Fe2+ ,结果因缺少还原剂,不能使Cr2O72- 转化
成 Cr3+ ,最终生成Cr(OH)3 而除去(5)能否改用石墨作电极?原因是什么? 。 (4)电解过程Cr(OH)3和Fe(OH)3沉淀是怎样产生的?(3)由Cr2O72— 变Cr3+ 的离子方程式为_______________(2)电极反应式:阳极 ,阴极 ; 铬是一种用途广泛的化工原料,但六价铬具有强烈的
致癌作用,且又是一种严重的污染物。工业上为了处理含
Cr2O72—酸性工业废水,按下面的方法处理:①往工业废水
中加入适量NaCl ②以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于
排放标准。试回答:(1)加入适量NaCl是为了 ;结合原电池及电解原理,思考分析金属的腐蚀与防护 课后思考?谢谢!
