江苏省南菁高级中学2008-2009学年第一学期第三次月考化学试卷
文档属性
| 名称 | 江苏省南菁高级中学2008-2009学年第一学期第三次月考化学试卷 |  | |
| 格式 | rar | ||
| 文件大小 | 39.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-12-21 09:51:00 | ||
图片预览



文档简介
江苏省南菁高级中学
2008-2009学年第一学期第三次月考化学试卷
一、选择题(每小题只有1个选项符合题意,每题3分,共30分)
1.科学家提出硅是“21世纪的能源”、“未来的石油”的观点、假如硅作为一种普遍使用的
新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是
A 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B 硅的来源丰富,易于开采,且可再生
C 硅燃烧放出的热量大,且燃烧产物对环境污染程度低,且易有效控制
D 寻找高效催化剂,使硅的生产耗能很低,是硅能源开发对用的关键技术
2.玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的
物质是 A 烧碱 B 纯碱 C 氢氟酸 D 盐酸
3.2MgO·SiO2中的酸根阴离子为
A SiO32- B Si2O64- C SiO44- D Si2O32-
4.MgCl2·6H2O在高温灼烧时,其分解产物为
A MgCl2和H2O B Mg(OH)2、HCl和H2O C Mg、Cl2和H2O D MgO、HCl和H2O
5.在FeCl3溶液中,依次加入过量的NaI溶液和足量的Na2S,最后的沉淀是
A FeS、I2 B Fe2S3、I2 C FeS、 S D FeS、 S、 I2
6.向200mL0.10mol/L的Fe(NO3)2溶液中加入适量NaOH溶液,使Fe2+完全转化成沉淀,
过滤、洗涤,将所得的沉淀灼烧至质量不再变化,其质量为
A 1.44g B 1.60g C 4.36g D 4.84g
7.含杂质SiO2的硫铁矿样品1g,用充足的O2燃烧后称重为0.8g,则硫铁矿中含硫量为
A 10% B 22% C 32% D 40%
8.将Fe(NO3)2溶液分别滴入到以下溶液中:①H2O2 ②HNO3 ③溴水 ④碘水,
其中能使Fe2+转变成Fe3+的是
A 只有②③ B ①②③ C ②③④ D 全部
9.向100mL FeBr2溶液中通入标准状况下的Cl2 3.36L,测得溶液中c(Br-)=c(Cl-),
则原FeBr2溶液的物质的量浓度是
A 0.75mol/L B 1.5mol/L C 2mol/L D 3mol/L
10.有一种铁的“氧化物”样品,用5mol/L盐酸140mL恰好完全溶解,所得溶液还能吸收
标况下0.56L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是
A Fe2O3 B Fe3O4 C Fe4O5 D Fe5O7
二、选择题(每小题有1-2个选项符合题意,每题3分,共30分)
11.为了除去CuCl2酸性溶液中的Fe3+,可在加热、搅拌下加入一种试剂,过滤后,再加入适量的盐酸,这种试剂是
A NH3·H2O B CuO C Na2CO3 D CuCO3
12.下列物质中不具有漂白性的是
A SO2 B Na2O2 C Na2O D 新制氯水
13.下列物质与铁反应后,产物中存在三价铁的是
A 硫磺 B 水蒸气 C 稀硫酸 D 硫酸铜溶液
14.制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并密封冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。其中必须进行的操作及其正确顺序是
A ③②⑤⑥④ B ③②④①⑦ C ③②④⑤⑦ D ②④①⑦⑤
15.将铜片放入盛有稀硫酸烧杯中,没有明显的现象,当加入(或通入)下列物质后
(可以加热),铜片溶解,溶液变蓝且不会产生有毒气体的是
A CuO B O2 C NaNO3 D HCl
16.对下列事实的解释不正确的是
A 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B 浓硫酸和氯化钠固体混合可制氯化氢,说明浓硫酸是一种难挥发的酸
C 常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸不能发生反应
D 反应CuSO4+H2S=CuS↓十H2SO4能进行,说明硫化铜不溶于稀硫酸
17.甲乙两烧杯中各盛有100mL 3moL/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的
铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A 5.4g?? B 3.6g??? C 2.7g??? D 1.8g
18.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是
A 饱和碳酸钠溶液 B 高锰酸钾溶液 C 石灰水 D 饱和碳酸氢钠溶液
19.下列说法中正确的是
A 把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用
B 氢硫酸是弱酸,不能与强酸盐生成强酸
C 稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应
D 硫化亚铁不能存在于盐酸中,而硫化铜能存在于盐酸中
20.下列物质中不能用化合反应制得的物质是
①FeS ②FeCl2 ③Fe(OH)3 ④FeSO4 ⑤FeCl3 ⑥Fe(OH)2
A、②⑥ B、④⑥ C、③⑥ D、⑥
二、填空题(共42分)
21.(8分)将铁粉溶于足量稀硫酸后,所得溶液分装在A、B、C三试管中:
(1)在A试管中滴加双氧水,然后滴入KSCN溶液,溶液呈红色,反应的
离子方程式 、 。
(2)在B试管中滴入KMnO4溶液,溶液紫色褪去,反应的离子方程式是:
__________________________________________。
(3)在C试管中滴入KSCN溶液,然后在空气中放置片刻后,溶液又显红色,反应的
离子方程式是 。
22.(6分)供选择的答案:①酸性 ②具有高沸点、难挥发性 浓硫酸具有吸水性 ④浓硫酸具有脱水性 ⑤浓硫酸具有强氧化性。
在下列变化中,硫酸体现的性质为:
(1)铜跟浓硫酸共热,产生二氧化硫气体 ;
(2)亚硫酸钠中加入硫酸,产生二氧化硫气体 ;
(3)氯化钠固体跟浓硫酸的混和物共热时产生氯化氢气体 ;
(4)浓硫酸能用来干燥H2、O2、Cl2等,但不能用来干燥NH3、HBr、HI等 ;
(5)纸张、布片、蔗糖等遇浓硫酸会慢慢变黑 ;
(6)浓硫酸跟灼热的炭反应时产生混和气体 。
23.(4分)将18.7g复盐Fe2(SO4)3·x(NH4)2SO4·yH2O加到过量的NaOH溶液中加热,生成的氨用100mL、0.5mol/L硫酸吸收,多余的硫酸用2mol/L的NaOH溶液滴定,用去NaOH溶液25mL。再将等质量的复盐溶水配成溶液,加足量BaCl2溶液,充分反应后,过滤、洗涤、干燥,最后得白色沉淀23.3g。
则x的值为 ;y的值为 ;
24.(6分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。另一份加入含0.001mol KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。请回答:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试确定该结晶水合物的化学式 。
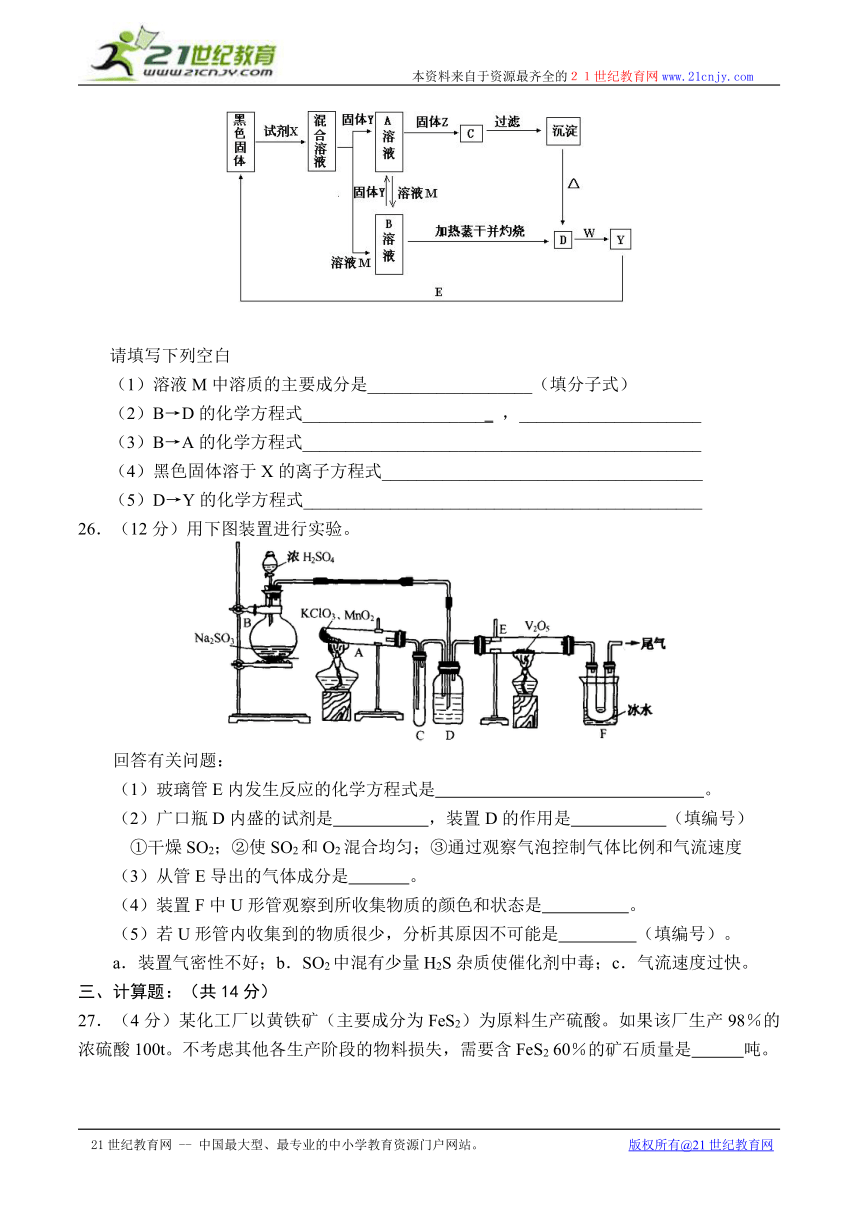
25.(10分)下图是中学化学常见的某些无机物相互转化的关系,图中Z是淡黄色固体,W是一种金属单质,D是红棕色固体。试剂X、A溶液、B溶液都是单一物质的溶液,向它们的溶液中加入用硝酸酸化的硝酸银溶液,均产生白色沉淀。
请填写下列空白
(1)溶液M中溶质的主要成分是___________________(填分子式)
(2)B→D的化学方程式______________________ ,_____________________
(3)B→A的化学方程式______________________________________________
(4)黑色固体溶于X的离子方程式_____________________________________
(5)D→Y的化学方程式______________________________________________
26.(12分)用下图装置进行实验。
回答有关问题:
(1)玻璃管E内发生反应的化学方程式是 。
(2)广口瓶D内盛的试剂是 ,装置D的作用是 (填编号)
①干燥SO2;②使SO2和O2混合均匀;③通过观察气泡控制气体比例和气流速度
(3)从管E导出的气体成分是 。
(4)装置F中U形管观察到所收集物质的颜色和状态是 。
(5)若U形管内收集到的物质很少,分析其原因不可能是 (填编号)。
a.装置气密性不好;b.SO2中混有少量H2S杂质使催化剂中毒;c.气流速度过快。
三、计算题:(共14分)
27.(4分)某化工厂以黄铁矿(主要成分为FeS2)为原料生产硫酸。如果该厂生产98%的浓硫酸100t。不考虑其他各生产阶段的物料损失,需要含FeS2 60%的矿石质量是 吨。
28.(10分)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+3C2AlN+3CO由于反应不完全,氮化铝中往往含有炭和氧化铝杂质。
为测定该产品中有关成分的含量,进行了以下两个实验:
称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭 g。
化学试卷答卷
一、选择题(共60分)(请填涂在答题卡上)
二、填空题(共42分)
21.(8分)
(1) 、
。
(2) __________________________________________________________。
(3)
。
22.(6分)
(1) ;(2) ;(3) ;
(4) ;(5) ;(6) 。
23.(4分)
x的值为 ;y的值为 ;
24.(6分)
(1)两种阳离子是 和 ,阴离子是 。
(2)化学式 。
25.(10分)
(1) ___________________(填分子式)
(2)B→D ______________________________________________________
_______________________________________________________
(3)B→A __________________________________________________
(4) ____________________________________________________
(5)D→Y ___________________________________________________
26.(12分)
(1) _______________ 。
(2) ________ , __________ (填编号)
(3) ____________________ 。
(4) _______________ 。
(5) ____________________ (填编号)。
三、计算题:(共14分)
27.(4分) 矿石质量是 吨。
28.(10分)(1)① ;
② ___ 。
(2) g。
化学试卷答案
一、选择题(20*3=60分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
C
C
D
C
B
C
B
C
D
题号
11
12
13
14
15
16
17
18
19
20
答案
BD
C
B
B
B
C
A
BD
D
D
二、填空题(共42分)
21、(8分)(1)2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-= Fe(SCN)3
(2)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O (3)4Fe2++O2+4H+=4Fe3++2H2O
22、(6 分)(1)①⑤ (2)② (3)①② (4)①③⑤ (5)④ (6)⑤
23、(4分) 1 , 12
24、(6分)(1)NH4+、Fe2+,SO42- (2) (NH4)2Fe(SO4)2?6H2O
25、(10分)(1)Cl2 (2)FeCl3 +3H2OFe(OH)3+3HCl 2Fe(OH)3Fe2O3+3H2O (3)2FeCl3 +Fe=3FeCl2 (4)Fe3O4 +8H+=2Fe3++Fe2++4H2O (5)2Al+Fe2O3Al2O3+2Fe
26、(10分)(1)2SO2+O2 2SO3 (2)浓硫酸;① ② ③ (3)SO3、SO2、O2 (4)无色固体(或白色固体) (5)b
三、计算题(14分)
27、(4分) 100t
28、(10分)(1)AlN+NaOH+H2O→NaAlO2+NH3↑ (2)61.5%
(3)1.92
2008-2009学年第一学期第三次月考化学试卷
一、选择题(每小题只有1个选项符合题意,每题3分,共30分)
1.科学家提出硅是“21世纪的能源”、“未来的石油”的观点、假如硅作为一种普遍使用的
新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是
A 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B 硅的来源丰富,易于开采,且可再生
C 硅燃烧放出的热量大,且燃烧产物对环境污染程度低,且易有效控制
D 寻找高效催化剂,使硅的生产耗能很低,是硅能源开发对用的关键技术
2.玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的
物质是 A 烧碱 B 纯碱 C 氢氟酸 D 盐酸
3.2MgO·SiO2中的酸根阴离子为
A SiO32- B Si2O64- C SiO44- D Si2O32-
4.MgCl2·6H2O在高温灼烧时,其分解产物为
A MgCl2和H2O B Mg(OH)2、HCl和H2O C Mg、Cl2和H2O D MgO、HCl和H2O
5.在FeCl3溶液中,依次加入过量的NaI溶液和足量的Na2S,最后的沉淀是
A FeS、I2 B Fe2S3、I2 C FeS、 S D FeS、 S、 I2
6.向200mL0.10mol/L的Fe(NO3)2溶液中加入适量NaOH溶液,使Fe2+完全转化成沉淀,
过滤、洗涤,将所得的沉淀灼烧至质量不再变化,其质量为
A 1.44g B 1.60g C 4.36g D 4.84g
7.含杂质SiO2的硫铁矿样品1g,用充足的O2燃烧后称重为0.8g,则硫铁矿中含硫量为
A 10% B 22% C 32% D 40%
8.将Fe(NO3)2溶液分别滴入到以下溶液中:①H2O2 ②HNO3 ③溴水 ④碘水,
其中能使Fe2+转变成Fe3+的是
A 只有②③ B ①②③ C ②③④ D 全部
9.向100mL FeBr2溶液中通入标准状况下的Cl2 3.36L,测得溶液中c(Br-)=c(Cl-),
则原FeBr2溶液的物质的量浓度是
A 0.75mol/L B 1.5mol/L C 2mol/L D 3mol/L
10.有一种铁的“氧化物”样品,用5mol/L盐酸140mL恰好完全溶解,所得溶液还能吸收
标况下0.56L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是
A Fe2O3 B Fe3O4 C Fe4O5 D Fe5O7
二、选择题(每小题有1-2个选项符合题意,每题3分,共30分)
11.为了除去CuCl2酸性溶液中的Fe3+,可在加热、搅拌下加入一种试剂,过滤后,再加入适量的盐酸,这种试剂是
A NH3·H2O B CuO C Na2CO3 D CuCO3
12.下列物质中不具有漂白性的是
A SO2 B Na2O2 C Na2O D 新制氯水
13.下列物质与铁反应后,产物中存在三价铁的是
A 硫磺 B 水蒸气 C 稀硫酸 D 硫酸铜溶液
14.制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并密封冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。其中必须进行的操作及其正确顺序是
A ③②⑤⑥④ B ③②④①⑦ C ③②④⑤⑦ D ②④①⑦⑤
15.将铜片放入盛有稀硫酸烧杯中,没有明显的现象,当加入(或通入)下列物质后
(可以加热),铜片溶解,溶液变蓝且不会产生有毒气体的是
A CuO B O2 C NaNO3 D HCl
16.对下列事实的解释不正确的是
A 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B 浓硫酸和氯化钠固体混合可制氯化氢,说明浓硫酸是一种难挥发的酸
C 常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸不能发生反应
D 反应CuSO4+H2S=CuS↓十H2SO4能进行,说明硫化铜不溶于稀硫酸
17.甲乙两烧杯中各盛有100mL 3moL/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的
铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A 5.4g?? B 3.6g??? C 2.7g??? D 1.8g
18.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是
A 饱和碳酸钠溶液 B 高锰酸钾溶液 C 石灰水 D 饱和碳酸氢钠溶液
19.下列说法中正确的是
A 把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用
B 氢硫酸是弱酸,不能与强酸盐生成强酸
C 稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应
D 硫化亚铁不能存在于盐酸中,而硫化铜能存在于盐酸中
20.下列物质中不能用化合反应制得的物质是
①FeS ②FeCl2 ③Fe(OH)3 ④FeSO4 ⑤FeCl3 ⑥Fe(OH)2
A、②⑥ B、④⑥ C、③⑥ D、⑥
二、填空题(共42分)
21.(8分)将铁粉溶于足量稀硫酸后,所得溶液分装在A、B、C三试管中:
(1)在A试管中滴加双氧水,然后滴入KSCN溶液,溶液呈红色,反应的
离子方程式 、 。
(2)在B试管中滴入KMnO4溶液,溶液紫色褪去,反应的离子方程式是:
__________________________________________。
(3)在C试管中滴入KSCN溶液,然后在空气中放置片刻后,溶液又显红色,反应的
离子方程式是 。
22.(6分)供选择的答案:①酸性 ②具有高沸点、难挥发性 浓硫酸具有吸水性 ④浓硫酸具有脱水性 ⑤浓硫酸具有强氧化性。
在下列变化中,硫酸体现的性质为:
(1)铜跟浓硫酸共热,产生二氧化硫气体 ;
(2)亚硫酸钠中加入硫酸,产生二氧化硫气体 ;
(3)氯化钠固体跟浓硫酸的混和物共热时产生氯化氢气体 ;
(4)浓硫酸能用来干燥H2、O2、Cl2等,但不能用来干燥NH3、HBr、HI等 ;
(5)纸张、布片、蔗糖等遇浓硫酸会慢慢变黑 ;
(6)浓硫酸跟灼热的炭反应时产生混和气体 。
23.(4分)将18.7g复盐Fe2(SO4)3·x(NH4)2SO4·yH2O加到过量的NaOH溶液中加热,生成的氨用100mL、0.5mol/L硫酸吸收,多余的硫酸用2mol/L的NaOH溶液滴定,用去NaOH溶液25mL。再将等质量的复盐溶水配成溶液,加足量BaCl2溶液,充分反应后,过滤、洗涤、干燥,最后得白色沉淀23.3g。
则x的值为 ;y的值为 ;
24.(6分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。另一份加入含0.001mol KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。请回答:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试确定该结晶水合物的化学式 。
25.(10分)下图是中学化学常见的某些无机物相互转化的关系,图中Z是淡黄色固体,W是一种金属单质,D是红棕色固体。试剂X、A溶液、B溶液都是单一物质的溶液,向它们的溶液中加入用硝酸酸化的硝酸银溶液,均产生白色沉淀。
请填写下列空白
(1)溶液M中溶质的主要成分是___________________(填分子式)
(2)B→D的化学方程式______________________ ,_____________________
(3)B→A的化学方程式______________________________________________
(4)黑色固体溶于X的离子方程式_____________________________________
(5)D→Y的化学方程式______________________________________________
26.(12分)用下图装置进行实验。
回答有关问题:
(1)玻璃管E内发生反应的化学方程式是 。
(2)广口瓶D内盛的试剂是 ,装置D的作用是 (填编号)
①干燥SO2;②使SO2和O2混合均匀;③通过观察气泡控制气体比例和气流速度
(3)从管E导出的气体成分是 。
(4)装置F中U形管观察到所收集物质的颜色和状态是 。
(5)若U形管内收集到的物质很少,分析其原因不可能是 (填编号)。
a.装置气密性不好;b.SO2中混有少量H2S杂质使催化剂中毒;c.气流速度过快。
三、计算题:(共14分)
27.(4分)某化工厂以黄铁矿(主要成分为FeS2)为原料生产硫酸。如果该厂生产98%的浓硫酸100t。不考虑其他各生产阶段的物料损失,需要含FeS2 60%的矿石质量是 吨。
28.(10分)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+3C2AlN+3CO由于反应不完全,氮化铝中往往含有炭和氧化铝杂质。
为测定该产品中有关成分的含量,进行了以下两个实验:
称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭 g。
化学试卷答卷
一、选择题(共60分)(请填涂在答题卡上)
二、填空题(共42分)
21.(8分)
(1) 、
。
(2) __________________________________________________________。
(3)
。
22.(6分)
(1) ;(2) ;(3) ;
(4) ;(5) ;(6) 。
23.(4分)
x的值为 ;y的值为 ;
24.(6分)
(1)两种阳离子是 和 ,阴离子是 。
(2)化学式 。
25.(10分)
(1) ___________________(填分子式)
(2)B→D ______________________________________________________
_______________________________________________________
(3)B→A __________________________________________________
(4) ____________________________________________________
(5)D→Y ___________________________________________________
26.(12分)
(1) _______________ 。
(2) ________ , __________ (填编号)
(3) ____________________ 。
(4) _______________ 。
(5) ____________________ (填编号)。
三、计算题:(共14分)
27.(4分) 矿石质量是 吨。
28.(10分)(1)① ;
② ___ 。
(2) g。
化学试卷答案
一、选择题(20*3=60分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
C
C
D
C
B
C
B
C
D
题号
11
12
13
14
15
16
17
18
19
20
答案
BD
C
B
B
B
C
A
BD
D
D
二、填空题(共42分)
21、(8分)(1)2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-= Fe(SCN)3
(2)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O (3)4Fe2++O2+4H+=4Fe3++2H2O
22、(6 分)(1)①⑤ (2)② (3)①② (4)①③⑤ (5)④ (6)⑤
23、(4分) 1 , 12
24、(6分)(1)NH4+、Fe2+,SO42- (2) (NH4)2Fe(SO4)2?6H2O
25、(10分)(1)Cl2 (2)FeCl3 +3H2OFe(OH)3+3HCl 2Fe(OH)3Fe2O3+3H2O (3)2FeCl3 +Fe=3FeCl2 (4)Fe3O4 +8H+=2Fe3++Fe2++4H2O (5)2Al+Fe2O3Al2O3+2Fe
26、(10分)(1)2SO2+O2 2SO3 (2)浓硫酸;① ② ③ (3)SO3、SO2、O2 (4)无色固体(或白色固体) (5)b
三、计算题(14分)
27、(4分) 100t
28、(10分)(1)AlN+NaOH+H2O→NaAlO2+NH3↑ (2)61.5%
(3)1.92
