近几年化学高考的启迪与思考
图片预览





文档简介
课件89张PPT。
Tel:0514-7975398, 13665248211
wuxin@yzu.edu.cn吴星化学是真实的近几年化学高考的启迪与思考公民教育与大学预科教育的关系
课程改革与高校招生改革
化学高考与化学教学
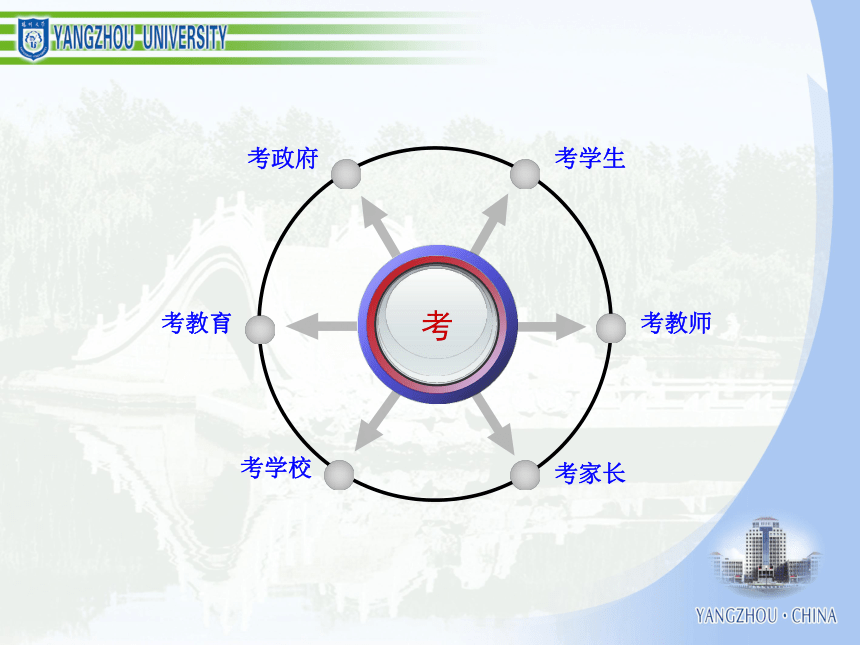
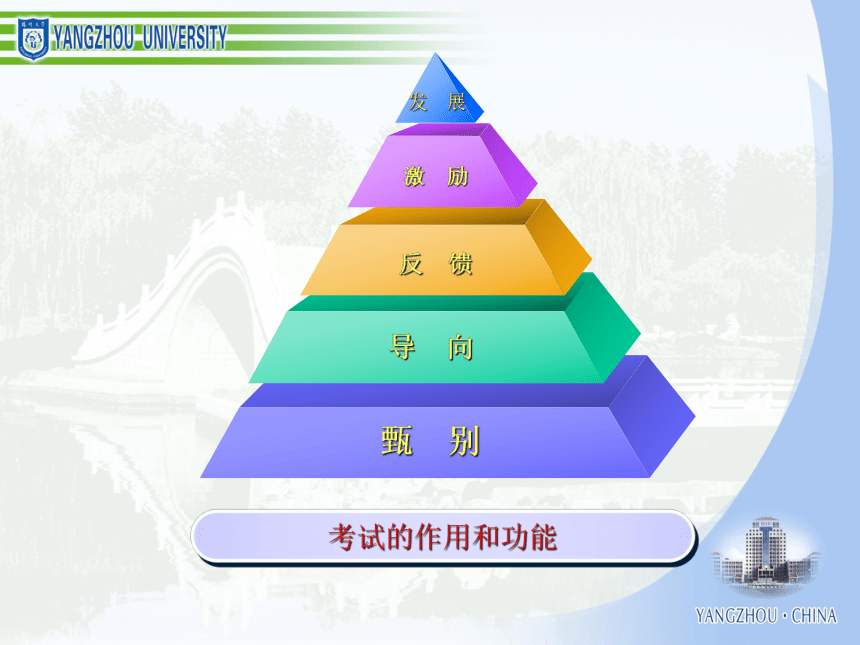
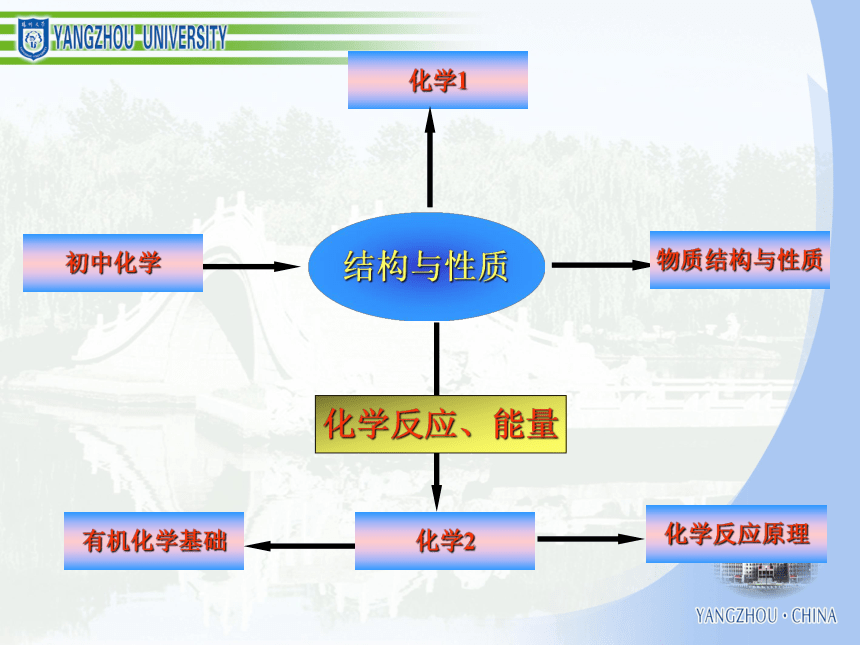
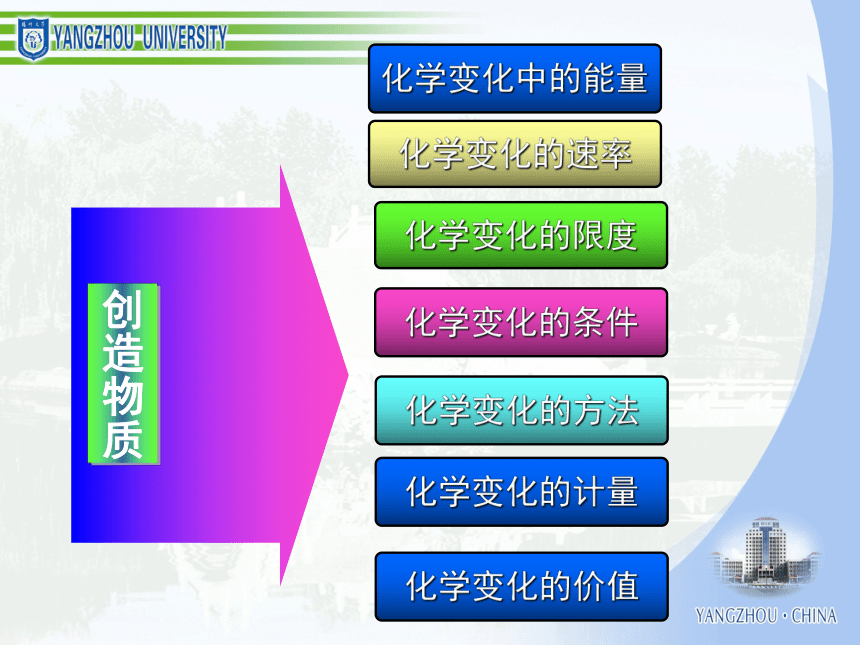
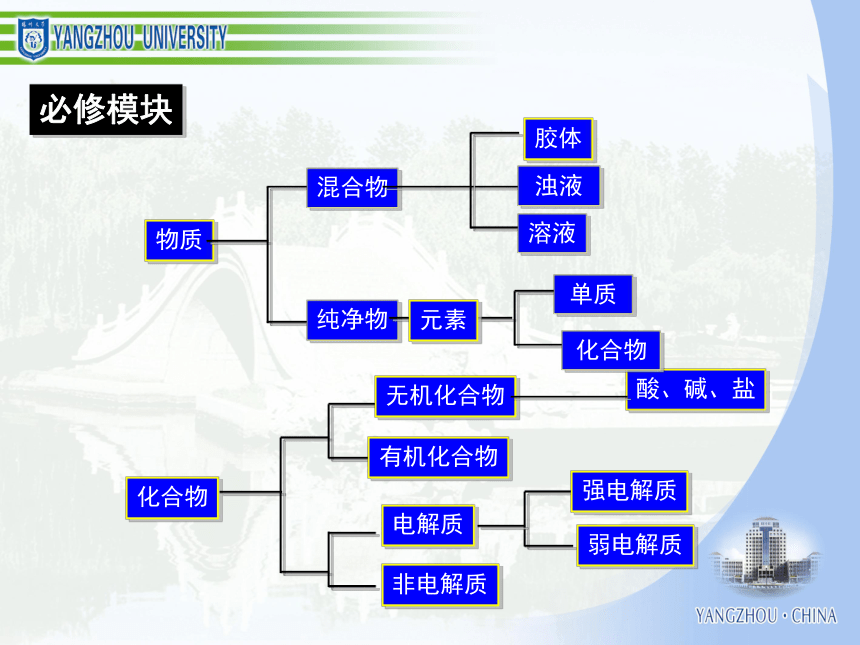
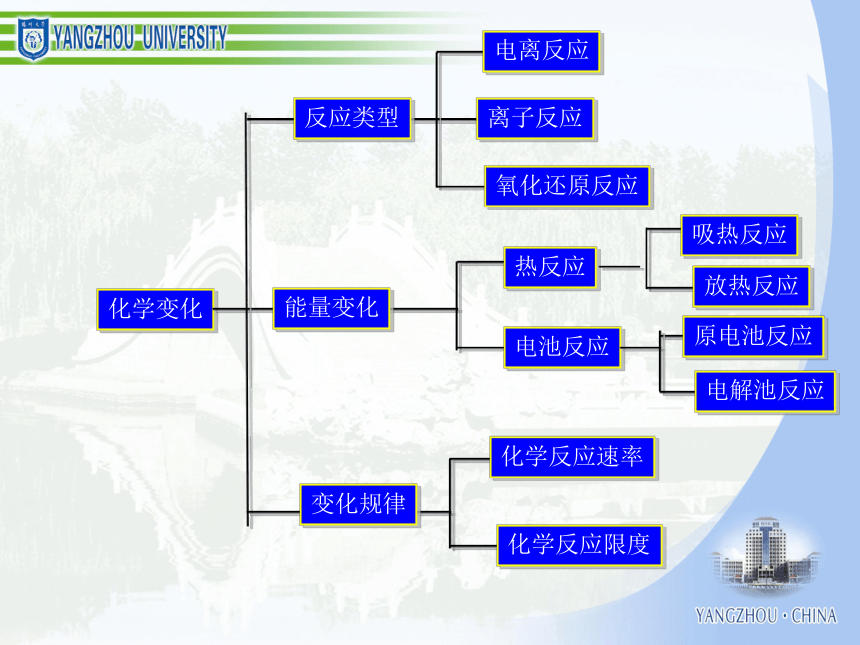
化学学习能力与高考化学成绩 一、认识化学科学二、了解化学思想三、分析高考规律四、组织有效教学考试的作用和功能结构与性质化学反应、能量化学1 化学2 有机化学基础 初中化学 物质结构与性质 化学反应原理 化学变化的速率化学变化的限度化学变化的条件化学变化的方法化学变化的计量化学变化中的能量化学变化的价值物质结构确定和表示物质性质研究和表示物质结构与性质的关系物质组成确定和表示必修模块物质胶体酸、碱、盐混合物纯净物浊液溶液化合物单质元素化合物强电解质弱电解质电解质非电解质无机化合物有机化合物化学变化反应类型电离反应离子反应氧化还原反应能量变化热反应电池反应吸热反应放热反应原电池反应电解池反应变化规律化学反应速率化学反应限度有机化合物反应类型取代反应加成反应消去反应物质类别烃烃衍生物饱和烃不饱和烃芳香烃纯物质离子分子共价键电子转移离子化合物离
子
键原子结构原子核核外电子核外电子排布元素周期律元素周期表核素共价分子共
价
键离
子
键化学变化能量变化热反应电池反应反应热焓变原电池反应电解池反应变化规律反应速率反应方向化学平衡电离平衡沉淀溶解平衡水解平衡焓变、熵变活化能、催化剂化学原理模块物质结构核外电子排布式周期律:
原子半径
化合价
电离能
电负性
金属性周期表
族
周期
区晶体共价分子原子共价键:
σ、π
配位键
键的极性几何构型
杂化
电子对互斥分子极性、溶解性离子晶体分子晶体原子晶体金属晶体晶格能晶格能分子间作用力堆积方式
原子化热物质结构与性质有机化合物结构组成反应碳四价杂化测定方法同分异构取代加成消去烃衍生物有机化学基础实验化学实验化学定量法物质的制备实验研究方法实验研究内容化学实验能力观察法比较法实验法制订方案实验操作观察现象提出课题表述结果应用结论评价反思物质的提纯物质的检验物质的分析性质探究应用研究综合探究思想一:化学是真实客观的08全国I卷经典大学无机化学实验06四川思想二:化学是实验为基础如何操作?碘是否会出来?24.(江苏07,8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺 一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器 中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内 溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
如何除去铝表面氧化膜?如何隔绝空气?06上海一定存在铁吗?FeS 、S 、Fe质量增加颜色不变有VL气体思想三:结构决定性质对焰色的解释物质的熔点差异电解MgCl2时加入其他金属氯化物的作用是什么?08广东题2008年江苏第21题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。Mg与稀HNO3反应生成什么?4Mg + HNO3 + 5H2O = 4 Mg(OH)2↓+ NH3 (1)
4Mg + 10HNO3 = 4 Mg(NO3)2+ NH4NO3+ 3H2O (2)思想四:化学变化的条件性天津08卷 下列离方程式书写正确的是
A、石灰乳与Na2CO3溶液混合:
Ca2++CO32-=CaCO3
B、NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4++HSO3-+2OH- NH3?+SO32-+2H2O
C、酸性条件下KIO3溶液与KI溶液发生反应生成I2:
IO3-+5I-+3H2O=3I2+6OH-
D、AgNO3溶液中加入过量的氨水:
Ag++NH3·H2O=AgOH?+NH4+
学科素养知识能力素养考查目标:科学素养中的学科能力化学视野实验探究化学学科能力测试试卷内容结构题型结构基本概念理论化学实验化学计算有机化学元素化学选择题非选择题试卷结构:内容结构与题型结构试题难度预测试题命题意图分析试题解题思路分析试卷特点分析试卷测量目标一致性分析试卷分析:预测和分析试卷结果统计学生学习情况分析学生知识技能分析学生解决问题方法分析学生考试心理分析方法水平升高试题形成方法体现探究性的理念探究:问题的真实性
过程的开放性
知识的应用性
内容的融合性原创:确定立意
选择情景
资料查阅
综合分析
形成试题体现回归教材高中化学教材中的实验课程改革的内容和理念废铁制备硫酸亚铁山东08试题要素分析选择题可稳定均分,覆盖知识面
选择题中有一定量的基础题和常见题
填充题能考查知识的深度理解
简答题能考查学生的表达能力和发散性思维能力
计算题能考查学生运用数学方法解决问题的能力
证明题能考查学生的逻辑推理能力试题功能分析C1化学08重庆融雪剂评价假设现象和结论全国I28.(13分)
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量的碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水。按图连接仪器。
实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成,同时,b瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却,此时,管中的熔融物凝固成银白色金属。根据以上叙述回答:
(1)元素Z是 ;
(2)停止加热前是否需要先断开a和b的连接处?为什么?
;
(3)反应管a中发生的所有反应的化学方程式是
;
(4)本实验的尾气是否需处理?如需处理,请回答如何处理;如不需处理,请说明理由。
。什么物质?化学方程式可用MO表示反应物?化学键
电解质溶液
阿佛加德罗常数和定律
同分异构现象
盖斯定律的应用
实验现象的描述
生产工艺分析
离子方程式
离子共存
沉淀溶解平衡
原子结构
绿色化学
化学电源
实验分析
元素周期律
元素化合物
有机物结构08全国化学高考试题知识内容选择与非选择融合化学与STSE融合有机与理论的融合速率与元素化合物融合29.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。 应用情景热化学与电化融合电离平稳与计算融合27.(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W(1)Y的电子式是_______________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_______________________。
(3)用图示装置制备NO并验证其还原性。有下列
主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜
片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,
向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是
③步骤c滴入稀硝酸后烧杯中的现象是______________
反应的离子方程式是_____________________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1-T2之间,反应的化学方程式是_________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)______________。
物质结构化学原理实验操作实验现象化学计算26.重庆卷(14分)
N2O5—是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
(2) 2N2O5(g)→4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 .(填“增大”、“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据: 则500 s内N2O5的分解速率为 .
③在T2温度下,反应1 000 s时测得
NO2的浓度为4.98 mol·L-1,则T2 T1.
(3)题26图所示装置可用于制备N2O5,
则N2O5在电解池的 区生成,
其电极反应式为 .
有机物结构式化学平衡速率计算速率影响电化学化学课程标准燃烧热原电池原电子组成?
电极材料?
电池方程式是氧化还原反应?熵变氢键金属原子
堆积化学1化学2反应原理结构性质有机化学物质结构晶体共价分子原子物质结构与性质核外电子排布式周期律:原子半径、化合价、电离能、电负性、金属性几何构型键的极性、
分子极性、溶解性共价键:σ、π杂化晶体类型
物质的熔沸点离子晶体分子间作用力分子间作用力分子间作用力08宁夏物质结构35.[化学——选修物质结构与性质](15分)
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。32.[化学—物质结构与性质]氮是地球上极为丰富的元素。
⑴Li3N晶体中氮以N3-的存在,基态N3-的电子排布式为 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
⑶(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)
a.助燃剂
b.“绿色”溶剂
c.复合材料
d.绝热材料
⑷X+中所有电子正好充满KLM三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
08山东物质结构化学变化能量变化热反应电池反应盖斯定律变化规律反应速率化学平衡电离平衡沉淀溶解平衡水解平衡催化剂化学原理模块溶液中的平平衡转化率计算08宁夏原理试题 已知可逆反应:
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol,L-1, c(N)=2.4 mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 1 mol,L-1,c(N)=2.4 mol·L-1;达到平衡后,c(P)=2 mol·L-1,c(Q)= ;
(4)若反应温度不变,反应物的起始浓度为:c(M)= 1 mol,L-1,达到平衡后,M的转化率为 。29.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。08山东原理试题有机化合物结构组成反应碳四价杂化测定方法同分异构取代加成消去烃衍生物有机化学基础36.[ 化学——选修有机化学基础](15分)
已知化合物A中各元素的质量分数分别为C 37.5%,H 4.2%和O 58.3%。请填空
(1)0.01molA在空气中充分燃烧需消耗氧气1.01L(标准状况),则A的分子式是 ;
(2)实验表明:A不能发生银镜反应。1molA与过量的碳酸氢钠溶液反应可以放出3mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 ;
(3)在浓硫酸催化和适宜的的反应条件下,A与足量的乙醇反应生成B(C12H20O7),B只有两种官能团,其数目比为3∶1。由A生成B的反应类型是 ,该反应的化学方程式是 ;
(4)A失去1分子水后形成化合物C,写出C的两种可能的结构简式及其官能团的名称① ,② 。08宁夏有机试题33.[化学—有机化学基础]
苯丙酸诺龙是一种兴奋剂,结构简式为:
⑴由苯丙酸诺龙的结构推测,它能 (填代号)。
a.使溴的四氯化碳溶液褪色 b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应 d.与Na2CO3溶液作用生成CO2
苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:
据以上信息回答⑵~⑷题:
⑵B→D的反应类型是 。
⑶C的结构简式为 。
⑷F→G的化学方程式是 。08山东有机试题08海南有机试题21.(11分)A、B、C、D1、D2、E、F、G、H均为有机化合物,请根据下列图示回答问题。
(1)直链有机化合物A的结构简式是_________________________;
(2)①的反应试剂和反应条件是____________________;
(3)③的反应类型是_______________________________;
(4)B生成C的化学方程式是_______________________________;
D1或D2生成E的化学方程式是_____________________________;
(5)G可应用于医疗、爆破等,由F生成G的化学方程式是_________________。
08江苏有机试题客观规律研究内容2008年宁夏第35题
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。SCOCrF并非全部谢谢扬州大学 吴 星
Tel:0514-7975398
13665248211 wuxin@yzu.edu.cn
Tel:0514-7975398, 13665248211
wuxin@yzu.edu.cn吴星化学是真实的近几年化学高考的启迪与思考公民教育与大学预科教育的关系
课程改革与高校招生改革
化学高考与化学教学
化学学习能力与高考化学成绩 一、认识化学科学二、了解化学思想三、分析高考规律四、组织有效教学考试的作用和功能结构与性质化学反应、能量化学1 化学2 有机化学基础 初中化学 物质结构与性质 化学反应原理 化学变化的速率化学变化的限度化学变化的条件化学变化的方法化学变化的计量化学变化中的能量化学变化的价值物质结构确定和表示物质性质研究和表示物质结构与性质的关系物质组成确定和表示必修模块物质胶体酸、碱、盐混合物纯净物浊液溶液化合物单质元素化合物强电解质弱电解质电解质非电解质无机化合物有机化合物化学变化反应类型电离反应离子反应氧化还原反应能量变化热反应电池反应吸热反应放热反应原电池反应电解池反应变化规律化学反应速率化学反应限度有机化合物反应类型取代反应加成反应消去反应物质类别烃烃衍生物饱和烃不饱和烃芳香烃纯物质离子分子共价键电子转移离子化合物离
子
键原子结构原子核核外电子核外电子排布元素周期律元素周期表核素共价分子共
价
键离
子
键化学变化能量变化热反应电池反应反应热焓变原电池反应电解池反应变化规律反应速率反应方向化学平衡电离平衡沉淀溶解平衡水解平衡焓变、熵变活化能、催化剂化学原理模块物质结构核外电子排布式周期律:
原子半径
化合价
电离能
电负性
金属性周期表
族
周期
区晶体共价分子原子共价键:
σ、π
配位键
键的极性几何构型
杂化
电子对互斥分子极性、溶解性离子晶体分子晶体原子晶体金属晶体晶格能晶格能分子间作用力堆积方式
原子化热物质结构与性质有机化合物结构组成反应碳四价杂化测定方法同分异构取代加成消去烃衍生物有机化学基础实验化学实验化学定量法物质的制备实验研究方法实验研究内容化学实验能力观察法比较法实验法制订方案实验操作观察现象提出课题表述结果应用结论评价反思物质的提纯物质的检验物质的分析性质探究应用研究综合探究思想一:化学是真实客观的08全国I卷经典大学无机化学实验06四川思想二:化学是实验为基础如何操作?碘是否会出来?24.(江苏07,8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺 一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器 中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内 溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
如何除去铝表面氧化膜?如何隔绝空气?06上海一定存在铁吗?FeS 、S 、Fe质量增加颜色不变有VL气体思想三:结构决定性质对焰色的解释物质的熔点差异电解MgCl2时加入其他金属氯化物的作用是什么?08广东题2008年江苏第21题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。Mg与稀HNO3反应生成什么?4Mg + HNO3 + 5H2O = 4 Mg(OH)2↓+ NH3 (1)
4Mg + 10HNO3 = 4 Mg(NO3)2+ NH4NO3+ 3H2O (2)思想四:化学变化的条件性天津08卷 下列离方程式书写正确的是
A、石灰乳与Na2CO3溶液混合:
Ca2++CO32-=CaCO3
B、NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4++HSO3-+2OH- NH3?+SO32-+2H2O
C、酸性条件下KIO3溶液与KI溶液发生反应生成I2:
IO3-+5I-+3H2O=3I2+6OH-
D、AgNO3溶液中加入过量的氨水:
Ag++NH3·H2O=AgOH?+NH4+
学科素养知识能力素养考查目标:科学素养中的学科能力化学视野实验探究化学学科能力测试试卷内容结构题型结构基本概念理论化学实验化学计算有机化学元素化学选择题非选择题试卷结构:内容结构与题型结构试题难度预测试题命题意图分析试题解题思路分析试卷特点分析试卷测量目标一致性分析试卷分析:预测和分析试卷结果统计学生学习情况分析学生知识技能分析学生解决问题方法分析学生考试心理分析方法水平升高试题形成方法体现探究性的理念探究:问题的真实性
过程的开放性
知识的应用性
内容的融合性原创:确定立意
选择情景
资料查阅
综合分析
形成试题体现回归教材高中化学教材中的实验课程改革的内容和理念废铁制备硫酸亚铁山东08试题要素分析选择题可稳定均分,覆盖知识面
选择题中有一定量的基础题和常见题
填充题能考查知识的深度理解
简答题能考查学生的表达能力和发散性思维能力
计算题能考查学生运用数学方法解决问题的能力
证明题能考查学生的逻辑推理能力试题功能分析C1化学08重庆融雪剂评价假设现象和结论全国I28.(13分)
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量的碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水。按图连接仪器。
实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成,同时,b瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却,此时,管中的熔融物凝固成银白色金属。根据以上叙述回答:
(1)元素Z是 ;
(2)停止加热前是否需要先断开a和b的连接处?为什么?
;
(3)反应管a中发生的所有反应的化学方程式是
;
(4)本实验的尾气是否需处理?如需处理,请回答如何处理;如不需处理,请说明理由。
。什么物质?化学方程式可用MO表示反应物?化学键
电解质溶液
阿佛加德罗常数和定律
同分异构现象
盖斯定律的应用
实验现象的描述
生产工艺分析
离子方程式
离子共存
沉淀溶解平衡
原子结构
绿色化学
化学电源
实验分析
元素周期律
元素化合物
有机物结构08全国化学高考试题知识内容选择与非选择融合化学与STSE融合有机与理论的融合速率与元素化合物融合29.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。 应用情景热化学与电化融合电离平稳与计算融合27.(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W(1)Y的电子式是_______________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_______________________。
(3)用图示装置制备NO并验证其还原性。有下列
主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜
片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,
向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是
③步骤c滴入稀硝酸后烧杯中的现象是______________
反应的离子方程式是_____________________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1-T2之间,反应的化学方程式是_________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)______________。
物质结构化学原理实验操作实验现象化学计算26.重庆卷(14分)
N2O5—是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
(2) 2N2O5(g)→4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 .(填“增大”、“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据: 则500 s内N2O5的分解速率为 .
③在T2温度下,反应1 000 s时测得
NO2的浓度为4.98 mol·L-1,则T2 T1.
(3)题26图所示装置可用于制备N2O5,
则N2O5在电解池的 区生成,
其电极反应式为 .
有机物结构式化学平衡速率计算速率影响电化学化学课程标准燃烧热原电池原电子组成?
电极材料?
电池方程式是氧化还原反应?熵变氢键金属原子
堆积化学1化学2反应原理结构性质有机化学物质结构晶体共价分子原子物质结构与性质核外电子排布式周期律:原子半径、化合价、电离能、电负性、金属性几何构型键的极性、
分子极性、溶解性共价键:σ、π杂化晶体类型
物质的熔沸点离子晶体分子间作用力分子间作用力分子间作用力08宁夏物质结构35.[化学——选修物质结构与性质](15分)
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。32.[化学—物质结构与性质]氮是地球上极为丰富的元素。
⑴Li3N晶体中氮以N3-的存在,基态N3-的电子排布式为 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
⑶(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)
a.助燃剂
b.“绿色”溶剂
c.复合材料
d.绝热材料
⑷X+中所有电子正好充满KLM三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
08山东物质结构化学变化能量变化热反应电池反应盖斯定律变化规律反应速率化学平衡电离平衡沉淀溶解平衡水解平衡催化剂化学原理模块溶液中的平平衡转化率计算08宁夏原理试题 已知可逆反应:
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol,L-1, c(N)=2.4 mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 1 mol,L-1,c(N)=2.4 mol·L-1;达到平衡后,c(P)=2 mol·L-1,c(Q)= ;
(4)若反应温度不变,反应物的起始浓度为:c(M)= 1 mol,L-1,达到平衡后,M的转化率为 。29.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。08山东原理试题有机化合物结构组成反应碳四价杂化测定方法同分异构取代加成消去烃衍生物有机化学基础36.[ 化学——选修有机化学基础](15分)
已知化合物A中各元素的质量分数分别为C 37.5%,H 4.2%和O 58.3%。请填空
(1)0.01molA在空气中充分燃烧需消耗氧气1.01L(标准状况),则A的分子式是 ;
(2)实验表明:A不能发生银镜反应。1molA与过量的碳酸氢钠溶液反应可以放出3mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 ;
(3)在浓硫酸催化和适宜的的反应条件下,A与足量的乙醇反应生成B(C12H20O7),B只有两种官能团,其数目比为3∶1。由A生成B的反应类型是 ,该反应的化学方程式是 ;
(4)A失去1分子水后形成化合物C,写出C的两种可能的结构简式及其官能团的名称① ,② 。08宁夏有机试题33.[化学—有机化学基础]
苯丙酸诺龙是一种兴奋剂,结构简式为:
⑴由苯丙酸诺龙的结构推测,它能 (填代号)。
a.使溴的四氯化碳溶液褪色 b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应 d.与Na2CO3溶液作用生成CO2
苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:
据以上信息回答⑵~⑷题:
⑵B→D的反应类型是 。
⑶C的结构简式为 。
⑷F→G的化学方程式是 。08山东有机试题08海南有机试题21.(11分)A、B、C、D1、D2、E、F、G、H均为有机化合物,请根据下列图示回答问题。
(1)直链有机化合物A的结构简式是_________________________;
(2)①的反应试剂和反应条件是____________________;
(3)③的反应类型是_______________________________;
(4)B生成C的化学方程式是_______________________________;
D1或D2生成E的化学方程式是_____________________________;
(5)G可应用于医疗、爆破等,由F生成G的化学方程式是_________________。
08江苏有机试题客观规律研究内容2008年宁夏第35题
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。SCOCrF并非全部谢谢扬州大学 吴 星
Tel:0514-7975398
13665248211 wuxin@yzu.edu.cn
同课章节目录
