必修1复习课件
图片预览










文档简介
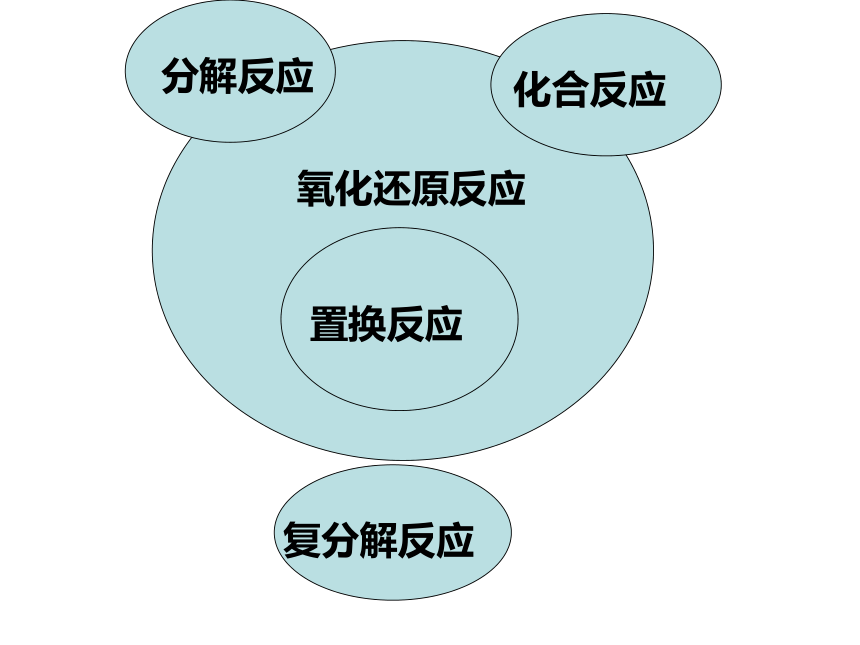
课件67张PPT。物质的分类树状图 p31、下列物质中前者从属于后者的是( )
A、纯净物、混合物 B、氧化物、化合物
C、盐、正盐 D、金属氧化物、碱性氧化物B2、下列说法中,正确的是 ( )
A、非金属氧化物都是酸性氧化物
B、酸性氧化物都是非金属氧化物
C、金属氧化物都是碱性氧化物
D、碱性氧化物都是金属氧化物E、与水反应生成酸的氧化物,不一定是该酸对应的酸性氧化物
F、凡是酸性氧化物都可以直接和水反应生成对应的酸
G、含氧元素的化合物是氧化物
H、单质含有一种元素,由一种元素组成的物质就是单质
I、HCl是纯净物,纯净的盐酸是纯净物
J、凡是在水中电离出H+的物质就是酸DE2.在历史上,人们曾经认为有机化合物只能由生物的细胞在一种特殊力量——生命力的作用下才能产生。经过科学家长时间的努力,终于由无机物合成了有机物。通过人工方法首次合成得到的有机物是 ( )
A、甲烷 B、乙醇 C、尿素 D、醋酸C1.下面说法正确的是 ( )
A.1mol米是6.02 ×1023粒米
B.10mol氢所含粒子数为6.02 ×1024
C.摩尔是物质的量的单位
D.阿伏加德罗常数就是6.02×1023mol-1E.H的摩尔质量是1g.mol-1
F.氩气的摩尔质量在数值上等于它的相对原子质量
G.1mol任何物质的质量等于该物质的相对分子质量物质的量CE1、决定体积的因素气体摩尔体积2、标准状况下气体摩尔体Vm≈22.4L/mol1、下列说法正确的是 ( )
A、1mol氖气和1 mol氧气体积相同
B、0.1molN2在25℃和101kPa时体积约为2.24 L
C、22g二氧化碳与标准状况下11.2 L HCl含有相同的分子
数
D、0.3molN2、0.7molO2在标准状况下的总体积约为22.4L2、相同物质的量的各固体或液体的体积并不相同,其主要原因是 ( );相同物质的量的气体的体积并 不相同,其主要原因是 ( )
A、粒子大小不同
B、粒子质量不同
C、粒子间距离不同
D、粒子间作用力不同CDCA阿伏加德罗定律 gNa2CO3.10H2O溶于90g水中,才能使的每100
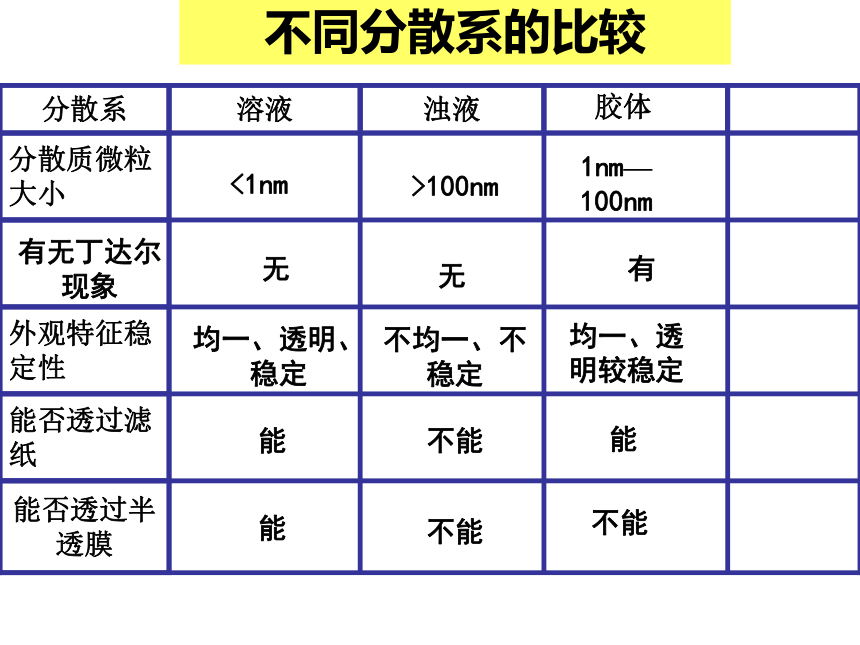
个水分子中溶有一个Na+7.53混合气体的平均相对分子质量1nm—100nm>100nm<1nm均一、透明较稳定不均一、不稳定均一、透明、稳定不能不能能能不能能不同分散系的比较 有无丁达尔现象无无有胶体根据分散剂状态分 固溶胶:有色玻璃液溶胶:AgI胶体、Fe(OH)3胶体、豆浆、牛奶、气溶胶:烟、云、雾电解质电解质 强电解质: 弱电解质: (电离是一个可逆过程)在水溶液或融化状态下能导电的化合物。在水溶液和融化状态下都不能导电的化合物电解质 :非电解质强酸、强碱、盐 弱酸、 NH3.H2O、 H2O1、导电性强弱取决于离子浓度大小而不是看它是强电解质还是弱电解质.3、电解质是强还是弱取决于电离程度,与导电
性没有必然联系.4、相同浓度下强电解质的导电性比弱电解质强.强弱电解质与导电性2、电解质只有在溶于水或熔化时才导电。2、被萃取的物质在萃取剂中的溶解度远远大于在原溶
剂中的溶解度萃取剂的要求1、与原溶剂互不相溶1、不能引入新的杂质2、被提纯的物质不能减少3、除杂试剂应该过量4、过量试剂必须除去5、除杂中用到多种物质时,要考虑加入试剂的顺序6、被提纯或分离的物质要复原物质的分离和提纯的要求1.已知粗盐中含有泥砂、MgCl2、CaCl2、Na2SO4等杂质
设计实验除去以上杂质得到精盐离子检验1.CO32-加入CaCl2溶液后有白色沉淀产生,加入盐酸后产生的无色无味的气体,该气体通入澄清石灰水有浑浊现象3. SO42-先加入盐酸酸化后没有白色沉淀产生,再加BaCl2溶液后有白色沉淀产生5、Na元素 :黄色6、K元素:紫色 (透过蓝色钴玻璃)2. SO32-先加入BaCl2溶液后有白色沉淀产生,再加盐酸有刺激性气味的产生物质的量浓度质量数质子数ClS2-Na+ 3517中子数电子数2312323545181817101616801135粒子原子结构质量数——质子数——
(核电荷数 )——离子的价态——化合价——原子个数 数字的位置不同,所表示的意义就不同1、元素:具有相同核电荷数(即质子数)的同一类原子
的总称。2、核素:具有一定数目的质子和一定数目的中子的一种
原子的总称。3、同位素: 原子核内质子数相同中子数不同的原子互
称为同位数。元素、核素、同位素1、某元素的同种同位素,它们的原子具有不同的( )
A.质子数 B.质量数
C.核电荷数 D.电子数2.写出(1)核外有10个电子的分子
(2)核外有10个电子的离子
(3)核外有18个电子的分子
(4)核外有18个电子的离子由这几种核数共可形成几种水分子?
所得水的相对分子质量最多有几种?mL——Lg/mol—— /微粒化合物标准状况下气体友情提醒一、氧化还原反应1、本质:2、判断:3、氧化还原性比较:有电子转移的化学反应根据化合价变化a、同一个氧化还原反应b.根据已知事实 c、根据反应条件d、根据反应产物3、应用:Cl2与Fe3+4、电子转移: 2、6.4gCu溶解在一定量的HNO3中,形成NOX,通 入一定量的氧气溶与水中正好又形成硝酸,则通入氧气的量?1.指出下列反应中转移的电子数 二、 离子反应1、发生的条件:2、离子不能大量共存的原因:使得反应物中某些离子浓度变小(3).离子间发生氧化还原反应Fe3+I-S2-NO3-(H+)Fe2+SO32-I-S2-MnO4-(H+)Fe2+I-S2-(4.) 看有没有外界条件1、一律写化学式:弱酸弱碱水、固体难溶盐
单质氧化物、气体浓硫酸三、离子方程式下列哪些离子不能共存,并且说明其原因
A Ca2+ Na+ SO32- Cl-
B H+ Na+ Cl- CH3COO-
C Na+ K+ HCO3- OH-
D H+ Na+ Cl- AlO2-
E Fe3+ Na+ Cl- SCN-
F Fe2+ H+ Cl- NO3-判断下列离子方程式是否正确3.FeCl 3+ Cu:Fe3+ + Cu ==== Fe2+ + Cu2+ 6.CaCO3 + HCl:CO32- +2H+ === CO2 + H2O7.FeBr2 + Cl2(少量):Cl2 + 2Br- === 2Cl- + Br29.Fe(OH)3+HI(强酸): Fe(OH)3 + 3H+ === Fe3+ + H2O5.Na+H2O:Na+H2O=====Na+ +OH- +H21.向NaHSO4溶液中逐滴加入Ba(OH)2溶液呈
中性,写出反应的离子方程式___________
以上中性溶液中继续滴加Ba(OH)2溶液,写出此反应的离子方程式_____________
2.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至恰好不再产生沉淀为止,写出反应的离子方程式___________
在以上溶液中继续滴加NaHSO4溶液,写出此反应的离子方程式____________1.氯气的性质,制法,用途(1)物理性质:黄绿色、有刺激性气味的有毒气体能溶于水 1:2(2)化学性质a、与金属的反应b、与非金属单质的反应(H2)c 、与水的反应d、氧化性(3)工业制法:电解饱和食盐水某工厂发生氯气钢瓶泄露事件:
(1)如果你当时在现场,应该往哪里撤离?(山坡上/低洼处)
(2)应该准备什么样的简易”防毒面具”避免吸入较多的氯气?
(3)如何利用家中现成的物质来制简易”防毒面具”
(4)他们发现泄露的氯气钢瓶,投入剩有某物质溶液中,该物质是_____
(5)对于弥漫在空气中的氯气,消防队员喷洒一种挥发性的化学物质处理.其化学物质是什么?A B C D发生装置-----除杂装置—干燥装置--收集装置--吸收装置实验室制法图看教材P40的实验室制备氯气的装置图
(1)写出圆底烧瓶中发生的离子方程式
(2)实验前必须检查气密性,如何检查?
(3)如果将过量的二氧化锰与20ml 12mol/L的盐酸混合加热,充分反应生成氢气的物质的量明显小于0.01mol ,其主要原因1________2_______
(4)为了提高浓盐酸的利用率,你对实验的建议有1________ 2_______
(5)实验结束时,为了减少烧瓶中残留氯对环境的影响,可以向烧瓶中加入的溶液是_________有关离子方程式____________(6)兴趣小组的同学在烧杯中加入下列溶液中的一种溶液吸收氯气,你认为其中错误的是________
A.氢氧化钠 B.碳酸钠
C.浓硫酸 D.亚硫酸钠溶液1.新制氯水呈____色,可以说明_______存在
2.氯水的PH值_____水,说明氯水呈____性
3.向氯水中滴加紫色石蕊试液产生的现象是_________,可以说明氯水中存在_______微粒
4.在氯水中加入AgNO3溶液,产生的现象_________说明存在_______微粒
5.可以用钢瓶来存在液氯,为了防止钢瓶的腐蚀,冲入氯气前必须_____2.氯水的成分及探究三分子四离子HClO的性质: 强氧化性(表现出漂白性,杀菌,消毒):不稳定易分解:能使有机色素褪色一元弱酸:特性溴、碘均易溶于有机溶剂(CCl4、酒精、汽油、苯)3、溴.碘的物理性质特点CCl4Cl2KI碘水(棕黄色)下层:碘的四氯
化碳溶液(紫红色) 溴与碘的性质及萃取实验1、从海水中提取溴主要原理:Cl2+2NaBr====2NaCl+Br2步骤:①向海水中通入Cl2,使NaBr氧化(化学方程式)
②向所得溶液中鼓入热空气,将Br2吹出得粗溴,用纯
碱吸收,生成NaBr和NaBrO3
③将②中所得的溶液中加硫酸酸化,使NaBr、NaBrO3转化为溴4、钠a、物理性质:b、化学性质:c、提取钠:电解熔融的NaCl与水反应的现象:浮、熔、游、嘶、红Na2O2的性质:2Na2O2+2H2O= 4NaOH+ O2 ↑2Na2O2+2CO2= 2NaCO3+ O2 ↑碳酸钠和碳酸氢钠的比较 Na2CO3NaHCO3纯碱 苏打小苏打白色粉末白色晶体易溶于水相同温度下,比碳酸钠溶解度小剧烈Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O较稳定不稳定☆☆碱性相同浓度下,比碳酸钠 碱性弱与同浓度盐酸反应,比碳酸钠剧烈16. 向100g 8%烧碱溶液中通入一定量的CO2,将溶液在
低温下蒸干得固体产物10g,则该固体可能是 ( )
A、Na2CO3 B、NaHCO3
C、Na2CO3和NaHCO3 D、Na2CO3和NaOH17. 将0.5mol金属钠投入到足量水中,得到溶液a;将
0.5molMg投入到与水等质量的足量盐酸中,得溶液b,
则a和b的质量关系为 ( )
A、a=b B、a>b C、a HCl的盐酸中,或将1L含91.2gHCl的盐酸慢慢滴入
1L含212gNa2CO3的纯碱溶液中。这两种操作,在理论
上产生气体的质量比(不考虑气体在水中的溶解)是
A、1:1 B、2:5 C、2:1 D、5:2将CO2通入氨水的NaCl饱和溶液中,使溶解度较小的NaHCO3从溶液中析出,再加热析出的晶体即得纯碱。NaCl+NH3+CO2+H2O===NaHCO3+NH4Cl侯氏制碱法AlCl3NaAlO2Al(OH)3NaOH 或NH3.H2ONaOHHCl或CO2 +H2OHClAl2O3AlNaOH +H2OHClNaOH △HCl或Cl2或CuCl2电解O2或Fe2O316.往100mL 0.1mol/L的硫酸铝溶液中,加入浓度为
0.5mol/L的氢氧化钠溶液,当生成白色沉淀1.17g时,
加入氢氧化钠溶液的体积是 ( )
A. 130 mL B. 120 mL C. 90 mL D. 80 mL18.将10.2g镁铝合金粉末溶于4mol/L的盐酸400mL里,
加入2mol/L的氢氧化钠溶液,使得到的沉淀达到
最大值,则需氢氧化钠溶液的体积是 ( )
A.500mL B.800mL
C.1000mL D.1200mL35.将一定量的镁铝合金溶解在500ml 盐
酸中,然后取出10mL溶液,向其中加入1mol/L
的NaOH溶液,加入NaOH溶液时产生的沉淀
的质量m与所加NaOH溶液的体积V的
关系如右图所示。求:
(1)合金中镁和铝的质量。
(2)盐酸的物质的量浓度。
(设合金溶解后溶液的体积不变)2 14 16 V(mL)
m(g)36.把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于
足量的水中,产生1.16g沉淀,再向所得浊液中逐滴
加入1.00mol/LHCl,加入HCl溶液的体积与生成沉淀
的关系如右图所示。试回答: (1)A点的沉淀物的化学式为
理由是
(2)写出A点至B点发生反应的离子方程
(3)原混合物中AlCl3的物质的量为 mol
( 4)C点所加入的盐酸的体积为 mL
6、铁a、物理性质:硬度小、熔点沸高,导电导热性良好、
能被磁体吸引,具铁磁性b、化学性质:铁三角②加KSCN :c、Fe2+与Fe3+鉴别①观色法:④加碱:浅绿色的是Fe2+ ,黄色的是Fe3+ 加KSCN变血红色的是Fe3+③加淀粉碘化钾:试纸变蓝色的是Fe3+弱氧化剂:S、 Cu2+、HCl强氧化剂:Cl2、Br2Cl2、Br2、HNO3、浓H2SO4Fe、Cu、I-C、CO、H2、Al C、CO、H2、Al铁三角1、金属阳离子作为氧化剂在参加氧化还原反应时一定被还原成金属单质吗?2、如果金属A能和金属B的阳离子反应,则A比B活泼,对吗?为什么?3、根据所学知识你知道Fe2+、Fe3+、Cu2+的氧化性强弱顺序吗?4、如何防止Fe2+转化成Fe3+?a、加铁
b、尽量排尽溶液中的O2
c、在反应液上加一层保护层(汽油)9、现有一FeCl2、FeCl3、CuSO4的混合溶液,加入一定量的铁粉,按下列情况填空:
(1)反应完毕后Fe粉有剩余,则溶液中一定含有的阳离子是 ,一定没有的阳离子是 ;
(2)反应完毕后有铜粉无铁粉,则溶液中一定含有的阳离子是 ,可能含有的阳离子是 , 一定没有的阳离子是 ;
(3)反应完毕后无固体沉淀物存在,则反应后的溶液中一定含有的阳离子是 。Fe2+Cu2+、Fe3+Cu2+、Fe2+Fe2+Cu2+Fe3+3、10、23、346.有FeCl3和CuCl2的混合液,向其中加入Zn,充分反应后
(1)若溶液中没有任何固体析出,则溶液中一定有的阳离子是 ,可能有的阳离子是 .
(2)若溶液中仅有铜析出,则溶液中一定没有的阳离子是 ,可能有的阳离子是 .
(3)若溶液中有铁析出,则溶液中一定没有的阳离子是 . Fe2+、Cu2+、Zn2+Fe3+Fe3+Cu2+Fe3+、Cu2+4、工业炼铁a.设备:
b.原料:
c.炼制过程
d.产品:高炉铁矿石、焦炭、石灰石、空气生铁(约97%)——CO还原Fe2O3注意:
焦炭产生CO、提供温度
石灰石提供CO2、除SiO2MgCl2.6H2O 8、硅(1)、水泥3CaO·SiO2 2CaO·SiO2 3CaO·Al2O3石灰石、黏土a、生产原料:b、产品的成分:c、产品的特性:水硬性(2)、玻璃a、主要反应:
b、产品主要成分:
c、产品的特性:Na2O·CaO·6SiO2没有固定的熔点、有一定的膨胀系数(3)、硅a、物理性质:具有金属光泽、不溶于水的固体、
熔点高,硬度大、半导体
b、化学性质: 常温下能与强碱反应Si+2NaOH+H2O==== Na2SiO3 +2H2↑加热条件下能与氧气、氯气反应 性质很稳定,常温下与强酸、强氧化剂等都不反应(4)、二氧化硅a、物理性质:不溶于水的固体、熔点高、硬度大b、化学性质:与碱性氧化物、碱SiO2+2NaOH====Na2SiO3+H2O——典型的酸性氧化物高温下能被碳还原只与酸中的HF反应SiO2+4HF====SiF4↑+2H2O——HF能腐蚀玻璃 硅酸1、不稳定性(水玻璃在空气中变质)2、制法1、将足量的CO2通入Na2SiO3溶液中,然后对溶液加热蒸干,最后高温灼烧残留物,则该残留物是 。Na2SiO32、下列物质中属于硅酸盐产品的是 ,属于纯净物的是 ,制造光导的是 ,通常在建筑业中用作黏合剂的是 。
A、有机玻璃 B、石英 C、水泥
D、单晶硅 E、水玻璃 F、燧石
G、沙子CDBCE金属的腐蚀1、实质:2、分类:化学腐蚀金属或合金发生氧化还原反应电化学腐蚀:金属与周围物质接触直接发生的反应:不纯金属或合金与电解质溶液直接接
触发生的腐蚀注意:纯的金属不发生电化学腐蚀电化学腐蚀伴随电流的产生3、防腐方法a、覆盖保护层(涂油、刷漆、加塑料、搪瓷、钝化)b、改变金属内部结构(不锈钢)c、牺牲阳极的阴极保护法d、外加电流保护法(镀锌)1、下面铁被腐蚀由快到慢的顺序为 。
①镀锌 ②镀铅 ③与负极相连 ④与正极相连④<②<①<③
A、纯净物、混合物 B、氧化物、化合物
C、盐、正盐 D、金属氧化物、碱性氧化物B2、下列说法中,正确的是 ( )
A、非金属氧化物都是酸性氧化物
B、酸性氧化物都是非金属氧化物
C、金属氧化物都是碱性氧化物
D、碱性氧化物都是金属氧化物E、与水反应生成酸的氧化物,不一定是该酸对应的酸性氧化物
F、凡是酸性氧化物都可以直接和水反应生成对应的酸
G、含氧元素的化合物是氧化物
H、单质含有一种元素,由一种元素组成的物质就是单质
I、HCl是纯净物,纯净的盐酸是纯净物
J、凡是在水中电离出H+的物质就是酸DE2.在历史上,人们曾经认为有机化合物只能由生物的细胞在一种特殊力量——生命力的作用下才能产生。经过科学家长时间的努力,终于由无机物合成了有机物。通过人工方法首次合成得到的有机物是 ( )
A、甲烷 B、乙醇 C、尿素 D、醋酸C1.下面说法正确的是 ( )
A.1mol米是6.02 ×1023粒米
B.10mol氢所含粒子数为6.02 ×1024
C.摩尔是物质的量的单位
D.阿伏加德罗常数就是6.02×1023mol-1E.H的摩尔质量是1g.mol-1
F.氩气的摩尔质量在数值上等于它的相对原子质量
G.1mol任何物质的质量等于该物质的相对分子质量物质的量CE1、决定体积的因素气体摩尔体积2、标准状况下气体摩尔体Vm≈22.4L/mol1、下列说法正确的是 ( )
A、1mol氖气和1 mol氧气体积相同
B、0.1molN2在25℃和101kPa时体积约为2.24 L
C、22g二氧化碳与标准状况下11.2 L HCl含有相同的分子
数
D、0.3molN2、0.7molO2在标准状况下的总体积约为22.4L2、相同物质的量的各固体或液体的体积并不相同,其主要原因是 ( );相同物质的量的气体的体积并 不相同,其主要原因是 ( )
A、粒子大小不同
B、粒子质量不同
C、粒子间距离不同
D、粒子间作用力不同CDCA阿伏加德罗定律 gNa2CO3.10H2O溶于90g水中,才能使的每100
个水分子中溶有一个Na+7.53混合气体的平均相对分子质量1nm—100nm>100nm<1nm均一、透明较稳定不均一、不稳定均一、透明、稳定不能不能能能不能能不同分散系的比较 有无丁达尔现象无无有胶体根据分散剂状态分 固溶胶:有色玻璃液溶胶:AgI胶体、Fe(OH)3胶体、豆浆、牛奶、气溶胶:烟、云、雾电解质电解质 强电解质: 弱电解质: (电离是一个可逆过程)在水溶液或融化状态下能导电的化合物。在水溶液和融化状态下都不能导电的化合物电解质 :非电解质强酸、强碱、盐 弱酸、 NH3.H2O、 H2O1、导电性强弱取决于离子浓度大小而不是看它是强电解质还是弱电解质.3、电解质是强还是弱取决于电离程度,与导电
性没有必然联系.4、相同浓度下强电解质的导电性比弱电解质强.强弱电解质与导电性2、电解质只有在溶于水或熔化时才导电。2、被萃取的物质在萃取剂中的溶解度远远大于在原溶
剂中的溶解度萃取剂的要求1、与原溶剂互不相溶1、不能引入新的杂质2、被提纯的物质不能减少3、除杂试剂应该过量4、过量试剂必须除去5、除杂中用到多种物质时,要考虑加入试剂的顺序6、被提纯或分离的物质要复原物质的分离和提纯的要求1.已知粗盐中含有泥砂、MgCl2、CaCl2、Na2SO4等杂质
设计实验除去以上杂质得到精盐离子检验1.CO32-加入CaCl2溶液后有白色沉淀产生,加入盐酸后产生的无色无味的气体,该气体通入澄清石灰水有浑浊现象3. SO42-先加入盐酸酸化后没有白色沉淀产生,再加BaCl2溶液后有白色沉淀产生5、Na元素 :黄色6、K元素:紫色 (透过蓝色钴玻璃)2. SO32-先加入BaCl2溶液后有白色沉淀产生,再加盐酸有刺激性气味的产生物质的量浓度质量数质子数ClS2-Na+ 3517中子数电子数2312323545181817101616801135粒子原子结构质量数——质子数——
(核电荷数 )——离子的价态——化合价——原子个数 数字的位置不同,所表示的意义就不同1、元素:具有相同核电荷数(即质子数)的同一类原子
的总称。2、核素:具有一定数目的质子和一定数目的中子的一种
原子的总称。3、同位素: 原子核内质子数相同中子数不同的原子互
称为同位数。元素、核素、同位素1、某元素的同种同位素,它们的原子具有不同的( )
A.质子数 B.质量数
C.核电荷数 D.电子数2.写出(1)核外有10个电子的分子
(2)核外有10个电子的离子
(3)核外有18个电子的分子
(4)核外有18个电子的离子由这几种核数共可形成几种水分子?
所得水的相对分子质量最多有几种?mL——Lg/mol—— /微粒化合物标准状况下气体友情提醒一、氧化还原反应1、本质:2、判断:3、氧化还原性比较:有电子转移的化学反应根据化合价变化a、同一个氧化还原反应b.根据已知事实 c、根据反应条件d、根据反应产物3、应用:Cl2与Fe3+4、电子转移: 2、6.4gCu溶解在一定量的HNO3中,形成NOX,通 入一定量的氧气溶与水中正好又形成硝酸,则通入氧气的量?1.指出下列反应中转移的电子数 二、 离子反应1、发生的条件:2、离子不能大量共存的原因:使得反应物中某些离子浓度变小(3).离子间发生氧化还原反应Fe3+I-S2-NO3-(H+)Fe2+SO32-I-S2-MnO4-(H+)Fe2+I-S2-(4.) 看有没有外界条件1、一律写化学式:弱酸弱碱水、固体难溶盐
单质氧化物、气体浓硫酸三、离子方程式下列哪些离子不能共存,并且说明其原因
A Ca2+ Na+ SO32- Cl-
B H+ Na+ Cl- CH3COO-
C Na+ K+ HCO3- OH-
D H+ Na+ Cl- AlO2-
E Fe3+ Na+ Cl- SCN-
F Fe2+ H+ Cl- NO3-判断下列离子方程式是否正确3.FeCl 3+ Cu:Fe3+ + Cu ==== Fe2+ + Cu2+ 6.CaCO3 + HCl:CO32- +2H+ === CO2 + H2O7.FeBr2 + Cl2(少量):Cl2 + 2Br- === 2Cl- + Br29.Fe(OH)3+HI(强酸): Fe(OH)3 + 3H+ === Fe3+ + H2O5.Na+H2O:Na+H2O=====Na+ +OH- +H21.向NaHSO4溶液中逐滴加入Ba(OH)2溶液呈
中性,写出反应的离子方程式___________
以上中性溶液中继续滴加Ba(OH)2溶液,写出此反应的离子方程式_____________
2.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至恰好不再产生沉淀为止,写出反应的离子方程式___________
在以上溶液中继续滴加NaHSO4溶液,写出此反应的离子方程式____________1.氯气的性质,制法,用途(1)物理性质:黄绿色、有刺激性气味的有毒气体能溶于水 1:2(2)化学性质a、与金属的反应b、与非金属单质的反应(H2)c 、与水的反应d、氧化性(3)工业制法:电解饱和食盐水某工厂发生氯气钢瓶泄露事件:
(1)如果你当时在现场,应该往哪里撤离?(山坡上/低洼处)
(2)应该准备什么样的简易”防毒面具”避免吸入较多的氯气?
(3)如何利用家中现成的物质来制简易”防毒面具”
(4)他们发现泄露的氯气钢瓶,投入剩有某物质溶液中,该物质是_____
(5)对于弥漫在空气中的氯气,消防队员喷洒一种挥发性的化学物质处理.其化学物质是什么?A B C D发生装置-----除杂装置—干燥装置--收集装置--吸收装置实验室制法图看教材P40的实验室制备氯气的装置图
(1)写出圆底烧瓶中发生的离子方程式
(2)实验前必须检查气密性,如何检查?
(3)如果将过量的二氧化锰与20ml 12mol/L的盐酸混合加热,充分反应生成氢气的物质的量明显小于0.01mol ,其主要原因1________2_______
(4)为了提高浓盐酸的利用率,你对实验的建议有1________ 2_______
(5)实验结束时,为了减少烧瓶中残留氯对环境的影响,可以向烧瓶中加入的溶液是_________有关离子方程式____________(6)兴趣小组的同学在烧杯中加入下列溶液中的一种溶液吸收氯气,你认为其中错误的是________
A.氢氧化钠 B.碳酸钠
C.浓硫酸 D.亚硫酸钠溶液1.新制氯水呈____色,可以说明_______存在
2.氯水的PH值_____水,说明氯水呈____性
3.向氯水中滴加紫色石蕊试液产生的现象是_________,可以说明氯水中存在_______微粒
4.在氯水中加入AgNO3溶液,产生的现象_________说明存在_______微粒
5.可以用钢瓶来存在液氯,为了防止钢瓶的腐蚀,冲入氯气前必须_____2.氯水的成分及探究三分子四离子HClO的性质: 强氧化性(表现出漂白性,杀菌,消毒):不稳定易分解:能使有机色素褪色一元弱酸:特性溴、碘均易溶于有机溶剂(CCl4、酒精、汽油、苯)3、溴.碘的物理性质特点CCl4Cl2KI碘水(棕黄色)下层:碘的四氯
化碳溶液(紫红色) 溴与碘的性质及萃取实验1、从海水中提取溴主要原理:Cl2+2NaBr====2NaCl+Br2步骤:①向海水中通入Cl2,使NaBr氧化(化学方程式)
②向所得溶液中鼓入热空气,将Br2吹出得粗溴,用纯
碱吸收,生成NaBr和NaBrO3
③将②中所得的溶液中加硫酸酸化,使NaBr、NaBrO3转化为溴4、钠a、物理性质:b、化学性质:c、提取钠:电解熔融的NaCl与水反应的现象:浮、熔、游、嘶、红Na2O2的性质:2Na2O2+2H2O= 4NaOH+ O2 ↑2Na2O2+2CO2= 2NaCO3+ O2 ↑碳酸钠和碳酸氢钠的比较 Na2CO3NaHCO3纯碱 苏打小苏打白色粉末白色晶体易溶于水相同温度下,比碳酸钠溶解度小剧烈Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O较稳定不稳定☆☆碱性相同浓度下,比碳酸钠 碱性弱与同浓度盐酸反应,比碳酸钠剧烈16. 向100g 8%烧碱溶液中通入一定量的CO2,将溶液在
低温下蒸干得固体产物10g,则该固体可能是 ( )
A、Na2CO3 B、NaHCO3
C、Na2CO3和NaHCO3 D、Na2CO3和NaOH17. 将0.5mol金属钠投入到足量水中,得到溶液a;将
0.5molMg投入到与水等质量的足量盐酸中,得溶液b,
则a和b的质量关系为 ( )
A、a=b B、a>b C、a HCl的盐酸中,或将1L含91.2gHCl的盐酸慢慢滴入
1L含212gNa2CO3的纯碱溶液中。这两种操作,在理论
上产生气体的质量比(不考虑气体在水中的溶解)是
A、1:1 B、2:5 C、2:1 D、5:2将CO2通入氨水的NaCl饱和溶液中,使溶解度较小的NaHCO3从溶液中析出,再加热析出的晶体即得纯碱。NaCl+NH3+CO2+H2O===NaHCO3+NH4Cl侯氏制碱法AlCl3NaAlO2Al(OH)3NaOH 或NH3.H2ONaOHHCl或CO2 +H2OHClAl2O3AlNaOH +H2OHClNaOH △HCl或Cl2或CuCl2电解O2或Fe2O316.往100mL 0.1mol/L的硫酸铝溶液中,加入浓度为
0.5mol/L的氢氧化钠溶液,当生成白色沉淀1.17g时,
加入氢氧化钠溶液的体积是 ( )
A. 130 mL B. 120 mL C. 90 mL D. 80 mL18.将10.2g镁铝合金粉末溶于4mol/L的盐酸400mL里,
加入2mol/L的氢氧化钠溶液,使得到的沉淀达到
最大值,则需氢氧化钠溶液的体积是 ( )
A.500mL B.800mL
C.1000mL D.1200mL35.将一定量的镁铝合金溶解在500ml 盐
酸中,然后取出10mL溶液,向其中加入1mol/L
的NaOH溶液,加入NaOH溶液时产生的沉淀
的质量m与所加NaOH溶液的体积V的
关系如右图所示。求:
(1)合金中镁和铝的质量。
(2)盐酸的物质的量浓度。
(设合金溶解后溶液的体积不变)2 14 16 V(mL)
m(g)36.把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于
足量的水中,产生1.16g沉淀,再向所得浊液中逐滴
加入1.00mol/LHCl,加入HCl溶液的体积与生成沉淀
的关系如右图所示。试回答: (1)A点的沉淀物的化学式为
理由是
(2)写出A点至B点发生反应的离子方程
(3)原混合物中AlCl3的物质的量为 mol
( 4)C点所加入的盐酸的体积为 mL
6、铁a、物理性质:硬度小、熔点沸高,导电导热性良好、
能被磁体吸引,具铁磁性b、化学性质:铁三角②加KSCN :c、Fe2+与Fe3+鉴别①观色法:④加碱:浅绿色的是Fe2+ ,黄色的是Fe3+ 加KSCN变血红色的是Fe3+③加淀粉碘化钾:试纸变蓝色的是Fe3+弱氧化剂:S、 Cu2+、HCl强氧化剂:Cl2、Br2Cl2、Br2、HNO3、浓H2SO4Fe、Cu、I-C、CO、H2、Al C、CO、H2、Al铁三角1、金属阳离子作为氧化剂在参加氧化还原反应时一定被还原成金属单质吗?2、如果金属A能和金属B的阳离子反应,则A比B活泼,对吗?为什么?3、根据所学知识你知道Fe2+、Fe3+、Cu2+的氧化性强弱顺序吗?4、如何防止Fe2+转化成Fe3+?a、加铁
b、尽量排尽溶液中的O2
c、在反应液上加一层保护层(汽油)9、现有一FeCl2、FeCl3、CuSO4的混合溶液,加入一定量的铁粉,按下列情况填空:
(1)反应完毕后Fe粉有剩余,则溶液中一定含有的阳离子是 ,一定没有的阳离子是 ;
(2)反应完毕后有铜粉无铁粉,则溶液中一定含有的阳离子是 ,可能含有的阳离子是 , 一定没有的阳离子是 ;
(3)反应完毕后无固体沉淀物存在,则反应后的溶液中一定含有的阳离子是 。Fe2+Cu2+、Fe3+Cu2+、Fe2+Fe2+Cu2+Fe3+3、10、23、346.有FeCl3和CuCl2的混合液,向其中加入Zn,充分反应后
(1)若溶液中没有任何固体析出,则溶液中一定有的阳离子是 ,可能有的阳离子是 .
(2)若溶液中仅有铜析出,则溶液中一定没有的阳离子是 ,可能有的阳离子是 .
(3)若溶液中有铁析出,则溶液中一定没有的阳离子是 . Fe2+、Cu2+、Zn2+Fe3+Fe3+Cu2+Fe3+、Cu2+4、工业炼铁a.设备:
b.原料:
c.炼制过程
d.产品:高炉铁矿石、焦炭、石灰石、空气生铁(约97%)——CO还原Fe2O3注意:
焦炭产生CO、提供温度
石灰石提供CO2、除SiO2MgCl2.6H2O 8、硅(1)、水泥3CaO·SiO2 2CaO·SiO2 3CaO·Al2O3石灰石、黏土a、生产原料:b、产品的成分:c、产品的特性:水硬性(2)、玻璃a、主要反应:
b、产品主要成分:
c、产品的特性:Na2O·CaO·6SiO2没有固定的熔点、有一定的膨胀系数(3)、硅a、物理性质:具有金属光泽、不溶于水的固体、
熔点高,硬度大、半导体
b、化学性质: 常温下能与强碱反应Si+2NaOH+H2O==== Na2SiO3 +2H2↑加热条件下能与氧气、氯气反应 性质很稳定,常温下与强酸、强氧化剂等都不反应(4)、二氧化硅a、物理性质:不溶于水的固体、熔点高、硬度大b、化学性质:与碱性氧化物、碱SiO2+2NaOH====Na2SiO3+H2O——典型的酸性氧化物高温下能被碳还原只与酸中的HF反应SiO2+4HF====SiF4↑+2H2O——HF能腐蚀玻璃 硅酸1、不稳定性(水玻璃在空气中变质)2、制法1、将足量的CO2通入Na2SiO3溶液中,然后对溶液加热蒸干,最后高温灼烧残留物,则该残留物是 。Na2SiO32、下列物质中属于硅酸盐产品的是 ,属于纯净物的是 ,制造光导的是 ,通常在建筑业中用作黏合剂的是 。
A、有机玻璃 B、石英 C、水泥
D、单晶硅 E、水玻璃 F、燧石
G、沙子CDBCE金属的腐蚀1、实质:2、分类:化学腐蚀金属或合金发生氧化还原反应电化学腐蚀:金属与周围物质接触直接发生的反应:不纯金属或合金与电解质溶液直接接
触发生的腐蚀注意:纯的金属不发生电化学腐蚀电化学腐蚀伴随电流的产生3、防腐方法a、覆盖保护层(涂油、刷漆、加塑料、搪瓷、钝化)b、改变金属内部结构(不锈钢)c、牺牲阳极的阴极保护法d、外加电流保护法(镀锌)1、下面铁被腐蚀由快到慢的顺序为 。
①镀锌 ②镀铅 ③与负极相连 ④与正极相连④<②<①<③
