3.4 难溶电解质的溶解平衡
文档属性
| 名称 | 3.4 难溶电解质的溶解平衡 |

|
|
| 格式 | rar | ||
| 文件大小 | 41.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-12-25 07:23:00 | ||
图片预览





文档简介
课件12张PPT。第四节
难溶电解质的溶解平衡一、Ag+ 和Cl– 的反应真能进行到底吗?【讨论】1、观察课本P65,表3—4,谈谈对部分酸、碱、盐
的溶解性表中的“溶”与“不溶”的理解。
2、难溶电解质的定义是什么?其溶解度是否为0?
3、根据对溶解度S及反应限度、化学平衡原理的认识,
说明生成沉淀的离子反应是否能真正进行到底?
4、当等物质的量的AgNO3与NaCl反应生成AgCl时,
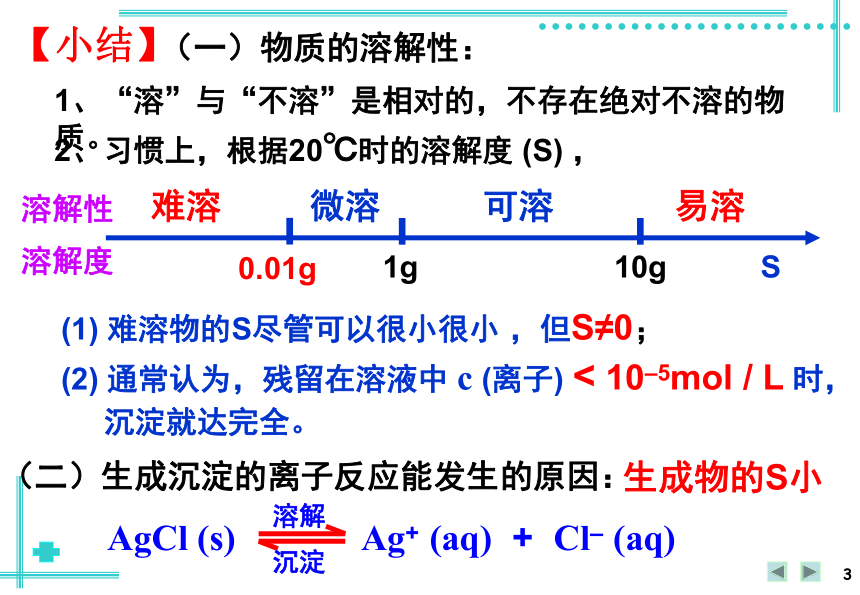
溶液中是否含有Ag+ 和Cl– ?实验3-4【小结】1、“溶”与“不溶”是相对的,不存在绝对不溶的物质。2、习惯上,根据20℃时的溶解度 (S) ,0.01g1g10gS难溶微溶可溶易溶(1) 难溶物的S尽管可以很小很小 ,但S≠0;(2) 通常认为,残留在溶液中 c (离子) < 10–5mol / L 时,
沉淀就达完全。(二)生成沉淀的离子反应能发生的原因:生成物的S小(一)物质的溶解性:溶解性
溶解度AgCl (s) Ag+ (aq) + Cl– (aq)溶解沉淀(三) 难溶电解质的溶解平衡1、定义: 在一定条件下,当难溶电解质的溶解速率与有关
离子重新生成沉淀的速率相等时,即v(溶解) = v(沉淀)
此时溶液中各粒子的浓度、百分含量保持不变的状态。
(也称为沉淀的溶解平衡) 溶解平衡时的溶液是饱和溶液。2、表达式:AmBn (s) m An+ (aq) + n Bm– (aq)3、溶解平衡的特征:逆、等、动、定、变溶解沉淀如:AgCl (s) Ag+ (aq) + Cl– (aq)4、影响溶解平衡的因素: 内因:
外因:电解质本身的性质。① 浓度:加水,平衡向 方向移动。溶解② 温度:升温,多数平衡向 方向移动。溶解【练习】 《优化》P74,题4、5如:升高温度AgCl溶解度增大,
而CaSO4、Ca(OH)2溶解度降低。遵循平衡移动原理。 石灰乳中存在如下沉淀的溶解平衡:
Ca(OH)2(s) Ca2+(aq) + 2OH– (aq) ,加入
下列溶液,可使Ca(OH)2(s)减少的是( )
A、Na2CO3溶液 B、AlCl3溶液
C、NaOH溶液 D、CaCl2溶液AB【练习1】 难溶电解质的溶解平衡,也遵循平衡移动原理。
跟其它平衡一样,也有平衡常数。5、溶度积(平衡常数):K sp1) 溶度积表达式:K sp=·只与温度有关。2) 溶度积规则:任意时刻有,离子积Q c=Qc > Ksp,溶液 ,过饱和析出沉淀Qc = Ksp,溶液 ,饱和平衡状态Qc < Ksp,溶液 ,未饱和沉淀发生溶解《优化》
P74—75,
7、8、11、121、如何处理工业废水中的Fe3+ ?
2、如何检验溶液中含有Cl– ?
3、如何除去NaCl溶液中的Na2SO4杂质?【思考与交流】二、沉淀溶解平衡的应用1、沉淀的生成⑴ 条件:
⑵ 常用方法:Qc > Ksp①调节pH法 ②加沉淀剂法生成物的Ksp越小越好!如:工业原料氯化铵中混有氯化铁,加氨水调pH值
至7-8。二、沉淀溶解平衡的应用1、沉淀的生成⑴ 条件:
⑵ 常用方法:Qc > Ksp①调节pH法 ②加沉淀剂法生成物的Ksp越小越好!如:工业原料氯化铵中混有氯化铁,加氨水调pH值
至7-8。Fe3+ + 3NH3? H2O == Fe(OH)3↓+ 3NH4 +如:沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂。Cu 2+ + S2– == CuS↓Hg 2+ + S2– == HgS↓【思考与交流】1、如果要除去某溶液中的SO42–,你选择加入钡盐
还是钙盐?为什么?加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42–沉淀更完全2、以你现有的知识,你认为判断沉淀能否生成可
从哪方面考虑?是否可能使要除去的离子通过
沉淀反应全部除去?说明原因。从溶解度方面可判断沉淀能否生成。
不可能使要除去的离子通过沉淀完全除去。 要除去MgCl2酸性溶液中少量的FeCl3,
不宜选用的试剂是( )
A、MgO B、MgCO3
C、NaOH D、Mg(OH)2【练习2】C【能力提升】利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作
内服造影剂,这种手段称为钡餐透视。
(1)医学上进行钡餐透视时为什么不用BaCO3?
(用离子方程式表示) (2)某课外小组为了探究BaSO4的溶解度,分别将BaSO4放入:① 5ml水 ?②40ml0.2mol/L氢氧化钡溶液 ?③20ml0.5mol/L的硫酸溶液 ? ④40ml0.1mol/L的硫酸钠溶液中,溶解至饱和。
以上个溶液中,Ba2+ 的浓度由大到小的顺序为( )
A、② > ①> ③ > ④ ? B、② > ① > ④ > ③?
C、① > ④ > ③ > ②? D、① > ② > ④ > ③? BaCO3+ 2H+ = Ba2+ + CO2↑+ H2OB
难溶电解质的溶解平衡一、Ag+ 和Cl– 的反应真能进行到底吗?【讨论】1、观察课本P65,表3—4,谈谈对部分酸、碱、盐
的溶解性表中的“溶”与“不溶”的理解。
2、难溶电解质的定义是什么?其溶解度是否为0?
3、根据对溶解度S及反应限度、化学平衡原理的认识,
说明生成沉淀的离子反应是否能真正进行到底?
4、当等物质的量的AgNO3与NaCl反应生成AgCl时,
溶液中是否含有Ag+ 和Cl– ?实验3-4【小结】1、“溶”与“不溶”是相对的,不存在绝对不溶的物质。2、习惯上,根据20℃时的溶解度 (S) ,0.01g1g10gS难溶微溶可溶易溶(1) 难溶物的S尽管可以很小很小 ,但S≠0;(2) 通常认为,残留在溶液中 c (离子) < 10–5mol / L 时,
沉淀就达完全。(二)生成沉淀的离子反应能发生的原因:生成物的S小(一)物质的溶解性:溶解性
溶解度AgCl (s) Ag+ (aq) + Cl– (aq)溶解沉淀(三) 难溶电解质的溶解平衡1、定义: 在一定条件下,当难溶电解质的溶解速率与有关
离子重新生成沉淀的速率相等时,即v(溶解) = v(沉淀)
此时溶液中各粒子的浓度、百分含量保持不变的状态。
(也称为沉淀的溶解平衡) 溶解平衡时的溶液是饱和溶液。2、表达式:AmBn (s) m An+ (aq) + n Bm– (aq)3、溶解平衡的特征:逆、等、动、定、变溶解沉淀如:AgCl (s) Ag+ (aq) + Cl– (aq)4、影响溶解平衡的因素: 内因:
外因:电解质本身的性质。① 浓度:加水,平衡向 方向移动。溶解② 温度:升温,多数平衡向 方向移动。溶解【练习】 《优化》P74,题4、5如:升高温度AgCl溶解度增大,
而CaSO4、Ca(OH)2溶解度降低。遵循平衡移动原理。 石灰乳中存在如下沉淀的溶解平衡:
Ca(OH)2(s) Ca2+(aq) + 2OH– (aq) ,加入
下列溶液,可使Ca(OH)2(s)减少的是( )
A、Na2CO3溶液 B、AlCl3溶液
C、NaOH溶液 D、CaCl2溶液AB【练习1】 难溶电解质的溶解平衡,也遵循平衡移动原理。
跟其它平衡一样,也有平衡常数。5、溶度积(平衡常数):K sp1) 溶度积表达式:K sp=·只与温度有关。2) 溶度积规则:任意时刻有,离子积Q c=Qc > Ksp,溶液 ,过饱和析出沉淀Qc = Ksp,溶液 ,饱和平衡状态Qc < Ksp,溶液 ,未饱和沉淀发生溶解《优化》
P74—75,
7、8、11、121、如何处理工业废水中的Fe3+ ?
2、如何检验溶液中含有Cl– ?
3、如何除去NaCl溶液中的Na2SO4杂质?【思考与交流】二、沉淀溶解平衡的应用1、沉淀的生成⑴ 条件:
⑵ 常用方法:Qc > Ksp①调节pH法 ②加沉淀剂法生成物的Ksp越小越好!如:工业原料氯化铵中混有氯化铁,加氨水调pH值
至7-8。二、沉淀溶解平衡的应用1、沉淀的生成⑴ 条件:
⑵ 常用方法:Qc > Ksp①调节pH法 ②加沉淀剂法生成物的Ksp越小越好!如:工业原料氯化铵中混有氯化铁,加氨水调pH值
至7-8。Fe3+ + 3NH3? H2O == Fe(OH)3↓+ 3NH4 +如:沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂。Cu 2+ + S2– == CuS↓Hg 2+ + S2– == HgS↓【思考与交流】1、如果要除去某溶液中的SO42–,你选择加入钡盐
还是钙盐?为什么?加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42–沉淀更完全2、以你现有的知识,你认为判断沉淀能否生成可
从哪方面考虑?是否可能使要除去的离子通过
沉淀反应全部除去?说明原因。从溶解度方面可判断沉淀能否生成。
不可能使要除去的离子通过沉淀完全除去。 要除去MgCl2酸性溶液中少量的FeCl3,
不宜选用的试剂是( )
A、MgO B、MgCO3
C、NaOH D、Mg(OH)2【练习2】C【能力提升】利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作
内服造影剂,这种手段称为钡餐透视。
(1)医学上进行钡餐透视时为什么不用BaCO3?
(用离子方程式表示) (2)某课外小组为了探究BaSO4的溶解度,分别将BaSO4放入:① 5ml水 ?②40ml0.2mol/L氢氧化钡溶液 ?③20ml0.5mol/L的硫酸溶液 ? ④40ml0.1mol/L的硫酸钠溶液中,溶解至饱和。
以上个溶液中,Ba2+ 的浓度由大到小的顺序为( )
A、② > ①> ③ > ④ ? B、② > ① > ④ > ③?
C、① > ④ > ③ > ②? D、① > ② > ④ > ③? BaCO3+ 2H+ = Ba2+ + CO2↑+ H2OB
