水的电离和溶液酸碱性
图片预览






文档简介
课件16张PPT。第二节
水的电离和溶液的酸碱性【知识回顾】1、什么是pH?
室温下,酸性的pH_______;
中性的pH_______;
碱性的pH_______。
2、室温下,水的pH_______;
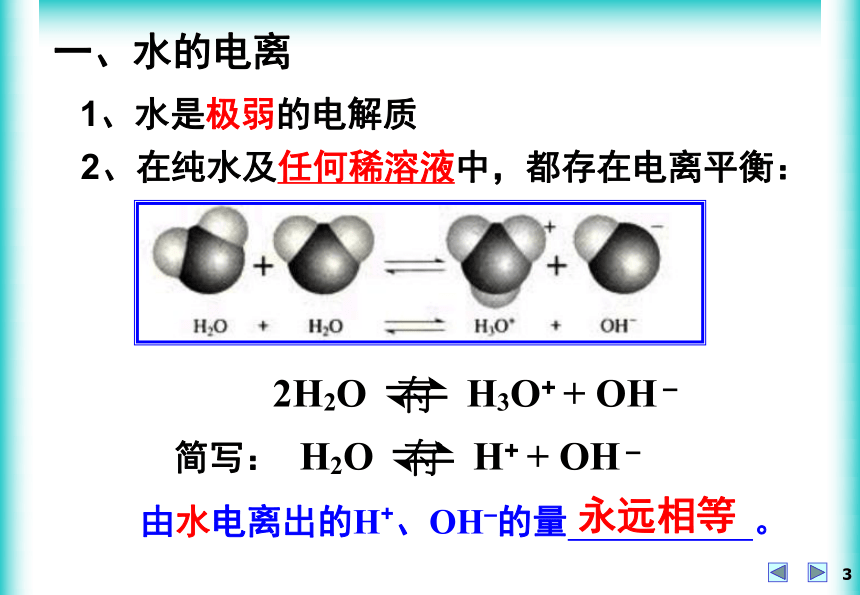
水中有没有H +、OH – ?pH = – lg c (H+) < 7> 7= 7= 7都有一、水的电离1、水是极弱的电解质2、在纯水及任何稀溶液中,都存在电离平衡:由水电离出的H+、OH–的量 。永远相等一、水的电离1、水是极弱的电解质2、在纯水及任何稀溶液中,都存在电离平衡:K电离=c ( H+ )c ( OH – )·c(H2O)P45
精确实验K电离c(H2O)·=c ( H+ )c ( OH – )·Kwater=c ( H+ )c ( OH – )·水的离子积(常数)3、水的离子积KwKw=c ( H+ )c ( OH – )·25℃时,c(H+) = c(OH– ) = 10 – 7mol·L–1
故 Kw =100℃时,c(H+) = c(OH– ) = 10 – 6mol·L–1
故 Kw =10 – 1410 – 12Kw只与温度有关!P46表3-2⑴ 表达式:⑵ 影响因素:升温, Kw增大熟记113、水的离子积KwKw=c ( H+ )c ( OH – )·Kw只与温度有关!⑴ 表达式:⑵ 影响因素:⑶ 注意:① Kw适用于纯水和任何稀的水溶液。只要温度一定, Kw是一个常数。② Kw中的 与 分别是溶液中的总浓度。c ( H+ )c ( OH – )③ 由水电离的 与 永远相等。H+OH –升温,Kw增大④ 对于纯水,尽管升温,电离程度增大,Kw增大,
但仍是中性水。【问题与讨论】3、在水中加入盐酸后,水的离子积是否发生改变?4、在水中加入强碱后,水的离子积是否发生改变?5、在酸碱溶液中,水电离出来的[H+]和[OH– ]是否相等?6、100℃时,水的离子积为10—12,求[H+]为多少?7、室温下,0.1mol / L 盐酸溶液中,求:
(1)溶液中 c ( H+ ) 和 c ( OH – ) ;
(2)水电离出的c ( H+ ) 和 c ( OH – ) 。1、含H+的溶液一定是酸,含OH–的溶液一定是碱?
2、任何酸溶液中只含H+ ,任何碱溶液中只含OH–吗?8、室温下,0.1mol / L NaOH溶液中呢?【练习】水的电离过程为 H2O H+ + OH –,在25℃、35℃时其离子积分别为K(25℃) = 1.0×10 –14 ,K(35℃) = 2.1×10 –14 。则下列叙述正确的( )
A. c(H+)随着温度升高而降低
B. 在35℃时,纯水中 c (H+) > c (OH –)
C. 水的电离度 α (25℃) > α (35℃)
D. 水的电离过程是吸热过程D讨论:对室温下的纯水进行下列操作,完成下表: 中性→↑↑=↑碱性→↓↑<↑酸性←↑↓>不变碱性←↓↑<不变【小结】升温or加极活泼金属,促进水的电离;
加入酸or碱,都抑制水的电离。4、影响水的电离平衡及Kw的因素⑴ 温度:升温,促进电离,Kw增大。已知100℃时 Kw=10–12,则该纯水中的c(H+)等于多少?⑵ 浓度:① 加入极活泼金属,c(H+)↓
T↑促进电离,Kw增大。② T不变,加入酸或碱,抑制水的电离,Kw不变。③ T不变,加入CH3COONa 或 NH4Cl,∵CH3COO–和NH4+ 等“弱离子”与水电离出的H+和OH –
结合成弱电解质,∴能促进水的电离,但Kw不变。④ T不变,加入NaCl ?无影响5、利用Kw的定量计算⑴ 求溶液中的 c (H+) 或 c (OH–)1) 判断正误:
①任何水溶液中都存在水的电离平衡。
②任何水溶液中(不论酸、碱或中性)都存在Kw = 10–14 。
③某温度下,某液体c(H+)= 10–7mol/L,则该溶液一定是纯水。 √××2) 0.01mol/L盐酸溶液中,c(H+)、c(OH–)分别为多少?c(H+) = 0.01mol/Lc(OH–) = 0.01mol/L3) 0.01mol/L NaOH溶液中,c(H+)、c(OH–)分别为多少?c(OH–) = KW / c(H+) = 10–12 mol/L c(H+) = KW / c(OH–) = 10–12 mol/L4) 25℃:A、B、C 三种溶液,其中
A中c(H+) = 10–3mol/L ,B中c(OH–) = 5?10–7mol/L,
C中c(H+) / c(OH–) = 106,则三种溶液的酸性强弱顺序
如何?
5) 25℃、浓度均为0.1mol/L的下列溶液中c(H+)由大到小
的排列顺序:①氨水 ②NaOH ③盐酸 ④醋酸∴ 酸性:A > C > B∵ B中c(H+) = KW / c(OH–) =2 ? 10–8mol/L C中c(H+) = 10–4mol/L ③ > ④ > ① > ②5、利用Kw的定量计算⑵ 求由水电离的 c (H+)水 或 c (OH–)水思考
0.01mol/L盐酸溶液中,由水电离的c(H+)水、c(OH–)水
分别是多少?为什么?
2) 0.01mol/L NaOH溶液中,由水电离的c(H+)水、c(OH–)水
分别是多少?为什么? c(OH–)水 = KW / c(H+) = 10–12 mol/L c(H+)水 =c(H+)水 = KW / c(OH–) = 10–12 mol/Lc(OH–)水 =计算
1、某溶液中由水电离产生的c(H+)水= 10–12 mol/L ,则该
溶液呈酸性还是碱性?并求该溶液中 c(H+) 的可能值 ?2、浓度均为0.1mol/L的下列溶液中,由水电离出
的c(H+)水大小关系为:①盐酸 ②醋酸溶液
③硫酸溶液 ④氢氧化钠溶液 解答: c(H+)水 = c(OH–)水 = 10–12 mol/L
若 c(H+)aq = c(H+)水 = 10–12 mol/L
则 c(OH–)aq = 10–2 mol/L 溶液显碱性;
若 c(OH–) aq = c(OH–)水 = 10–12 mol/L
则 c(H+) aq = 10–2 mol/L 溶液显酸性。② > ① = ④ > ③判断:
1. 任何水溶液中都存在KW = 10–14。
2. 某水溶液中c(H+) =10–6 一定是酸性溶液。
3. 向纯水中加入溶质,水的电离平衡将逆向移动。
4. 如果由水电离出的H+浓度为10–10,则KW =10–20【练习】××××1、常温下,10 – 4 mol/L 的盐酸溶液:
溶液中, c(OH–) =________mol/L;
将上述盐酸稀释10倍,溶液中 c(H+) =_____ mol/L 、
c(OH–) =_____ mol/L 。
将上述溶液稀释10000倍,溶液中c(H+) =_________ 、
c(OH–) =__________ 。
2、常温下,某溶液中由水电离出的H+和OH–浓度的乘积
为1×10–24,该溶液的c(H+)可能为
_______________________________ 10–10接近10–710–12 mol/L 或 10–2 mol/L 【练习】计算:10–510–9接近10–7
水的电离和溶液的酸碱性【知识回顾】1、什么是pH?
室温下,酸性的pH_______;
中性的pH_______;
碱性的pH_______。
2、室温下,水的pH_______;
水中有没有H +、OH – ?pH = – lg c (H+) < 7> 7= 7= 7都有一、水的电离1、水是极弱的电解质2、在纯水及任何稀溶液中,都存在电离平衡:由水电离出的H+、OH–的量 。永远相等一、水的电离1、水是极弱的电解质2、在纯水及任何稀溶液中,都存在电离平衡:K电离=c ( H+ )c ( OH – )·c(H2O)P45
精确实验K电离c(H2O)·=c ( H+ )c ( OH – )·Kwater=c ( H+ )c ( OH – )·水的离子积(常数)3、水的离子积KwKw=c ( H+ )c ( OH – )·25℃时,c(H+) = c(OH– ) = 10 – 7mol·L–1
故 Kw =100℃时,c(H+) = c(OH– ) = 10 – 6mol·L–1
故 Kw =10 – 1410 – 12Kw只与温度有关!P46表3-2⑴ 表达式:⑵ 影响因素:升温, Kw增大熟记113、水的离子积KwKw=c ( H+ )c ( OH – )·Kw只与温度有关!⑴ 表达式:⑵ 影响因素:⑶ 注意:① Kw适用于纯水和任何稀的水溶液。只要温度一定, Kw是一个常数。② Kw中的 与 分别是溶液中的总浓度。c ( H+ )c ( OH – )③ 由水电离的 与 永远相等。H+OH –升温,Kw增大④ 对于纯水,尽管升温,电离程度增大,Kw增大,
但仍是中性水。【问题与讨论】3、在水中加入盐酸后,水的离子积是否发生改变?4、在水中加入强碱后,水的离子积是否发生改变?5、在酸碱溶液中,水电离出来的[H+]和[OH– ]是否相等?6、100℃时,水的离子积为10—12,求[H+]为多少?7、室温下,0.1mol / L 盐酸溶液中,求:
(1)溶液中 c ( H+ ) 和 c ( OH – ) ;
(2)水电离出的c ( H+ ) 和 c ( OH – ) 。1、含H+的溶液一定是酸,含OH–的溶液一定是碱?
2、任何酸溶液中只含H+ ,任何碱溶液中只含OH–吗?8、室温下,0.1mol / L NaOH溶液中呢?【练习】水的电离过程为 H2O H+ + OH –,在25℃、35℃时其离子积分别为K(25℃) = 1.0×10 –14 ,K(35℃) = 2.1×10 –14 。则下列叙述正确的( )
A. c(H+)随着温度升高而降低
B. 在35℃时,纯水中 c (H+) > c (OH –)
C. 水的电离度 α (25℃) > α (35℃)
D. 水的电离过程是吸热过程D讨论:对室温下的纯水进行下列操作,完成下表: 中性→↑↑=↑碱性→↓↑<↑酸性←↑↓>不变碱性←↓↑<不变【小结】升温or加极活泼金属,促进水的电离;
加入酸or碱,都抑制水的电离。4、影响水的电离平衡及Kw的因素⑴ 温度:升温,促进电离,Kw增大。已知100℃时 Kw=10–12,则该纯水中的c(H+)等于多少?⑵ 浓度:① 加入极活泼金属,c(H+)↓
T↑促进电离,Kw增大。② T不变,加入酸或碱,抑制水的电离,Kw不变。③ T不变,加入CH3COONa 或 NH4Cl,∵CH3COO–和NH4+ 等“弱离子”与水电离出的H+和OH –
结合成弱电解质,∴能促进水的电离,但Kw不变。④ T不变,加入NaCl ?无影响5、利用Kw的定量计算⑴ 求溶液中的 c (H+) 或 c (OH–)1) 判断正误:
①任何水溶液中都存在水的电离平衡。
②任何水溶液中(不论酸、碱或中性)都存在Kw = 10–14 。
③某温度下,某液体c(H+)= 10–7mol/L,则该溶液一定是纯水。 √××2) 0.01mol/L盐酸溶液中,c(H+)、c(OH–)分别为多少?c(H+) = 0.01mol/Lc(OH–) = 0.01mol/L3) 0.01mol/L NaOH溶液中,c(H+)、c(OH–)分别为多少?c(OH–) = KW / c(H+) = 10–12 mol/L c(H+) = KW / c(OH–) = 10–12 mol/L4) 25℃:A、B、C 三种溶液,其中
A中c(H+) = 10–3mol/L ,B中c(OH–) = 5?10–7mol/L,
C中c(H+) / c(OH–) = 106,则三种溶液的酸性强弱顺序
如何?
5) 25℃、浓度均为0.1mol/L的下列溶液中c(H+)由大到小
的排列顺序:①氨水 ②NaOH ③盐酸 ④醋酸∴ 酸性:A > C > B∵ B中c(H+) = KW / c(OH–) =2 ? 10–8mol/L C中c(H+) = 10–4mol/L ③ > ④ > ① > ②5、利用Kw的定量计算⑵ 求由水电离的 c (H+)水 或 c (OH–)水思考
0.01mol/L盐酸溶液中,由水电离的c(H+)水、c(OH–)水
分别是多少?为什么?
2) 0.01mol/L NaOH溶液中,由水电离的c(H+)水、c(OH–)水
分别是多少?为什么? c(OH–)水 = KW / c(H+) = 10–12 mol/L c(H+)水 =c(H+)水 = KW / c(OH–) = 10–12 mol/Lc(OH–)水 =计算
1、某溶液中由水电离产生的c(H+)水= 10–12 mol/L ,则该
溶液呈酸性还是碱性?并求该溶液中 c(H+) 的可能值 ?2、浓度均为0.1mol/L的下列溶液中,由水电离出
的c(H+)水大小关系为:①盐酸 ②醋酸溶液
③硫酸溶液 ④氢氧化钠溶液 解答: c(H+)水 = c(OH–)水 = 10–12 mol/L
若 c(H+)aq = c(H+)水 = 10–12 mol/L
则 c(OH–)aq = 10–2 mol/L 溶液显碱性;
若 c(OH–) aq = c(OH–)水 = 10–12 mol/L
则 c(H+) aq = 10–2 mol/L 溶液显酸性。② > ① = ④ > ③判断:
1. 任何水溶液中都存在KW = 10–14。
2. 某水溶液中c(H+) =10–6 一定是酸性溶液。
3. 向纯水中加入溶质,水的电离平衡将逆向移动。
4. 如果由水电离出的H+浓度为10–10,则KW =10–20【练习】××××1、常温下,10 – 4 mol/L 的盐酸溶液:
溶液中, c(OH–) =________mol/L;
将上述盐酸稀释10倍,溶液中 c(H+) =_____ mol/L 、
c(OH–) =_____ mol/L 。
将上述溶液稀释10000倍,溶液中c(H+) =_________ 、
c(OH–) =__________ 。
2、常温下,某溶液中由水电离出的H+和OH–浓度的乘积
为1×10–24,该溶液的c(H+)可能为
_______________________________ 10–10接近10–710–12 mol/L 或 10–2 mol/L 【练习】计算:10–510–9接近10–7
