二氧化硫的性质和应用
图片预览






文档简介
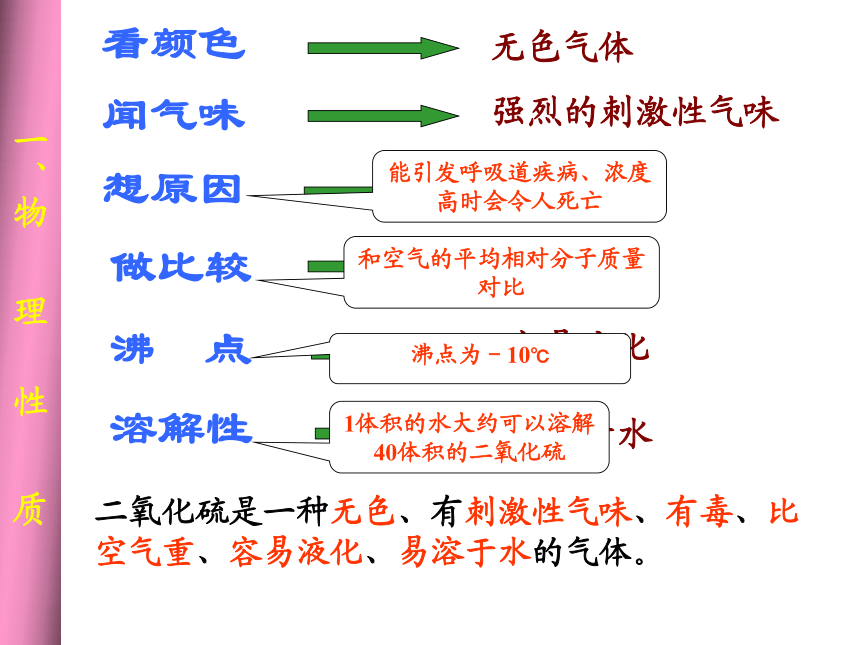
课件20张PPT。二氧化硫的性质和作用 一、物 理 性 质看颜色想原因闻气味做比较溶解性沸 点能引发呼吸道疾病、浓度高时会令人死亡和空气的平均相对分子质量对比沸点为-10℃1体积的水大约可以溶解40体积的二氧化硫二氧化硫是一种无色、有刺激性气味、有毒、比 空气重、容易液化、易溶于水的气体。 课堂习题 1 常温常压下,下列气体溶解度由大到小的顺序为:
(1)SO2 (2) O2 (3)HCl (4)Cl2 HCl > SO2 > Cl2 > O2二、SO2的化学性质2、氧化性:
2H2S + SO2 = 3S↓ + 2H2O3、还原性: SO2 + Br2 + 2H2O = H2SO4 + 2HBr
☆5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
2SO2 + O2 2SO3(无色固体,与水反应生成硫酸)4、漂白性:与有色物质结合生成无色不稳定物质,易分解。1、具有酸性氧化物通性
SO2 + H2O H2SO3 2NaOH + SO2 = Na2SO3 + H2O
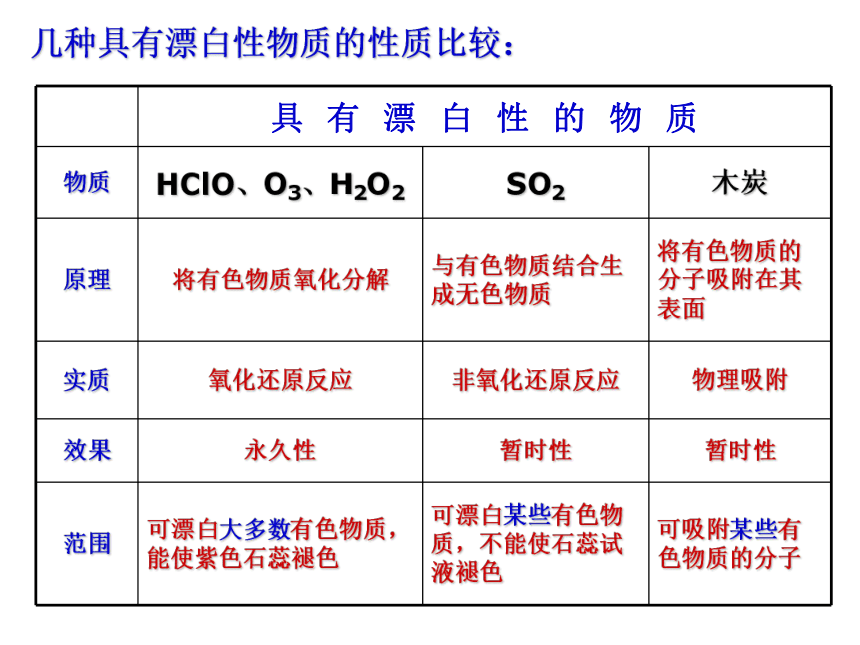
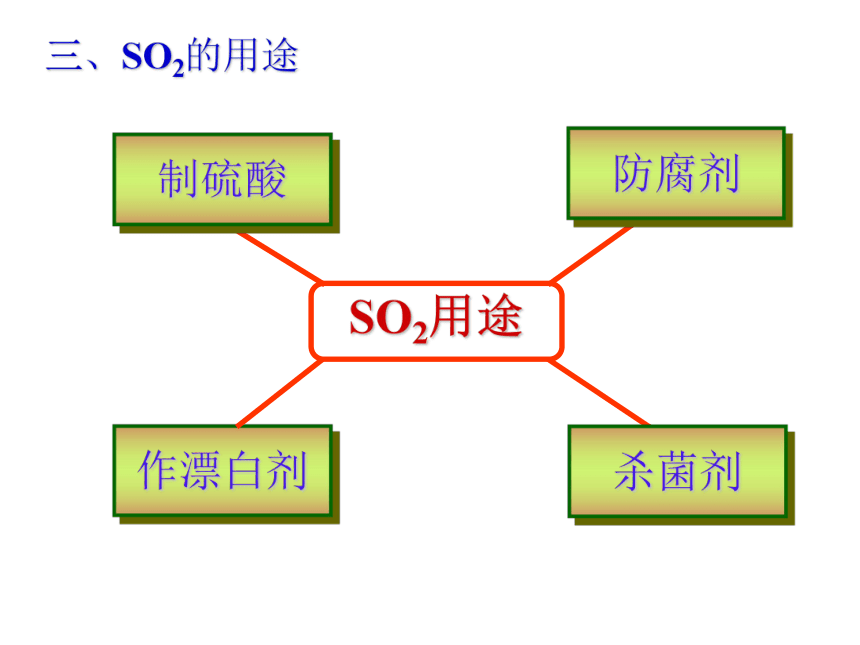
SO2 + CaO == CaSO3SO2 + H2O2 == H2SO4几种具有漂白性物质的性质比较:三、SO2的用途 由于溶解了二氧化碳的缘故,正常雨水的PH在5.6左右,然而,当空气中大量N和S的氧化物随雨水降落下来就会使得雨水的PH小于5.6而形成酸雨。正常雨水的PH在5.6左右,酸雨的PH小于5.6自然和人为因素向大气中排放的污染物酸性污染物自然来源人为来源湿沉降干沉降大气污染 — 酸雨的形成酸雨对环境的危害总结SO2与H2O反应与碱反应氧化性还原性重视环境保护,防止酸雨危害环境!H2SO4Na2SO3石灰水溴水KMnO4溶液品红NaOH溶液思考:
1、发生装置与制Cl2有什么不同?为何有这种不同?
2、尾气处理装置与Cl2的有什么不同?为什么?实验现象及解释:1、石灰水变浑浊,持续通入,溶液又变澄清。2、溴水橙色褪去,滴加BaCl2,生成不溶于HNO3白色沉淀。3、KMnO4溶液的紫红色褪色。4、品红溶液红色褪色,加热溶液,又恢复原来的红色。SO2能和Ca(OH)2反应,生成白色不溶物。SO2被Br2氧化,从而使溶液颜色消失。SO2具有还原性,被KMnO4氧化,溶液颜色褪去。SO2能和有色物质结合生成无色不稳定的物质,因此
具有漂白性。课堂习题 2下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D课堂习题 3 二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将 [ ]
A 、和氯气单独通过时相同 B、和二氧化硫单独通过时相同
C、是二者作用效果之和 D、可能失去漂白性D4 . 一个城市的环保部门采集了一份雨水样品,每隔一段时间
测定一次pH值,其结果如下:
1.请你写出酸雨开始呈酸性的化学方程式.
2.这种雨水的pH值逐渐减小,其原因何在?
(提示:从硫元素的化合价和酸性强弱方面考虑)SO2+H2O=H2SO3 SO3+H2O=H2SO4
O2+H2SO3= H2SO4 空气中的氧气能够逐渐将水中的H2SO3
氧化成强酸硫酸.课堂习题 4 工业革命以来,科学技术取得了前所未有的发展,使得人类的物质生活得到了极大的改善,我们也一直为在经济领域所取得的辉煌成就而无比自豪!
在称为“后工业时代”的今天,我们对经济发展的关注似乎比对环境保护的关注的程度要高得多,通过本节内容的学习我们了解到了酸雨带给自然的危害,如果我们再不注意保护环境,也许有一天,当我们环顾四周看到的可能就只是满目疮痍的大地,也许除了之外人类我们再没有别的朋友!结束语: 2CaSO3 +O2== 2CaSO4
(1)SO2 (2) O2 (3)HCl (4)Cl2 HCl > SO2 > Cl2 > O2二、SO2的化学性质2、氧化性:
2H2S + SO2 = 3S↓ + 2H2O3、还原性: SO2 + Br2 + 2H2O = H2SO4 + 2HBr
☆5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
2SO2 + O2 2SO3(无色固体,与水反应生成硫酸)4、漂白性:与有色物质结合生成无色不稳定物质,易分解。1、具有酸性氧化物通性
SO2 + H2O H2SO3 2NaOH + SO2 = Na2SO3 + H2O
SO2 + CaO == CaSO3SO2 + H2O2 == H2SO4几种具有漂白性物质的性质比较:三、SO2的用途 由于溶解了二氧化碳的缘故,正常雨水的PH在5.6左右,然而,当空气中大量N和S的氧化物随雨水降落下来就会使得雨水的PH小于5.6而形成酸雨。正常雨水的PH在5.6左右,酸雨的PH小于5.6自然和人为因素向大气中排放的污染物酸性污染物自然来源人为来源湿沉降干沉降大气污染 — 酸雨的形成酸雨对环境的危害总结SO2与H2O反应与碱反应氧化性还原性重视环境保护,防止酸雨危害环境!H2SO4Na2SO3石灰水溴水KMnO4溶液品红NaOH溶液思考:
1、发生装置与制Cl2有什么不同?为何有这种不同?
2、尾气处理装置与Cl2的有什么不同?为什么?实验现象及解释:1、石灰水变浑浊,持续通入,溶液又变澄清。2、溴水橙色褪去,滴加BaCl2,生成不溶于HNO3白色沉淀。3、KMnO4溶液的紫红色褪色。4、品红溶液红色褪色,加热溶液,又恢复原来的红色。SO2能和Ca(OH)2反应,生成白色不溶物。SO2被Br2氧化,从而使溶液颜色消失。SO2具有还原性,被KMnO4氧化,溶液颜色褪去。SO2能和有色物质结合生成无色不稳定的物质,因此
具有漂白性。课堂习题 2下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D课堂习题 3 二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将 [ ]
A 、和氯气单独通过时相同 B、和二氧化硫单独通过时相同
C、是二者作用效果之和 D、可能失去漂白性D4 . 一个城市的环保部门采集了一份雨水样品,每隔一段时间
测定一次pH值,其结果如下:
1.请你写出酸雨开始呈酸性的化学方程式.
2.这种雨水的pH值逐渐减小,其原因何在?
(提示:从硫元素的化合价和酸性强弱方面考虑)SO2+H2O=H2SO3 SO3+H2O=H2SO4
O2+H2SO3= H2SO4 空气中的氧气能够逐渐将水中的H2SO3
氧化成强酸硫酸.课堂习题 4 工业革命以来,科学技术取得了前所未有的发展,使得人类的物质生活得到了极大的改善,我们也一直为在经济领域所取得的辉煌成就而无比自豪!
在称为“后工业时代”的今天,我们对经济发展的关注似乎比对环境保护的关注的程度要高得多,通过本节内容的学习我们了解到了酸雨带给自然的危害,如果我们再不注意保护环境,也许有一天,当我们环顾四周看到的可能就只是满目疮痍的大地,也许除了之外人类我们再没有别的朋友!结束语: 2CaSO3 +O2== 2CaSO4
